МОДУЛЬ 1
Элементы количественного анализа. Способы выражения концентрации растворов. Химическая термодинамика и кинетика.
Занятие № 4
I. Тема: Химическая кинетика и равновесие.
II.Актуальность темы: Положения химической кинетики, которая изучает скорости и механизмы реакций, с успехом применяются для изучения биохимических процессов. Особенности течения биохимических процессов зависят от катализаторов; эффективность действия лекарственных веществ может быть связана со скоростью химических реакций, возникающих при этом в организме. Изучением кинетических закономерностей поступления, распределения и выведения из организма чужеродных химических соединений ксенобиотиков - занимаются специальные науки: фармако- и токсикокинетика. Следовательно, изучение кинетики и механизма химических реакций имеет большое теоретическое и практическое значение не только в химии, но и в биологии и медицине.
III. Цель: Сформировать системный подход к рассмотрению кинетики химических процессов и научиться производить расчеты скоростей химических реакций.
IV. Исходный уровень:
1. Понятие о скоростях химических реакций, факторы, от которых они зависят.
2. Обратимые и необратимые реакции.
3. Понятие о состоянии химического равновесия.
V.Учебно – целевые вопросы:
1. Обратимые и необратимые химические реакции.
2. Химическое равновесие и качественные характеристики состояния
химического равновесия.
3. Закон действующих масс (ЗДМ).
4. Константа химического равновесия и ее связь с энергией Гиббса.
5. Определения направления протекания реакции по константе равновесия.
6. Зависимость энергии Гиббса и константы равновесия от температуры.
|
|
7. Принцип ЛеШателье – Брауна.
VI. После изучения темы студент должен
знать:
- химическое равновесие, способы расчета констант равновесия
уметь:
- интерпретировать гомогенные и гетерогенные реакции, порядок и молекулярность реакций;
- рассчитывать скорость химических реакций на основании закона действующих масс и при изменении температуры;
- интерпретировать константу скорости реакции, ее физический смысл;
- интерпретировать понятие энергии активации, теорию активных столкновений, уравнение Аррениуса;
- трактовать константу равновесия на основании закона действующих масс для равновесной системы и направление смещения равновесия по принципу Ле – Шателье.
Литература:
1. Ю.А.Ершов, В.А.Попков, А.С. Берлянд. Общая химия. Биофизическая химия. Химия биогенных элементов. Под ред. Ершова Ю.А. 10 –е изд. перераб. и доп. 2014 г.560 с.
2. Попков В. А. Общая химия: учебник/ В. А. Попков, С. А. Пузаков. -М.: ГЭОТАР-Медиа, 2009. -976 с.: ил.
3.Учебное пособие по общей и неорганической химии для самостоятельной работы студентов 1 курса фармацевтического факультета. Оренбург, 2009.- с. 74 – 84.
Эталоны решения задач
Пример 1:
Определить как изменится скорость реакции 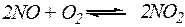 , если общее давление в системе уменьшить в 5 раз.
, если общее давление в системе уменьшить в 5 раз.
Решение:
Уменьшение давления в системе в 5 раз вызовет увеличение объема в 5 раз, а концентрация реагирующих веществ уменьшается в 5 раз. Начальная скорость реакции равна:
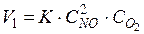
После уменьшения давления в 5 раз:
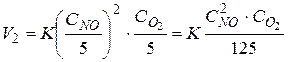
Скорость реакции уменьшится в 125 раз.
Пример 2. Во сколькораз увеличится скорость химической реакции при повышении температуры от  = 100C до
= 100C до  = 800С, если температурный коэффициент скорости g равен 2?
= 800С, если температурный коэффициент скорости g равен 2?
|
|
Решение.
Из правила Вант-Гоффа:

Скорость реакции увеличится в 128 раз.
Пример 3. Реакция образования йодистого водорода протекает по уравнению:
H2(газ) + I2(газ) ⇄ 2HI(газ).
В каком направлении сместится равновесие, если:
а) увеличить концентрацию I2?
б) уменьшить концентрацию HI?
в) увеличить давление?
Решение.
Увеличение концентрации I2 и уменьшение концентрации HI приведет к сдвигу равновесия в сторону прямой реакции. Увеличение давления не вызовет сдвига равновесия.
Пример 4. При определенных условиях реакция хлороводорода с кислородом является обратимой:
4HCl(Г) + O2(Г) ↔ 2Cl2(Г) + 2H2O(Г) + 116,4 кДж.
Какое влияние на равновесие системы окажут: а) увеличение давления; б) повышение температуры; в) введение катализатора?
Решение. 1. Все вещества в системе – газы. В соответствии с принципом Ле-Шателье повышение давления приводит к смещению равновесия в сторону реакции, приводящей к меньшему количеству вещества газов, т.е. в сторону образования Cl2 и Н2О.
2.Поскольку прямая реакция – экзотермическая, то повышение температуры будет способствовать протеканию процесса с поглощением температуры, т.е. равновесие сместится в сторону протекания эндотермической реакции – образования HCl и O2.
3.Катализатор в одинаковой степени ускоряет прямую и обратную реакцию, поэтому в его присутствии равновесные количества веществ не изменятся.
Пример 4. Как повлияет увеличение давления на химическое равновесие в обратимой системе: Fe2O3(К) + 3H2(Г) ↔ 2Fe(К) + 3H2 O(Г)?
|
|
Решение. В гетерогенной равновесной системе повышение давления должно привести к смещению равновесия в сторону реакции, приводящей к образованию меньшего количества веществ газов. Так как количество веществ газов, образующихся при протекании прямой и обратной реакции одинаковы, то изменение давления не приведет к смещению равновесия.
Задачи для самостоятельного решения
Вариант № 1
1. На сколько градусов необходимо повысить температуру, чтобы скорость реакции увеличилась в 64 раза? Температурный коэффициент скорости реакции gравен 2.
2. Как изменятся скорости прямой и обратной реакций, протекающих в газовой фазе и подчиняющихся уравнениям:

а) при увеличении давления в системе в 2 раза?
б) при увеличении объемов газов в 2 раза?
3. Определите в какую сторону сместится равновесие реакции
N2 (г)+ O2(г) = NO(Г) - Q
при:
а)повышении температуры б) повышения давления
Вариант № 2
1. Во сколько раз увеличится скорость химической реакции при повышении температуры от 10 до 700С, если температурный коэффициент скорости gравен 2?
2.Скорость реакции выражается уравнением:  Во сколько раз изменится скорость реакции при увеличении концентрации исходных веществ в 3 раза?
Во сколько раз изменится скорость реакции при увеличении концентрации исходных веществ в 3 раза?
3. Определите в какую сторону сместится равновесие реакции
SO2 (г)+ O2 (г)= SO3 (г) + Q
при:
а)повышении температуры б) повышения давления
Вариант № 3
1.Скорость реакции A(тв)+ 2B(газ)=C(тв) выражается уравнением:  Как изменится скорость реакции, если концентрацию B увеличить в 2 раза?
Как изменится скорость реакции, если концентрацию B увеличить в 2 раза?
2. Скорость некоторой реакции при повышении температуры с 40 до 700С увеличилась в 8 раз. Определить величину g.
3. Определите в какую сторону сместится равновесие при:
а)повышении температуры б) повышения давления
2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
Вариант № 4
1. Скорость реакции 3A+B=C выражается уравнением:  Во сколько раз изменится скорость прямой реакции:
Во сколько раз изменится скорость прямой реакции:
а) при увеличении концентрации вещества A в 2 раза?
б) при одновременном уменьшении концентрации исходных веществ в 2 раза?
2. Скорость некоторой реакции при повышении температуры с 40 до 700С увеличилась в 8 раз. Определить величину g.
3. Как влияют на равновесие в системе
 , (ΔН<0)
, (ΔН<0)
а) понижение давления;
б) повышение температуры;
в) увеличение концентрации исходных веществ?
Вариант № 5
1. Как изменятся скорости прямой и обратной реакций, протекающих в газовой фазе и подчиняющихся уравнениям:

при изотермическом увеличении давления в 2 раза?
2. На сколько градусов надо увеличить температуру, чтобы скорость реакции возросла в 9 раз, если температурный коэффициент скорости g равен 3?
3. Определите в какую сторону сместится равновесие при:
а)повышении температуры б) повышения давления
SO2 (г)+ O2 (г)= SO3 (г) + Q
Вариант № 6
1. Чему равен температурный коэффициент скорости g, если при увеличении температуры на 300С скорость реакции возрастает в 27 раз?
2. Как изменится скорость прямой реакции при уменьшении объема реакционного сосуда в 3 раза для следующих систем:
2NO(г) + Cl2 (г)®2NOCl(г)
3. Определите в какую сторону сместится равновесие при:
а)повышении температуры б) повышения давления
NO(г) + O2 (г)= NO2 (г)+Q
Вариант № 7
1.При увеличении температуры от 10 до 500С скорость реакции увеличилась в 16 раз. Определить температурный коэффициент скорости g.
2. Как изменится скорость прямой реакции при уменьшении объема реакционного сосуда в 3 раза для следующей системы:
а) H2 (г)+Cl2 (г)® 2HCl(г
3. Определите в какую сторону сместится равновесие при:
а)повышении температуры б) повышения давления
CO(г) + O2 (г)= CO2(г)+Q
Вариант № 8
1. Во сколько раз увеличится скорость химической реакции при повышении температуры от 30 до 600С, если температурный коэффициент скорости g равен 3?
2. Скорость реакции A(тв)+ 2B(газ)=C(тв) выражается уравнением:  Как изменится скорость реакции, если концентрацию B увеличить в 2 раза?
Как изменится скорость реакции, если концентрацию B увеличить в 2 раза?
3. Оределите в какую сторону сместится равновесие при:
а)повышении температуры б) повышения давления
H2(г) + I2(г) = HI (г)-Q
Вариант № 9
1. Чему равен температурный коэффициент скорости химической реакции g, если при увеличении температуры на 300С скорость возрастает в 27 раз?
2.Как изменится скорость реакции в системе А(г)+ 2В(г)®АВ2 (г) если концентрацию вещества А уменьшить в 2 раза, а концентрацию вещества В увеличить в 4 раза?
3. Определите в какую сторону сместится равновесие при:
а)повышении температуры б) повышения давления
CO(г) + O2 (г)= CO2(г)+Q
Вариант № 10
1.Во сколько раз возрастет скорость данной реакции 2NO + O2 = 2NO2 при увеличении давления в смеси исходных газов в два раза?
2. При увеличении температуры системы от 10 до 500С скорость химической реакции увеличилась в 16 раз. Определить температурный коэффициент скорости реакции g.
3. Определите в какую сторону сместится равновесие при:
а)повышении температуры б) повышения давления
NO(г) + O2 (г)= NO2 (г)+Q
Вариант № 11
1. Во сколько раз увеличится скорость реакции при увеличении температуры на 250С, если γ = 3?
2. Во сколько раз изменится скорость прямой и обратной реакций в системе 2SO2(г) + O2 = 2SO3(г), если объем газовой смеси уменьшить в 3 раза? В какую сторону сместится равновесие системы?
3. Определите в какую сторону сместится равновесие при:
а)повышении температуры б) повышения давления
NO2(г) = N2O4(ж) +Q
Вариант № 12
1. Вычислите по правилу Вант-Гоффа, во сколько раз увеличится скорость химической реакции при увеличении температуры на 200С, если γ = 2,8.
2. Запишите кинетическое уравнение для следующих уравнений реакций:
А) S(тв) + O2 (г) = SO2 (г)
Б) 2SO2 (г) + O2 (г) = 2SO3 (ж)
3. Определите в какую сторону сместится равновесие при:
а)повышении температуры б) повышения давления
CaCO3(тв) = CaO(тв) + CO2(г) -Q
Вариант № 13
1. Как изменится скорость химической реакции между азотом и водородом N2(г) + 3H2(г)  2NH3(г), если, не изменяя температуру, уменьшить давление системы в 2 раза?
2NH3(г), если, не изменяя температуру, уменьшить давление системы в 2 раза?
2. Во сколько раз уменьшится скорость химической реакции при уменьшении температура с 36оС до 28оС, если температурный коэффициент равен 2?
3. Действием каких факторов можно сместить равновесие в химической реакции N2(г) + 6Li(т)  2Li3N(т)+ 39 кДж/моль в сторону продуктов реакции?
2Li3N(т)+ 39 кДж/моль в сторону продуктов реакции?
Вариант № 14
1. Как изменится скорость химической реакции между кислородом и водородом 2Н2(г) + О2(г)  2H2О (г), если, не изменяя температуру, уменьшить концентрацию исходных веществ в 4 раза?
2H2О (г), если, не изменяя температуру, уменьшить концентрацию исходных веществ в 4 раза?
2. Во сколько раз увеличится скорость химической реакции при изменении температуры от 35 до 75оС, если температурный коэффициент равен 2?
3. Действием каких факторов можно сместить равновесие в сторону продуктов реакции С2Н4 + 3О2  2СО2 + 2Н2О? ∆Н < 0
2СО2 + 2Н2О? ∆Н < 0
Вариант № 15
1. Во сколько раз изменится скорость прямой реакции
А(г) + 2В(г)  АВ2 (г) при увеличении давления в 2 раза?
АВ2 (г) при увеличении давления в 2 раза?
2.Во сколько раз уменьшится скорость химической реакции при уменьшении температура с 36оС до 28оС, если температурный коэффициент равен 2?
3. Действием каких факторов можно сместить равновесие в химической реакции N2(г) + 6Li(т)  2Li3N(т)+ 39 кДж/моль в сторону продуктов реакции?
2Li3N(т)+ 39 кДж/моль в сторону продуктов реакции?
Вариант № 16
1.Скорость химической реакции увеличилась в 81 раз при увеличении температуры на 30оС. Определите величину температурного коэффициента
2. Во сколько раз возрастет скорость данной реакции 2NO + O2 = 2NO2 при увеличении давления в смеси исходных газов в два раза?
3. Как следует изменить концентрацию, температуру и давление в реакции горения углерода, чтобы сместить равновесие в сторону обратной реакции?
Вариант № 17
1.Во сколько раз возрастет скорость данной реакции 2SO2 + O2 = 2SO3 при увеличении давления в смеси исходных газов в два раза?
2.Скорость химической реакции увеличилась в 81 раз при увеличении температуры на 30оС. Определите величину температурного коэффициента.
3.Действием каких факторов можно сместить равновесие в сторону прямой химической реакции Fe(т) +2HCl(ж)  FeCl2(ж) + Н2(г)? ∆Н > 0
FeCl2(ж) + Н2(г)? ∆Н > 0
Вариант № 18
1.Во сколько раз возрастет скорость данной реакции 2SO2 + O2 = 2SO3 при увеличении концентрации реагирующих веществ в два раза?
2. Чему равен температурный коэффициент, если при увеличении температуры на 30оС скорость химической реакции возрастает в 27 раз?
3. Определите в какую сторону сместится равновесие при:
а)повышении температуры б) повышения давления
NO2(г) = N2O4(ж) +Q