Характер продуктов окислительной модификации боковых группировок аминокислотных остатков в структуре белков и свободных аминокислот может полностью не совпадать (только в структуре белков, подвергнутых действию АФК, обнаруживаются относительно стабильные пероксидные группировки, а также модификации, проявившие выраженную редуцирующую (то есть, электронодонорную) активность). Однако, наиболее подверженные окислению аминокислоты будут подвергаться в первую очередь окислительной модификации и в структуре белка: цистеин и метионин являются теми аминокислотными остатками, окисление которых требует не только на один два порядка более низких концентраций окислителя, но и отражается на функциональной активности белков. В конечном счете, модифицирующему воздействию гидроксильного радикала подвержены любые аминокислотные остатки в структуре белков. Причем, наряду с отрывом электрона таким радикалом и образованием гидроксила (•ОН), формируются и свободнорадикальные аддукты. В качестве субстратов для связывания НО• выступают аминокислотные остатки, обладающие развитой системой двойных связей – Три (Trp), Фен, Тир (Tyr) и Гис (с образованием соответствующих гидроксилированных радикалов - точкой обозначена локализация свободной валентности): (у тирозина преимущественно осуществляется отрыв водорода от ОН-группы):
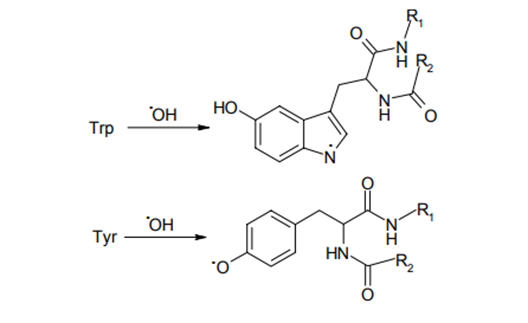
(с делокализацией свободной валентности по бензольному кольцу тирозина).
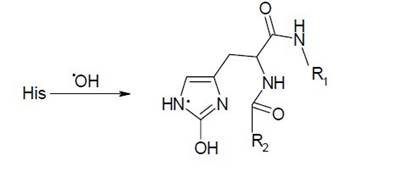
Однако в присутствии молекулярного кислорода боковые группировки этих остатков подвергаются дальнейшей трансформации. В случае гистидина окислительная модификация его боковой группировки в аэробных условиях приводит к разложению его пентагональной кольцевой группировки с образованием ряда карбонильных форм. Причем, даже столь глубокая деградация этого остатка не приводит к расщеплению полипептидного остова молекулы:
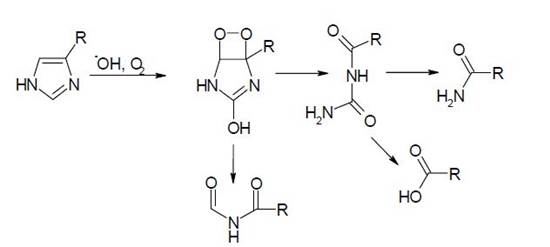
Окислительная деградация пролина осуществляется по следующим схемам:
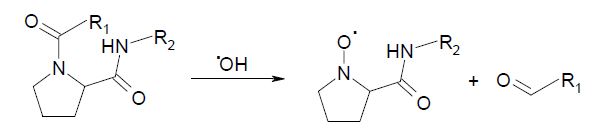
1) При взаимодействии пролина с гидроксильным радикалом образуется нитроксильный радикал (N-O•) пролина и наблюдается разложение ацилпролиновой связи, то есть, фрагментация полипептидной цепи:
2) в присутствии О2 осуществляется расщепление полипептидного остова белка:
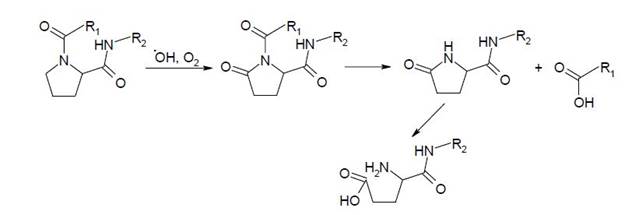
В этих реакциях для окислительной деградации пролинового остатка для разложения полипептидной цепи не требуется отрыва атома водорода от α-углеродного атома.
3) при одновременной атаке гидроксильным и супероксидным радикалами аминокислотного остатка пролина происходит расщепление полипептидной цепи одновременно по двум механизмам - "а" и "б":
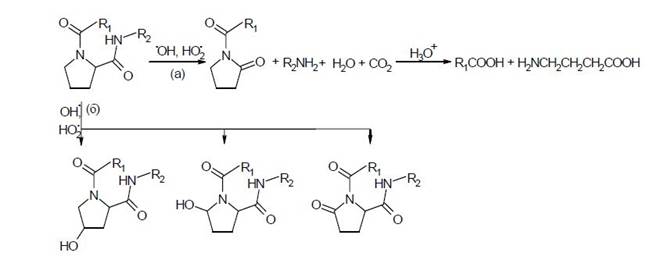
Расщепление полипептидного остова наблюдается и при окислительной модификации в аэробных условиях остатка глутаминовой кислоты. Атака гидроксильным радикалом триптофана ведет к образованию 5-гидрокситриптофанильного радикала с делокализацией свободной валентности на атоме азота индольного цикла. Дальнейшее окисление триптофана приводит к разрыву пятичленной структуры с образованием следующих конечных продуктов нерадикальной природы: кинуренину (1), N-формилкинуренину (2), 3-гидроксикинуренину (3), 3-гидрокси-N-формилкинуренину (4) и 5-гидроксикинуренину (5):
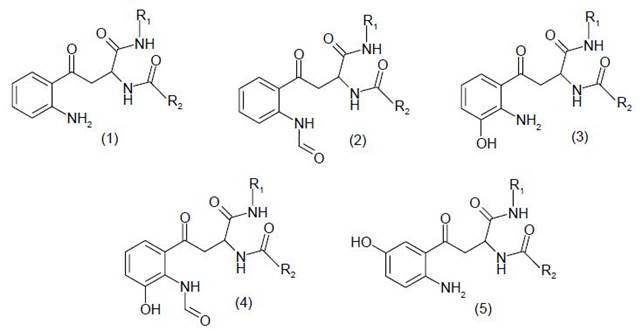
Образующиеся при окислении альдегиды способны участвовать в двух конкурирующих процессах. Во-первых, модифицируя аминогруппы до оснований Шиффа, участвовать в деструкции белка совместно с радикальными формами. Во-вторых, подвергаться гидролизу до кенуренина с отщеплением формильной группировки. Окислительная трансформация триптофанового остатка ведет к специфической флуоресценции, используемой в качестве критерия оценки радикального повреждения различных типов белков. Окислительная модификация Trp во всех случаях приводит к существенному снижению функциональной активности белка, значительному уменьшению его устойчивости к денатурирующим воздействиям.
Наряду с триптофаном наиболее чувствительными к действию окислителей являются остатки Met и Cys в составе белков. Некоторые реакции окисления Met и Cys являются обратимыми (для чего существуют специальные ферментативные системы):
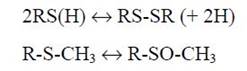
Наряду с «каноническими» продуктами окисления этих остатков, образуются и активные радикальные интермедиаты. В случае тиильного радикала, основными процессами, протекающими в клеточных системах при аэробных условиях, являются его реакции с молекулярным кислородом и глутатионом, GSH (концентрация которого в живых клетках составляет миллимолярные значения):
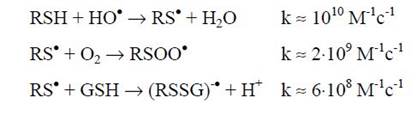
После чего тиилпероксидный радикал трансформируется либо в сульфинильный радикал:

либо, взаимодействуя с SН-содержащими соединениями (преимущественно с GSH), превращается в сульфеновую кислоту и сульфинильный радикал):
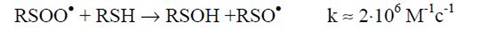
В то же время дисульфидный анион-радикал комплекса белка с глутатионом отдает свой лишний электрон молекулярному кислороду, трансформируя последний в супероксиданион-радикал и превращаясь в валентнонасыщенный аддукт:
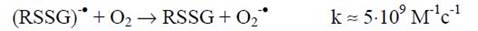
Образующийся в реакции тиильный радикал способен атаковать белки, преимущественно отрывая атом водорода от α-углерода полипептидных цепей:
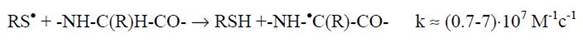
Следовательно, в присутствие кислорода происходит фрагментация белков не только в результате атаки их только гидроксильным радикалом или продуктом его взаимодействия с белками - алкоксильным радикалом, но и при участии в этом процессе тиильного радикала - продукта окисления низкомолекулярных SН-соединений.
Простой обмен свободной валентности с атомом серы цистеинильных остатков является второй по своему значению реакцией взаимодействия тиильного радикала с белками (из-за меньшего представительства свободных SН-групп у этих молекул, по сравнению с имеющимися у них α-углеродными атомами), ведущей к миграции свободной валентности между полипептидными цепями:
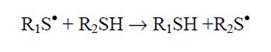
При взаимодействии гидроксильного радикала с метионилом и его обратимым производным - метионилсульфоксидом наблюдаются следующие превращения:
а) Отрыв электрона или группировки атомов:
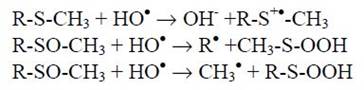
б) присоединение НО•:
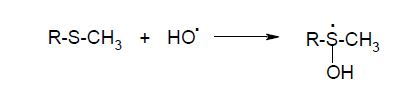
То есть, гидроксильный радикал, реагируя с этими соединениями, способен как отрывать электрон от исходной тиоэфирной группы (или отрывать группу атомов от метионилсульфоксида), так и формировать гидроксилированный свободнорадикальный аддукт с метиониловым остатком. Меt по критерию незаменимости занимает вторую позицию после Тгр в структуре белков. Вследствие слабого нуклеофильного характера тиоэфирной группы этой аминокислоты (по сравнению с другими нуклеофильными аминокислотными остатками в белках) при низких значениях рН она не протонируется. И в кислой среде метеонин окисляется уже при низких концентрациях окислителей. Трансформация Меt в метионилсульфоксид происходит в присутствии НО•, 1О2, Н2О2, гипохлорита и хлорамина, причем механизм генерации метионилсульфоксида в каждом случае имеет свои особенности:
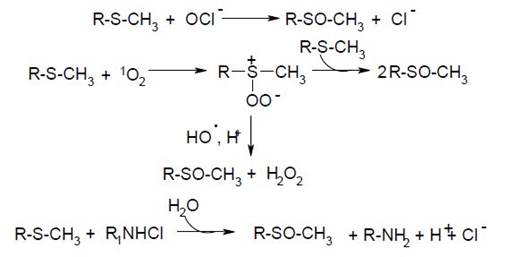
Приведенные неконтролируемые самопроизвольные процессы окисления аминокислот с участием АФК являются опасными для живых систем.