Элементарный состав 1 кг жидкого нефтяного топлива может быть представлен равенством
1 кг топлива = скг С+ hкг Н + sкг S + oкг О,
где С, Н, S, О – химические символы углерода, водорода, серы и кислорода; c, h, s, o – массовые доли соответственно углерода, водорода, серы и кислорода в 1 кг топлива.
В расчетах рабочего цикла принимается следующий условный состав дизельного топлива: с = 0,87; h = 0,126; о = 0,004.
Количество кислорода, необходимое для сгорания 1кг топлива:
с /12 + h /4 + s /32 - o /32 кмоль О2/1кг топл, (16)
где o /32 - количество кмоль кислорода, которое не потребуется для реакции горения, так как содержится в самом топливе.
Если учесть, что в единице объема (или 1 кмоля) сухого воздуха содержится 21% кислорода, то для сжигания 1 кг топлива потребуется следующее количество воздуха:
Lo = 1/0,21 (с /12 + h /4 + s /32 - o/ 32) = 0.495 кмоль возд/1 кг возд. (17)
То же количество воздуха в килограммах на 1 кг топлива:
L  =mвLo = 14,331 кг возд / кг топлива, (18)
=mвLo = 14,331 кг возд / кг топлива, (18)
где mв= 28,97 – молекулярная масса воздуха, кг/кмоль.
Коэффициентом избытка воздуха для сгорания называется отношение действительного количества воздуха L, вводимого в цилиндр двигателя на 1кг топлива, к теоретически необходимому Lо,
a =  , (19)
, (19)
где Ga - часовое количество воздуха кг/ч, затраченного на горение часового расхода топлива Gm , кг/ч.
При сгорании топлива с a конечные продукты реакции состоят из газообразных СО2, SO2 и паров воды, а также из азота и избыточного кислорода воздуха:
М= Мсо2 + Мн2о + Мso2 + MN2 + Мо2. (20)
В расчетах рабочего цикла общее количество кмоль продуктов сгорания М удобно делить на две части: количество кмоль “чистых” продуктов сгорания (на окисление компонентов топлива при этом затрачено теоретически необходимое количество воздуха Lo)
Мсо2 + Мн2о + Мso2 + MN2 = с /12 + h /2 + s /32 + 0.79 Lo, (21)
где 0,79 Lo – количество кмоль азота МN2, которое остается в продуктах сгорания при a=1;
количество Lo(a-1) кмоль избыточного воздуха, состоящего из 0,21 Lo(a-1) кмоль кислорода Мо2 и 0,079 Lo(a-1) кмоль азота МN2. Тогда общее количество кмоль продуктов сгорания будет:
М = с /12 + h /2 + s /32 + Lo(a - 0,21). (22)
В дизелях количество впрыскиваемого в цилиндры топлива пропорционально нагрузке, а количество поступающего воздуха в меньшей степени зависит от нагрузки. Следовательно, с уменьшением нагрузки a увеличивается, что ведет к резкому падения процентного содержания СО2 и Н2О в продуктах сгорания, тогда как объемное содержание азота мало зависит от a.
Известно, что суммарное число молей (объем) продуктов сгорания больше, чем суммарное число молей кислорода, необходимого для сжигания 1 кг топлива. Приращение числа молей при сгорании составляет
D М = М – L = M - aLo. (23)
При a= 1 DМ =  . (24)
. (24)
Таким образом, при сгорании углеводородного топлива число молей конечных продуктов больше числа молей исходных газообразных продуктов на величину DМ = (8 h +o)/32, т.е. приращение происходит исключительно за счет окисления водорода и наличия в топливе некоторого количества кислорода; масса конечных продуктов сгорания (Gr ,кг) равна массе исходных продуктов (воздух и топливо, кг):
Gr =Gв + Gт.
Теоретическим коэффициентом молекулярного изменения b0 называется отношение количества молей продуктов сгорания М к количеству молей свежего заряда L.
b 0 = M/L=M/aLo. (25)
Используя уравнение (21) получим М=L +DМ и
b 0 = 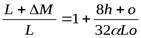 ,
,
а для топлива среднего (расчетного) состава b0 = 1 + 0.064/ a.
Текущее значение коэффициента молекулярного изменения можно получить, если через x обозначить долю топлива, сгоревшего к данному моменту процесса от цикловой подачи топлива, тогда число молей продуктов сгорания в рассматриваемый момент будет
Мх = L + DМх.
Тогда текущее значение bх определится из выражения:
b х =  ,
,
D М / L = b -1,
следовательно,
b х = 1 +  . (26)
. (26)
Значения bх для процесса сгорания (0 < х <1) изменяются в следующих пределах: х= 0, bх= 1; и х= 1, bх=b.
Теплоемкость газов в цилиндре дизеля изменяется вместе с изменением температуры и состава смеси. Пользоваться истинными теплоносителями в расчетах неудобно, поэтому применяют среднюю мольную теплоемкость. Средние мольные теплоемкости вычисляются по формулам.
 а +вТ;
а +вТ;  =Rm+
=Rm+  .
.
Для воздуха 
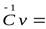 19,26 + 0,00251Т кДж/(кмоль·К);
19,26 + 0,00251Т кДж/(кмоль·К);
Для «чистых» продуктов сгорания (a=1)
 = 20,473 + 0,0036Т кДж/(кмоль·К) (27)
= 20,473 + 0,0036Т кДж/(кмоль·К) (27)
В результате сгорания топлива при a>1 в цилиндре образуется смесь газов, которую можно рассматривать как смесь «чистых» продуктов сгорания (a= 1) в количестве (Lo + DМ)х кмоль и избыточного воздуха в количестве (aLo-Loх) кмоль.
Количество остаточных газов в цилиндре Мr невелико и можно принять, что они также состоят из двух частиц: Мr / a кмоль «чистых» продуктов сгорания и (Мr - Мr /a) – кмоль воздуха в остаточных газах.
Общее количество «чистых» продуктов сгорания в цилиндрах с учетом доли сгоревшего топлива х будет равно
Lo x + DМх + Мr / a = Lo  ,
,
где DМ / Lo =0.064 для топлива расчетного состава.
Общее количество воздуха в цилиндре в тот же момент будет равно
a Lo – Lo x + Mr - Мr / a = Lo [ a( 1 +gr)-(x+gr) ].
Теплоемкость смеси газов в цилиндре определяется по правилу смешения:
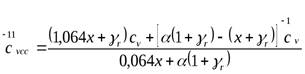 . (28)
. (28)
При подстановке в формулу (28) значений х, a, gr и уравнений 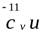
 по формуле (27) она приводится к виду:
по формуле (27) она приводится к виду:  .
.