В организации системы кровообращения можно выделить систему макроциркуляции – сердечный насос, сосуды-буферы (артерии) и сосуды-емкости (вены) – и систему микроциркуляции. Задача последней – присоединить систему кровообращения к общему сокообращению организма и распределить сердечный выброс между органами соответственно их потребностям. Поэтому каждый орган имеет свою, только ему присущую систему микроциркуляции, адекватную выполняемой им функции. Тем не менее удалось выявить 3 основных типа строения терминального сосудистого ложа (классический, мостовой и сетевой) и описать их устройство.
Систему микроциркуляции, схематично представленную на рис.4, составляют следующие микрососуды:
1. артериолы (диаметр 100 мкм и меньше);
2. прекапиллярные артериолы или прекапилляры или метартериолы (диаметр 25 – 10 мкм);
3. капилляры (диаметр 2 – 20 мкм);
4. посткапиллярные венулы или посткапилляры (диаметр 15 – 20 мкм);
5. венулы (диаметр до 100 мкм).
Кроме этих сосудов еще выделяют артериоло-венулярные анастомозы – непосредственные соустья между артериолами/артериями и венулами/венами. Диаметр их – от 30 до 500 мкм, встречаются они в большинстве органов.
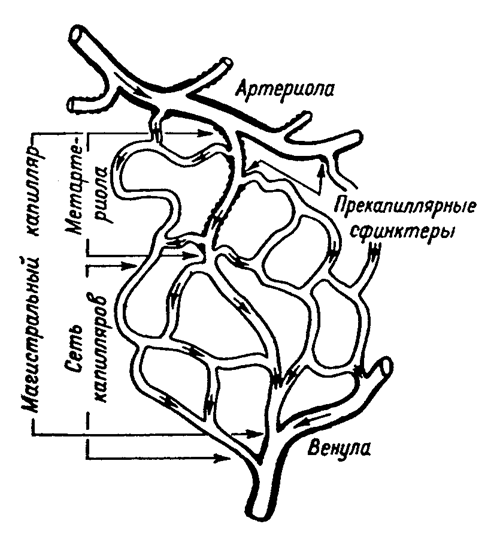
Рисунок 4. Схема микроциркуляторного русла [по Chambers, Zweifach, 1944].
Движущей силой кровотока в системе микроциркуляции является перфузионное давление или артерио-венозная разница давлений. Следовательно, это давление определяется уровнями общего артериального и венозного давлений, и на его величину может влиять работа сердца, общий объем крови и общее периферическое сосудистое сопротивление. Зависимость между центральным и периферическим кровообращением выражается формулой Q = dP/R, где Q – интенсивность (объемная скорость) кровотока в системе микроциркуляции, dP – артерио-венозная разница давлений, R – периферическое (гидродинамическое) сопротивление в данном сосудистом русле. Изменения как dP, так и R являются ведущими в нарушениях периферического кровообращения. Чем меньше величина периферического сопротивления, тем больше интенсивность кровотока; чем больше величина периферического сопротивления, тем меньше интенсивность кровотока. Регулирование периферического кровообращения и микроциркуляции во всех органах осуществляется посредством изменения сопротивления току в их сосудистой системе. Увеличение вязкости крови увеличивает гидродинамическое сопротивление и таким образом уменьшает интенсивность кровотока. Гораздо больше величина гидродинамического сопротивления зависит от радиуса сосудов: гидродинамическое сопротивление обратно пропорционально радиусу сосудов в четвертой степени. Отсюда следует, что изменения площади просвета сосудов (вследствие сужения или расширения сосудов) значительно сильнее влияют на кровоток, чем такие факторы, как вязкость или изменение давления.
Главными регуляторами микроциркуляции являются приводящие мелкие артерии и артериолы и артерио-венозные анастомозы. В результате расширения приносящих артериол 1) увеличивается скорость кровотока, 2) возрастает внутрикапиллярное давление и 3) увеличивается количество функционирующих капилляров. Последнее будет определяться также открытием прекапиллярных сфинктеров – расслаблением двух или более гладкомышечных клеток у начала капилляров.
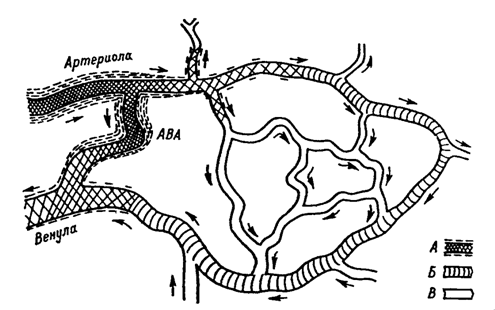
Рисунок 5. Схема основных сосудов микроциркуляторного русла [по Мчедлишвили, 1958].
А- гладкомышечные клетки микрососудов с вазомоторной иннервацией; Б- магистральный капилляр; В - капилляры, образующие сеть. АВА - артериально-венозный анастомоз.
Активно просвет микрососудов может изменяться только при наличии в их структуре гладкомышечных элементов. На рис. 5 заштрихованы виды сосудов, которые их содержат. Отсюда следует, что вегетативные нервы иннервируют все кровеносные сосуды, кроме капилляров. Однако последние исследования показали наличие участков тесных взаимоотношений между терминальными нервными элементами и капиллярами. Они представляют собой специализированные расширения аксонов у капиллярной стенки, сходные с расширениями в области аксо-аксональных синапсов, т.е. образуют по сути дела «синапсы по ходу». Вероятно этот бессинаптический тип передачи сигнала, обеспечивающий свободную диффузию нейромедиаторов в направлении микрососудов, является основным способом нервной регуляции капилляров. При этом происходит регуляция не одного капилляра, а всего сосудистого локуса. При электрораздражении нервов (афферентных и эфферентных) или под действием нейромедиаторов в ткани появляются простагландины, гистамин (в том числе и из-за дегрануляции тучных клеток), АТФ, адреналин и др. вазоактивные вещества. В результате главным образом меняется состояние эндотелиальных клеток, усиливается трансэндотелиальный транспорт, меняется проницаемость эндотелия и трофика ткани. Т.о., опосредование регуляторно-трофического влияния нервов на ткани через кровеносную систему осуществляется не только путем грубого регулирования притока крови к органу и его частям, но и путем тонкого регулирования собственно трофики через изменение состояния стенки микрососудов. С другой стороны, приведенные материалы показывают, что иннервационные нарушения относительно быстро приводят к существенным изменениям в ультраструктуре и проницаемости капилляров. Следовательно, в развитии неврогенных дистрофий важную роль должны играть микроциркуляторные расстройства и, в частности, изменение сосудистой проницаемости.
Изменение тонуса сосудов или сосудистых сфинктеров может быть обусловлено нервными, гуморальными и местными регуляторными механизмами (таблица 1).
Таблица 1.
Регуляция микрососудистого pуcлa
| Вид микрососуда | Диаметр (мкм) | Толщина стенки (мкм) | Регуляция | |
| нервная | гуморальная | |||
| Артериола | 20-25 | 5-6 | +++ | + |
| Мелкая артериола | 18-20 | 3-4 | ++ | + |
| Метартериола. | + | ++ | ||
| Прекапиллярный сфинктер | 10-12 | - | +++ | |
| Истинный капилляр | 8-10 | - | + | |
| Венула | 20-30 | 4-5 | - | + |
| Мелкая вена | 30—50 | 6-8 | + | + |
Примечание. Количество крестов обозначает степень выраженности регуляции.
Нервная регуляция осуществляется вегетативной нервной системой. Сосудодвигательные нервы относятся преимущественно к ее симпатическому отделу (реже – парасимпатическому) и обильно иннервируют артериолы кожи, почек и чревной области. В головном мозгу и скелетных мышцах эти сосуды иннервированы относительно слабо. Медиатором в синапсах является норадреналин, всегда вызывающий сокращение мускулатуры. Степень сокращения мышц сосудов зависит непосредственно от частоты импульсации. Сосудистый тонус покоя поддерживается благодаря постоянному поступлению по сосудодвигательным нервам импульсов с частотой 1-3 в сек (так называемая тоническая импульсация). При частоте импульсов, равной всего около 10 в сек, наблюдается максимальное сужение сосудов. Т.о., увеличение импульсации в сосудодвигательных нервах приводит к вазоконстрикции, а уменьшение – к вазодилатации, причем последняя ограничена базальным тонусом сосудов (т.е. тем тонусом, который наблюдается в отсутствие импульсации в сосудосуживающих нервах либо при их перерезке).
Парасимпатические холинергические сосудорасширяющие волокна иннервируют сосуды наружных половых органов, мелкие артерии мягкой мозговой оболочки головного мозга.
Нервный механизм выявляется также при анализе расширения сосудов кожи в ответ на механическое или химическое раздражение кожи. Это – аксон-рефлекс, осуществляемый при помощи ноцицептивных (проводящих боль) нервных волокон и нейропептидов.
Чувствительность мышечных клеток к вазоактивным веществам различна. Микрососуды чувствительнее крупных в 10-100 раз, самыми чувствительными в отношении действия как суживающих, так и расширяющих агентов, оказались прекапиллярные сфинктеры. Было найдено, что аналогичная реактивность наблюдается и в отношении электрической стимуляции (таблица 2). В условиях патологии изменяется чувствительность микрососудов к вазоактивным веществам.
Таблица 2
Градиент реактивности мнкроцbркуляторного ложа брыжейки крыс
(по Zweifach, 1961)
| Сосуд | Диаметр (мкм) | Стимуляция | |
| адреналин (мкг) | электрическая (В) | ||
| Артерия Артериола Прекапиллярный сфинктер Венула | 0,01 0,005 0,001 0,05 | 4,0 3,5 2,0 5,0 |
Реактивность микрососудов кроме того неодинакова в различных органах и тканях. Особенно наглядно эта закономерность выступает по отношению к адреналину (таблица 3). Наивысшей чувствительностью к адреналину обладают микрососуды кожи.
Таблица 3
Реактивность микрососудов крыс к nopoговой концентрации
адреналина (по Zweifach, 1961)
| Микрососуды | Адреналин |
| Кожи Скелетной мышцы Сальника Брыжейки Кишечной стенки Мочевого пузыря | 0,002 - 0,004 0,02 - 0,30 0,1 - 0,2 0,2 - 0,4 0,75 - 1,00 0,005 - 0,020 |
В последние годы доказан факт существования в одном и том же нейроне двух и более (вплоть до семи) нейротрансмиттеров, имеющих разную химическую природу, и в разном их сочетании. Широкая, если не повсеместная, распространенность нейропептидов в вегетативных нервах (например, нейропептида У, вазоактивного интестинального пептида, вещества Р и др.), снабжающих кровеносные сосуды, хорошо доказана многочисленными иммуногистохимическими исследованиями и свидетельствует о значительном увеличении сложности механизмов нервной регуляции сосудистого тонуса. Еще большее усложнение этих механизмов связано с обнаружением нейропептидов в составе чувствительных нервных волокон, снабжающих кровеносные сосуды, и их возможной «эффекторной» ролью в регуляции сосудистого тонуса.
Гуморальная регуляция осуществляется гормонамии химическими веществами, выделяющимися в организме. Вазопрессин (антидиуретический гормон) и ангиотензин – II вызывют сужение сосудов. Каллидин и брадикинин – расширение сосудов. Адреналин, секретируемый надпочечниками, может оказывать как сосудосуживающий, так и сосудорасширяющий эффект. Ответ определяется количеством a- или b-адренергических рецепторов на мембране сосудистых мышц. Если в сосудах преобладают a-рецепторы, то адреналин вызывает их сужение, а если большинство составляют b-рецепторы, то он вызывает расширение.
Местные регуляторные механизмы обеспечивают метаболическую ауторегуляцию периферического кровообращения. Они приспосабливают местный кровоток к функциональным потребностям органа. При этом метаболические сосудорасширяющие влияния доминируют над нервными сосудосуживающими эффектами и в некоторых случаях полностью подавляют их. Расширяют микрососуды: недостаток кислорода, продукты метаболизма – углекислый газ, увеличение Н-ионов, лактат, пируват, АДФ, АМФ и аденозин, многие медиаторы повреждения или воспаления – гистамин, брадикинин, простагландины А и Е и вещество Р. Считается, что расширение при действии некоторых медиаторов происходит за счет выделения из эндотелиальных клеток оксида азота, который непосредственно расслабляет гладкие мышцы. Суживают микрососуды медиаторы повреждения - серотонин, простагландины F, тромбоксан и эндотелины.
В отношении способности капилляров активно суживаться ответ скорее отрицательный, поскольку там нет гладкомышечных клеток. Те исследователи, которые наблюдают активное сужение их просвета, объясняют это сужение сокращением эндотелиоцита в ответ на раздражитель и выпячиванием ядра клетки внутрь капилляра. Пассивное сужение или даже полное закрытие капилляра наступает тогда, когда напряжение их стенок превалирует над внутрисосудистым давлением. Такое состояние возникает при уменьшении притока крови по приводящей артериоле. Существенное расширение капилляров также затруднено, так как 95% упругости их стенки приходится на окружающее их соединительное вещество. Только при его разрушении, например, воспалительным экссудатом, возросшее внутрикапиллярное давление может вызвать растяжение стенок капилляров и их значительное расширение.
В артериальном русле наблюдаются колебания давлений в соответствии с сердечным циклом. Амплитуда колебания давления называется пульсовым давлением. В концевых разветвлениях артерий и артериолах давление резко падает на протяжении нескольких миллиметров сосудистой сети, достигая 30-35 мм рт.ст. в конце артериол. Это связано с высоким гидродинамическим сопротивлением данных сосудов. Одновременно значительно снижаются или исчезают пульсовые колебания давления и пульсирующий кровоток постепенно сменяется непрерывным (при значительном расширении сосудов, например, при воспалении, пульсовые колебания наблюдаются даже в капиллярах и мелких венах). Тем не менее в артериолах, метартериолах и прекапиллярах можно отметить ритмичные колебания скорости кровотока. Частота и амплитуда этих колебаний могут быть различными, и они не участвуют в приспособлении кровотока к потребностям тканей. Предполагают, что это явление – эндогенная вазомоторика – обусловлено автоматизмом сокращений гладкомышечных волокон и не зависит от вегетативных нервных влияний.
Возможно, что изменения кровотока в капиллярах зависят и от лейкоцитов. Лейкоциты в отличие от эритроцитов имеют не дисковидную, а сферическую форму и при диаметре 6-8 мкм их объем превосходит объем эритроцитов в 2-3 раза. При вхождении лейкоцита в капилляр он «застревает» в устье капилляра на некоторое время. По данным исследователей оно колеблется от 0,05 сек до нескольких секунд. В этот момент движение крови в данном капилляре останавливается, а после проскальзывания лейкоцита в микрососуд – снова восстанавливается.
Основными формами расстройств периферического кровообращения и микроциркуляции являются: 1. артериальная гиперемия, 2. венозная гиперемия, 3. ишемия, 4. стаз.
Тромбоз и эмболия, не являющиеся самостоятельными нарушениями микроциркуляции, появляясь в этой системе, вызывают ее серьезные нарушения.
АРТЕРИАЛЬНАЯ ГИПЕРЕМИЯ.
Артериальной гиперемией называется усиление кровотока в органе или ткани в результате увеличения притока крови. Приток возрастает в результате расширения мелких артерий и артериол (активная гиперемия). При этом падает гидродинамическое сопротивление, в ткани возрастает объемная (Q), линейная (V) скорости кровотока (Q=VS), количество функционирующих капилляров (увеличивается градиент давления на протяжении капилляров, увеличивается линейная скорость и местный гематокрит, что приводит к превращению закрытых капилляров в функционирующие). Так как отток не нарушен и отек развивается редко, упругость стенки капилляров не изменяется и их расширение – незначительно. Однако площадь поперечного сечения микроциркуляторного русла (S) в целом возрастает из-за увеличения количества функционирующих капилляров. Течение крови имеет ламинарный характер, деление на осевой (клетки крови) и пристеночный (плазма) кровоток подчеркнуто, снижение внутреннего трения способствует быстрому кровообращению. В ткани увеличивается образование тканевой жидкости и соответственно возрастает лимфоотток.
Ускорение скорости кровотока снижает время контакта крови с тканью и уменьшает время диффузии кислорода в ткани. Это не приводит к ухудшению метаболизма, так как компенсируется увеличением количества функционирующих капилляров на единицу ткани; наоборот, метаболизм даже возрастает. Но в результате в венозной крови увеличивается количество кислорода, артериоло-венулярная разница по кислороду уменьшается и венозная кровь имеет более алый цвет.
Т.о., изменения микроциркуляции при артериальной гиперемии характеризуются расширением артериол, увеличением количества функционирующих капилляров, увеличением скорости кровотока, подчеркнутым делением на осевой и плазматический кровоток и ярко-алым цветом крови в сосудах.
Внешними признаками или симптомами артериальной гиперемии являются: ало-красный цвет органа (расширение сосудов, увеличение количества функционирующих капилляров, показателя гематокрита и артериализация венозной крови), увеличение тургора (напряжения) тканей (расширение и переполнение сосудов кровью, увеличение образования тканевой жидкости), повышение температуры поверхностно распложенных тканей (увеличение притока артериальной теплой крови).
Причинами артериальной гиперемии могут быть обычные физиологические раздражители – внешние (тепловые, механические факторы, солнечные лучи) и внутренние (рефлекторные влияния, метаболиты), и такая гиперемия называется физиологическая. Примеры физиологической гиперемии: рабочая при усилении функции органов, рефлекторная при действии адекватных доз физиологических раздражителей, при чувстве стыда и гнева.
Гиперемия при действии болезнетворных раздражителей – механических, физических, биологических, химических, как внешних, так и внутренних, называется патологической. Примеры такой гиперемии: воспалительная, коллатеральная – усиление кровотока по коллатералям в связи с затруднением кровотока по магистральному сосуду, постанемическая – гиперемия после быстрого устранения фактора, сдавливающего артерию (лигатура, опухоль, скопление жидкости), вакатная – обусловлена уменьшением барометрического давления (например, местная от действия медицинских банок), ангионевротическая – гиперемия на лице при красной волчанке, инфекционные сыпи на коже, гиперемия половины лица при невралгиях.
Любой вид артериальной гиперемии возникает в результате расширения приводящей периферической артерии или артериолы. Выделяют 3 механизма, обусловливающие такое расширение.
1. Миопаралитический механизм. Самый часто встречающийся, так как он обусловлен расслаблением мышечных элементов артериол и прекапилляров под действием местных факторов – метаболитов и медиаторов повреждения.
2. Нейропаралитический механизм. Возникает при перерезке, параличе или повреждении вазоконстрикторных волокон нервов и их центров, в том числе бактериальными токсинами и фармакологическим путем.
3. Нейротонический механизм. Гиперемия развивается в результате понижения тонуса вазоконстрикторов, повышения тонуса вазодилятаторов или аксон-рефлекса. Под влиянием симпатических вазодилятаторов артериальная гиперемия наступает в поджелудочной и слюнных железах, языке, кавернозных телах. По нейротоническому механизму осуществляется покраснение щек от стыда или гнева, покраснение кожи для выведения излишков тепла из организма. Аксон-рефлекс участвует в возникновении гиперемии при воспалении.
Значение артериальной гиперемии связано с ее последствиями. Ближайшее из них – повышение функциональных возможностей органа или ткани. Длительная гиперемия может привести к гипертрофии, гиперплазии и даже к ускорению развития органов или тканей. Развитие артериальной гиперемии в органах, заключенных в замкнутый объем, сопровождается иногда неприятными ощущениями – головной болью, шумом в ушах при гиперемии в церебральных сосудах, болью, чувством ломоты в суставах. При дефектах в стенке сосуда он может разорваться под влиянием повышенного давления и вызвать кровоизлияние.
ВЕНОЗНАЯ ГИПЕРЕМИЯ.
Венозной гиперемией называется увеличение кровенаполнения органа или ткани в результате нарушения оттока крови. Обязательное условие развития такой гиперемии – недостаточность оттока по окольным венозным путям.
Венозный застой крови возникает вследствие механических препятствий для оттока крови из микроциркуляторного русла в венозную систему (местная венозная гиперемия) или из-за повышения давления в крупных венах – при лево- или правожелудочковой сердечной недостаточности, при повышении давления в воротной вене при циррозе печени. Тогда наблюдается венозный застой сразу во многих венозных сосудистых сетях.
Кровяное давление в венах повышается непосредственно перед препятствием кровотоку. В результате: 1) уменьшается артерио-венозная разница давлений, что приводит к замедлению кровотока, линейная скорость кровотока падает; 2) повышенное внутрисосудистое давление растягивает сосуды и вызывает их расширение. Становятся шире все функционирующие вены, капилляры - особенно заметно в венозных отделах, раскрываются до того нефункционирующие венозные сосуды; 3) увеличивается растяжимость соединительной ткани, которая входит в состав сосудистых стенок и окружает их снаружи; 4) усиливается фильтрация жидкости из венул и капилляров в ткань.
В ткани при венозной гиперемии можно наблюдать не только простое замедление тока крови, но иногда и другие изменения кровотока: толчкообразный и маятникообразный ток крови. Если давление перед препятствием достигает диастолического давления в артериях, то кровоток будет останавливаться во время диастолы и опять начинаться во время каждой систолы, т.е. кровоток становится толчкообразным. Если же давление в венах перед препятствием повышается еще больше, превышая диастолическое давление в приводящих артериях, то ортоградный ток крови (имеющий нормальное направление) наблюдается только во время систол сердца, а во время диастол из-за извращения градиента давления в сосудах (вблизи вен оно становится выше, чем вблизи артерий) наступает ретроградный, т.е. обратный, толчок крови. Такой кровоток в органах называется маятникообразным.
Замедление скорости кровотока увеличивает время контакта крови с тканью и тем самым время диффузии кислорода в ткани. Артериоло-венулярная разница по кислороду увеличивается, в венозной крови растет содержание восстановленного гемоглобина, развивается цианоз – синюшная окраска кожи (% восстановленного гемоглобина в венозной крови превышает 5-6%). Умеренно понижается парциальное напряжение кислорода в ткани и ее рН, растет местное парциальное давление углекислого газа.
Т.о., изменения микроциркуляции при венозной гиперемии характеризуются значительным расширением венул и капилляров, замедлением скорости кровотока и темно-красным цветом крови в сосудах. Количество функционирующих капилляров как правило не изменяется.
Внешними признаками или симптомами венозной гиперемии являются: темно-красный или синюшно-багровый цвет органа (расширение и увеличение количества венозных сосудов, повышение показателя гематокрита из-за транссудации и увеличение % восстановленного гемоглобина в венозной крови), увеличение объема органа или участка ткани (расширение и переполнение сосудов кровью, отек), понижение температуры поверхностно распложенных тканей (уменьшение притока артериальной теплой крови).
Причины венозной гиперемии: механическое препятствие в венах – тромбоз, сдавление вены опухолью, увеличенной маткой при беременности, а также возрастание давления в крупных венах.
Ближайшие последствия венозной гиперемии: умеренная гипоксия ткани или органа, застойный стаз и отек или водянка. Хроническая венозная гиперемия сопровождается диапедезными кровоизлияниями в органах и тканях, атрофией и даже некрозами тех паренхиматозных клеток, которые наиболее аэробны, и переживанием и пролиферацией стромальных элементов органа, что приводит к органосклерозу.
СТАЗ.
Стазом называется полная остановка кровотока в сосудах. Различают следующие виды стаза:1) застойный – результат венозной гиперемии, вызвавшей повышение давления в венозных сосудах вплоть до уравнивания с артериальным (нарушен отток); 2) постишемический – результат ишемии, вызвавшей падения артериального давления до уровня венозного (нарушен приток); 3) истинный или капиллярный стаз – результат изменения вязкости крови и текучести ее по капиллярам. В реальных патологических процессах эти механизмы остановки кровотока могут комбинироваться, порождая смешанный стаз. Артериоло-венулярная разница по давлению как движущая сила кровотока утрачивается при застойном и постишемическом стазе, но сохранена при истинном. Застойный и постишемический стаз принципиально обратимы; истинный стаз обратим лишь вначале, т.к. по ходу его развития быстро наступают такие изменения клеток крови и плазмы, которые закрепляют непроходимость капилляров и венул.
Истинный стаз отличается значительным повышением капиллярного сопротивления току крови. По закону Пуазейля градиент давления dP=8LhQ/pr4, где h - вязкость крови, Q - объемная скорость кровотока, r - радиус сосуда, L – длина сосуда. При неизменном притоке решающее значение для сопротивления кровотоку будет иметь именно величина вязкости крови. Увеличение вязкости крови возникает, во-первых, в результате замедления скорости кровотока в микрососудах, которое часто предшествует стазу (например, при воспалении стаз развивается в условиях венозной гиперемии) и, во-вторых, в результате усиленной внутрисосудистой агрегации (скучивания) эритроцитов. Иногда агрегация эритроцитов предшествует замедлению кровотока, иногда эти два процесса развиваются параллельно.
Усиление агрегации эритроцитов обусловлено повреждением эритроцитов и потери ими деформируемости. Поверхность эритроцитов при агрегации становится неровной и как бы «пушистой». Создается также впечатление, что снаружи эритроцитов при этом появляется вязкий покров. Эритроциты соединяются друг с другом в «монетные столбики», движутся в сосуде, располагаясь не вдоль, а поперек него, наконец, образуют конгломераты-пробочки, которые могут закупорить микрососуд.
Стаз развивается легче при малой скорости крови, при увеличении гематокрита, например, в результате транссудации, в местах изгибов сосудов, при появлении на лейкоцитах и эндотелии «клейких» молекул – молекул адгезии, при увеличении в крови концентрации глобулинов, фибриногена.
Сначала происходит остановка крови непосредственно в ответ на действие повреждающих агентов, вызывающих стаз. Как только очаг такого стаза возникает, то кровоток обязательно останавливается на всем протяжении капилляра – выше и ниже очагов первоначального стаза. С течением времени стаз прогрессирует, развивается сладж (сам термин «sludge» в буквальном переводе с английского обозначает «густая грязь», «тина», «ил»). Сладжированная кровь имеет ряд отличий от нормальной. В микрососудах появляются агрегаты из эритроцитов, лейкоцитов, тромбоцитов. Четкое отграничение между поверхностью клеток и их плазмой теряется, развивается гомогенизации «монетных столбиков». Исчезает однородность потока крови, агрегаты становятся все более отчетливо различимы, а позже наступает их осаждение. Жидкая часть крови проходит преимущественно через стенки венул в ткани и кровь становится более вязкой. Стенки сосудов не получают адекватного питания и начинают терять свою нормальную форму.
Причинами истинного капиллярного стаза являются повреждение ткани как внешними (химическими, механическими, биологическими и др.), так и внутренними факторами, замедление кровотока, повышение гематокрита при полицитемиях, изменение свойств эритроцитов при анемиях и др.
Патогенное значение стаза крови в капиллярах в значительной степени зависит от того, в каком органе это происходит. Особенно опасен стаз в микрососудах головного мозга, миокарда и почек. Кроме того, стаз способствует образованию тромбов.
ИШЕМИЯ.
Ишемия – уменьшение кровенаполнения органа или ткани вследствие недостаточного притока. Возникает при непроходимости приводящей артерии и отсутствии (или недостаточности) коллатерального притока крови в данную сосудистую территорию.
При ишемии снижается приток крови, отток остается равный притоку. Давление в артериолах к периферии от места сужения падает сильно, а в венулах – менее значительно, градиент давлений уменьшен, что приводит к снижению линейной и более сильно объемной скорости кровотока. Исчезает деление на осевой и плазматический кровоток. В области ишемии в результате падения скорости крови наступает перераспределение эритроцитов в микрососудах – в капилляры поступает кровь, бедная эритроцитами (снижается местный гематокрит), и функционирующие капилляры превращаются в плазматические. Затем вследствие уменьшения внутрикапиллярного давления капилляры закрываются. Т.о., число функционирующих капилляров снижается. Из-за понижения внутрисосудистого давления понижается фильтрация жидкости из сосуда в ткань. Количество тканевой жидкости уменьшается, лимфоотток ослабляется вплоть до полной остановки. При ишемии прекращается доставка кислорода и энергетических материалов, кроме того, происходит накопление продуктов обмена веществ. Развивается гипоксия, гиперкапния и местный ацидоз.
В зависимости от этиологии различают обтурационную, компрессионную и нейроспастическую ишемию.
Обнаружено, что в клетках эндотелия после тяжелой ишемии снижается синтез окиси азота, что приводит к массивной адгезии нейтрофилов к стенкам микрососудов и сильно ухудшает их проходимость. В сосудах, в которых остались эритроциты, в результате их повреждения избытком метаболитов, уменьшением в них АТФ, развивается агрегация эритроцитов. Все это максимально опасно, когда кровоток уже остановлен. Тогда даже увеличение продольного градиента давлений в микрососудах в результате восстановления притока крови со стороны артерий (например, через коллатеральные пути) оказывается недостаточным, чтобы возобновить в них кровоток, и столб крови в микрососудах ишемизированной области остается неподвижен. Предполагают, что этим можно отчасти объяснить причины эффекта no-reflow, который делает невозможным быстрое восстановление кровообращения после длительной ишемии.
Т.о., изменения микроциркуляции при ишемии характеризуются значительным сужением микрососудов, замедлением скорости кровотока, исчезновением деления на осевой и плазматический кровоток и побледнением участка ткани. Количество функционирующих капилляров уменьшается.
Внешними признаками или симптомами ишемии являются: бледный цвет органа (сужение и уменьшение количества функционирующих сосудов, возрастание доли плазматических капилляров), небольшое уменьшение объема органа или участка ткани (уменьшение количества функционирующих сосудов, уменьшение тканевой жидкости), понижение температуры поверхностно распложенных тканей (уменьшение притока артериальной теплой крови). Могут появиться такие субъективные симптомы как боль, покалывание, онемение, «бегание мурашек».
Причинами ишемии являются: 1) полная или частичная закупорка приводящей периферической артерии или артериолы тромбом, эмболом; 2) патологической вазоконстрикцией (ангиоспазмом); 3) склеротическими или воспалительными изменениями артериальных стенок; 4) сдавлением артерий извне. Особой ситуацией, приводящей к ишемии, является коллатеральная ишемия при быстром перераспределении крови, например, в сосудах мозга при коллапсе.
Последствием кратковременной ишемии является снижение функциональных характеристик органа, длительной ишемии – гипоксический некробиоз. Местный некроз тканей, вызванный острым нарушением их кровообращения, называется инфарктом. Со временем на месте инфаркта развивается постнекротический склероз.
Ишемия магистрального артериального сосуда вызывает коллатеральную артериальную гиперемию по миопаралитическому механизму (действие накопившихся продуктов обмена веществ). Если коллатерали абсолютно достаточны, т.е. суммарный диаметр их не ниже диаметра непроходимой магистральной артерии, то инфаркт как правило не возникает (в конечностях, печени, тонком кишечнике, легких). В почках, сетчатке, селезенке, в бассейне средней мозговой артерии коллатерали абсолютно недостаточны, там часто встречаются инфаркты. Ряд органов имеет относительно достаточные коллатерали, например, сердце. Инфаркт миокарда обусловлен в этом случае поражением сосудов атеросклеротическим процессом. В результате нарушается функции эндотелия и миоцитов, что способствует тромбозу и ангиоспазму, может развиться значительное сужение коронарных сосудов (уменьшение диаметра до 75%).
ТРОМБОЗ.
Тромбозом называется прижизненное образование сгустка стабилизированного фибрина и форменных элементов крови на внутренней поверхности кровеносных сосудов с частичной или полной обтурацией их просвета.
Тромбы могут образовываться как в артериальных, так и венозных сосудах, отличающихся скоростью кровотока. Общим причинным фактором в этих двух типах сосудов является повреждение стенки сосуда. В артериальных сосудах быстрый кровоток снижает концентрацию плазменных коагуляционных факторов, поэтому в тромбогенезе ведущую роль играют тромбоциты. Они активируются, прилипают к месту повреждения и вместе с лейкоцитами за 2-5 мин. образуют белый тромб. Позднее в нем откладывается фибрин, в нитях которого застревают эритроциты и тромб превращается в красный. В венозных сосудах с медленным током крови одновременно с активацией тромбоцитов происходит и активация коагуляционного гемостаза с образованием фибрина, поэтому образуется красный тромб (за 4-9 мин.).
Последствием тромбоза в артериях является ишемия, постишемический стаз и некроз, в венах – венозная гиперемия и застойный стаз.
Тромбоз – сложный патологический процесс, этиология и патогенез которого изложены в методической разработке для самостоятельной работы студентов «Патофизиология системы гемостаза».
ЭМБОЛИЯ.
Эмболией называется закупорка артерий циркулирующими в крови частицами или конгломератами (эмболами), несвойственными нормальному кровотоку. Эмболы двигаются с током крови до наиболее узкого для них сосуда, застревают там и закупоривают сосуд. В результате на периферии от эмбола развивается ишемия и постишемический стаз, которые при недостаточных коллатералях вызывают инфаркт.
Эмболы, вызывающие инфаркты легких, заносятся из венозной системы большого круга кровообращения и «правого сердца»; вызывающие инфаркты миокарда, головного мозга, внутренних органов или конечностей – из «левого сердца» или легочных вен; вызывающие инфаркты печени – из непарных органов брюшной полости.
По происхождению эмболов все эмболии подразделяются на 2 группы. Эндогенные эмболии: 1) тромбоэмболия (более 90% всех случаев эмболии относится к этой подгруппе) – эмболия оторвавшимися от мест образования тромбами или их частицами; 2) жировая эмболия – эмболия капельками жира при переломах трубчатых костей или разможжении жировой клетчатки при травмах, продуктами агрегации хиломикронов крови: 3) тканевая эмболия – эмболия околоплодными водами, частицами тканей при травмах; 4) опухолевая эмболия – эмболия оторвавшимися кусочками опухоли при ее распаде, а также опухолевыми клетками при метастазировании. Экзогенные эмболии: 1) микробная и паразитарная эмболия – наблюдается при сепсисе, бактериемии и инвазии кровяных паразитов; 2) воздушная эмболия – эмболия пузырьками воздуха, попадающими из окружающей атмосферы в крупные вены, в которых кровяное давление может быть ниже атмосферного; 3) газовая эмболия – эмболия пузырьками газа, образующимися в крови при быстром понижении барометрического давления, например, при быстром подъеме водолазов или при разгерметизации кабины самолета.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Основная литература
1. Патологическая физиология (под редакцией А.Д.Адо, М.А.Адо, В.И.Пыцкого, Г.В.Порядина, Ю.А.Владимирова), Москва, 2000.
2. Общая патофизиология, А.Ш.Зайчик, Л.П.Чурилов, Санкт