Линлин Оу, Бин Сон, Хуэйминь Лян, Цзя Лю, Сяоли Фэн, Бин Дэн, Тин Сун & Лунцюань Шао
Благодаря своим уникальным физико-химическим свойствам наноматериалы семейства графенов GFN (ГФН) широко используются во многих областях, особенно в биомедицинских приложениях. В настоящее время многие исследования изучают биосовместимость и токсичность ГФН in vivo и in intro. Как правило, ГФН могут оказывать различную степень токсичности у животных или клеточных моделей, следуя различным путям введения и проникая через физиологические барьеры, впоследствии распределяясь в тканях или локализуясь в клетках, в конечном итоге выводясь из организма. В этом обзоре собраны исследования токсических эффектов ГФН в нескольких органах и клеточных моделях. Мы также указываем, что токсичность ГФН определяется различными факторами, включая боковой размер, структуру поверхности, функционализацию, заряд, примеси, агрегации и т. Д. Кроме того, было выявлено несколько типичных механизмов, лежащих в основе токсичности GFN, например, физическое разрушение, окислительный стресс, повреждение ДНК, воспалительная реакция, апоптоз, аутофагия и некроз. В этих механизмах (toll-подобные рецепторы -) TLR-, трансформирующий фактор роста β- (TGF-β-) и фактор некроза опухоли альфа - (TNF-α) зависимые пути вовлечены в сигнальную сеть путей, и окислительный стресс играет решающую роль в этих путях. В настоящем обзоре мы обобщаем имеющуюся информацию о регулирующих факторах и механизмах токсичности ГФН, а также предлагаем некоторые проблемы и предложения для дальнейших исследований ГФН с целью завершения токсикологических механизмов и предоставления предложений по повышению биологической безопасности ГФН и содействию их широкому применению.
..Материалы на основе графена обычно имеют размеры от нескольких до сотен нанометров и имеют толщину 1-10 нм, что также является определением "наночастиц’ или "наноматериалов". Благодаря своим исключительным физико – химическим свойствам графеновые материалы получили широкое применение в различных областях, в том числе в накопителях энергии; наноэлектронных устройствах; батареях; и биомедицинских приложениях, таких как антибактериальные препараты, биосенсоры, для визуализации клеток, доставки лекарств и в тканевой инженерии.
Наряду с увеличением применения и производства ГФН возрастает риск профессионального или экологического воздействия на ГФН. А в последнее время появились некоторые исследования воздействия ГФН в профессиональных условиях, и опубликованные данные показали, что профессиональное воздействие ГФН имеет потенциальную токсичность для рабочих и исследователей.
ГФН могут вызывать острые и хронические повреждения тканей, проникая через гематоэнцефалический барьер, гематоплацентарный барьер и т. д. А также накапливаясь в легких, печени, селезенке и т. д. Например, некоторые аэрозоли графеновых наноматериалов могут вдыхаться и в значительной степени осаждаться в дыхательных путях, а также легко проникать через трахеобронхиальные дыхательные пути и затем перемещаться вниз в нижние дыхательные пути легких, что приводит к последующему образованию гранулем, фиброзу легких и неблагоприятным последствиям для здоровья пораженных лиц. Токсикологические механизмы ГФН, продемонстрированные в последних исследованиях, в основном содержат воспалительный ответ, повреждение ДНК, апоптоз, аутофагию и некроз и т. д.
Легкие являются потенциальным входом наночастиц графена в организм человека через дыхательные пути. Ингаляционные наночастицы ГО(оксида графена) могут разрушать ультраструктуру и биофизические свойства пленки легочного сурфактанта (ЛС), являющейся первой линией защиты хозяина, и вызывать их потенциальную токсичность. Агломерированные или дисперсные частицы осаждаются на внутренней поверхности альвеол внутри альвеол и затем поглощаются альвеолярными макрофагами (АМs). Интратрахеально введенный графен может перераспределяться в печень и селезенку, проходя через воздушно-кровяной барьер. Графеновые квантовые точки (GQDs) с небольшим размером менее 100 нм могут пересекать гематоэнцефалический барьер. Многие наночастицы графена способны пересекать плацентарный барьер и сильно влиять на развитие эмбрионов. Внутривенно введенный графен поступал в организм через кровообращение и сильно задерживался в легких, печени, селезенке и костном мозге, а воспалительная клеточная инфильтрация, образование гранулем и отек легких наблюдались в легких. Было показано, что накопление оксида графена в легких увеличивается с увеличением вводимой дозы и размера частиц, но в печени оно значительно уменьшается.
Графен поступает в клетки различными путями. В основном физико-химические параметры, такие как размер, форма, покрытие, заряд, гидродинамический диаметр, изоэлектрическая точка и градиент рН, важны для того, чтобы позволить графену проходить через клеточную мембрану. Наночастицы диаметром <100 нм могут проникать в клетки, а наночастицы диаметром <40 нм - в ядро. Более крупные наночастицы оксида графена с белковым покрытием (PCGO) (~1 мкм) попадают в клетки главным образом через фагоцитоз, а более мелкие наночастицы PCGO (~500 нм) попадают в клетки главным образом через клатрин-опосредованный эндоцитоз.
Листы оксида графена могут прилипать и обвиваться вокруг клеточной мембраны, вставляться в липидный бислой или интернализироваться в клетку в результате взаимодействия с клетками.
Графены могут привести к острой воспалительной реакции и хроническому повреждению, нарушая нормальные физиологические функции важных органов. Интересно, что низкая доза оксида графена вызвала более серьезное повреждение желудочно-кишечного тракта, чем высокая. ГФН вызывают воспаление легких и были обнаружены в легком на 90-е сутки после однократной интратрахеальной инстилляции и могут даже транслоцироваться в лимфатические узлы легких после только носовой ингаляции. Высокая доза оксида графена, образующая агрегаты, может блокировать легочные кровеносные сосуды и приводить к одышке (асфиксии), а тромбоцитарные тромбы наблюдались при высоких концентрациях 1 и 2 мг/кг массы тела при парентеральном введении. Сообщается, что оксид графена нарушает альвеолярно-капиллярный барьер, позволяя воспалительным клеткам проникать в легкие и стимулировать высвобождение провоспалительных цитокинов. Фиброз и воспаление могут быть верифицированы повышенным уровнем белковых маркеров коллаген1, Gr1, CD68 и CD11b в легких. Использование Твина 80 для диспергирования FLG или плюронного поверхностно-активного вещества для диспергирования графена было предложено для снижения вероятности образования фиброза легких.
Токсичность в центральной нервной системе. Появились исследования, касающиеся потенциальных возможностей или рисков графена в мозге. Первичные графеновые хлопья снижали уровень рибонуклеиновой кислоты и скорость синтеза дезоксирибонуклеиновой кислоты у эмбрионов, что приводило к вредному влиянию на развитие мозговой ткани и наблюдалась атипичная ультраструктура мозга. Последние исследования ГФН в центральной нервной системе в основном связаны с применением, а не с токсичностью.
ГФН оказывают различное токсикологическое воздействие на мужскую и женскую репродуктивную систему. Данные показали, что ГО оказывает очень низкое или почти полное отсутствие токсического воздействия на мужскую репродукцию даже при высокой дозе путем внутрибрюшной инъекции. У самок мышей ситуация иная: они могли родить здоровое потомство после инъекции графена перед спариванием или на ранних сроках беременности, и только несколько аномальных плодов присутствовали среди пометов у самок, которым вводили ГО. Однако у беременных мышей были самопроизвольные аборты при любой дозе, и большинство беременных мышей умирало, когда высокая доза оксида графена вводилась на средних и поздних сроках беременности. Примечательно, что развитие потомства в группе высоких доз было задержано в период лактации. Высокая доза ГО снижала потребление воды матерями мышей при пероральном воздействии, что снижало выработку молока и, таким образом, задерживало рост потомства.
Цитотоксичность ГФН была верифицирована в различных клетках в отношении изменения жизнеспособности и морфологии клеток, разрушения целостности мембраны и индуцирования повреждения ДНК. Графены снижают адгезию клеток, индуцируют апоптоз клеток и проникают в лизосомы, митохондрии, клеточные ядра и эндоплазму. Они индуцировали повреждение ДНК за счет повышенной экспрессии белков p53, Rad 51 и OGG1 в клетках NIH-3 T3. Производные ГО резко снижали экспрессию дифференциальных генов, отвечающих за структуру и функции клеточной мембраны, такие как регуляция актинового цитоскелета, фокальная адгезия и эндоцитоз.
Многочисленные результаты показали, что графеновые материалы вызывают дозозависимую токсичность у животных и клеток, такую как повреждение печени и почек, образование гранулем легких, снижение жизнеспособности клеток и клеточный апоптоз.
Частицы оксида графена, как сообщается, вызывают морфологические изменения и значительный лизис, что приводит к высокому гемолизу в эритроцитах ( RBC). Разрушение мембраны RBC, вероятно, связано с сильными электростатическими взаимодействиями между отрицательно заряженными кислородными группами на поверхности оксида графена и положительно заряженными фосфатидилхолиновыми липидами на внешней мембране RBC.
Традиционно приготовленный оксид графена ГО часто содержит высокие уровни Mn2+ и Fe2+, которые являются высоко мутагенными для клеток. Неспецифическое высвобождение этих ионов из традиционно приготовленного ГО может привести к необычно высоким уровням цитотоксичности и разрушению ДНК.
Из-за высокого свободного поверхностного заряда наноматериалы могут легко образовывать “КОРОНЫ” с белками в биологических системах. Предполагается, что белковая корона влияет на циркуляцию, распределение, клиренс и токсичность наночастиц. В нескольких работах сообщалось, что оксид графена (ГО) образует короны ГО-белок с адсорбированными белками плазмы в сыворотке крови, и эти короны ГО-белок играют важную роль в решении судьбы биокинетического поведения ГО in vivo. Такие короны ГО-белок могут регулировать адгезию ГО к эндотелиальным и иммунным клеткам, как посредством специфических, так и неспецифических взаимодействий.
Проанализировав множество исследований, можно сделать вывод, что на токсичность графена влияет множество факторов. Эти факторы в совокупности во многих случаях в значительной степени изменяют токсичность ГФН. Научные исследования часто нуждаются в четком определении причины и следствия, которое должно содержать только один фактор, отличающийся одновременно, чтобы можно было определить действие этого единого фактора. Но в некоторых работах одновременно изучались несколько факторов, влияющих на токсичность ГФН, что привело к путанице результатов.
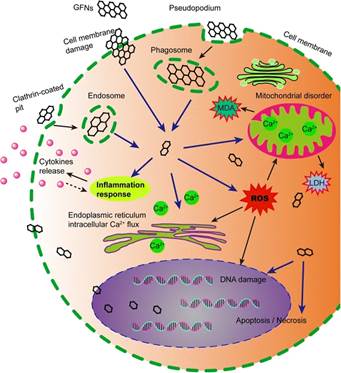
Графен способен физически разрушать клетки. Он является уникальным наноматериалом по сравнению с другими сферическими или одномерными наночастицами благодаря своей двумерной структуре с sp2-углеродами. Физическое взаимодействие наночастиц графена с клеточными мембранами является одной из основных причин цитотоксичности графена. Графен обладает высокой способностью связываться с α-спиральными структурами пептидов благодаря своей благоприятной кривизне поверхности. Он в значительной степени прилипает к поверхностям интактных клеток и приводит к аномальному растяжению клеточной мембраны. Сильные гидрофобные взаимодействия ГФН с клеточной мембраной приводят к морфологическому расширению филоподиальной и цитоскелетной дисфункции F-актина. Кроме того, заостренные края ГНС могут действовать как "лезвия", вставляя и прорезая клеточные мембраны.
Графен вызывает в клетках окислительный стресс, когда повышение уровня активных форм кислорода ROS подавляет активность антиоксидантных ферментов, включая каталазу, СОД или глутатионпероксидазу (GSH-PX). ROS действуют как вторые мессенджеры во многих внутриклеточных сигнальных каскадах и приводят к клеточным макромолекулярным повреждениям, таким как распад мембранных липидов, фрагментация ДНК, денатурация белков и митохондриальная дисфункция, которые значительно влияют на клеточный метаболизм и может привести к избыточной генерации ROS, что является первым шагом в механизмах канцерогенеза, старения и мутагенеза.
Графен вызывает деполяризацию мембран митохондрий и уменьшение их количества в клетках. Воздействие ГФН приводит к значительному увеличению связанного и несвязанного потребления кислорода митохондриями, диссипации мембранного потенциала митохондрий и, в конечном счете, запуску апоптоза путем активации митохондриального пути, ускоряя генерацию активных форм кислорода во время митохондриального дыхания в клетках. Образование •OH, опосредованное ГО и системой переноса электронов цитохрома-c/H2o2, может усиливать окислительный и термический стресс, нарушать систему митохондриального дыхания и в конечном итоге приводить к резкой токсичности. Поэтому, кроме повреждения плазматической мембраны и индукции окислительного стресса, ГФН могут вызывать апоптоз и/или некроз клеток, непосредственно влияя на митохондриальную активность клеток.
Благодаря своим небольшим размерам, высокой площади поверхности и поверхностному заряду оксид графена (ГО) может обладать значительными генотоксическими свойствами и вызывать серьезные повреждения ДНК, например, хромосомную фрагментацию, разрывы цепей ДНК, точечные мутации и окислительные аддукты ДНК и изменения. Даже если ГО не может проникнуть в ядро клетки, он все равно может взаимодействовать с ДНК во время митоза, когда ядерная мембрана разрушается, что увеличивает возможность аберраций ДНК. π-стэкинговое взаимодействие между углеродными кольцами графена и гидрофобными парами оснований ДНК может заставить сегмент ДНК "встать" или "лечь" на поверхность графена с его спиральной осью, перпендикулярной или параллельной соответственно. Межмолекулярные силы сильно деформируют концевые пары оснований ДНК, что потенциально повышает генотоксичность и может также индуцировать хромосомную фрагментацию, образование аддуктов ДНК и точечные мутации, способствуя окислительному стрессу или вызывая воспаление через активацию внутриклеточных сигнальных путей, таких как MAPK, TGF-β и NF-kB. Графен также может повышать экспрессию p53, Rad51 и MOGG1-1, которые отражают хромосомные повреждения, и снижать экспрессию CDK2 и CDK4, останавливая переход клеточного цикла из фазы G1 в фазу S в различных клетках. Такое повреждение ДНК может не только инициировать развитие рака, но и, возможно, угрожать здоровью следующего поколения, если в репродуктивных клетках возникает мутагенный потенциал ГО, что влияет на фертильность и здоровье потомства.
Графены ГФН могут вызывать значительную воспалительную реакцию, включая инфильтрацию воспалительных клеток, отек легких и образование гранулем в высоких дозах путем интратрахеальной инстилляции или парентерального введения. Тромбоциты являются важными компонентами образования тромбов для атаки патогенов и твердых частиц во время воспалительной реакции, и оксид графена может непосредственно активировать образование тромбов, богатых тромбоцитами, для окклюзии легочных сосудов после парентеральной инъекции. Например, сильный воспалительный ответ индуцировался подкожным введением ГО в течение 21 дня наряду с секрецией ключевых цитокинов, включая IL-6, IL-12, TNF-α, MCP-1 и IFN-g. ГФН может вызывать воспалительную реакцию и повреждение тканей, высвобождая цитокины и хемокины, которые приводят к рекрутированию циркулирующих моноцитов и стимулируют секрецию Th1/Th2 цитокинов и хемокинов. Кроме того, первичный графен и оксид графена вызывают воспалительный ответ, связываясь с toll-подобными рецепторами (TLR) и активируя сигнальный путь NF-kB в клетках. Сигнальный каскад NF-kB запускается TLRs и провоспалительными цитокинами, такими как IL-1 и TNF-α. При активации NF-kB смещается из цитоплазмы в ядро, облегчая связывание деградирующего IkB и действуя в качестве транскрипционного фактора для синтеза многочисленных провоспалительных цитокинов. Схема сигнального пути TLR4 и TLR9, активируемого GFNs, показана на рисунке ниже:
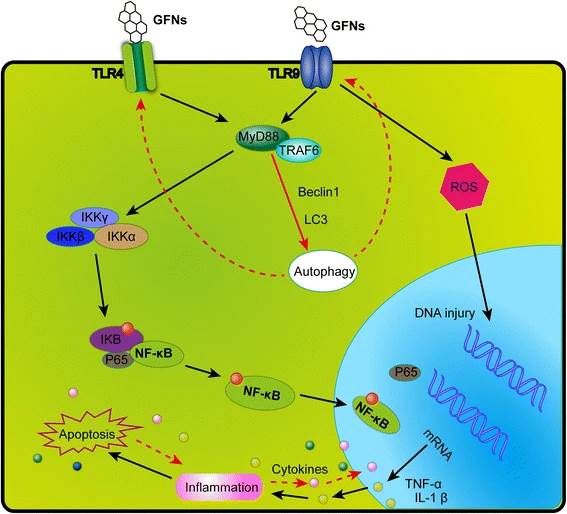
Апоптоз определяется как самоуничтожение клетки, регулируемое генами посредством сложных программ. Оксид графена (ГО) вызывает апоптоз и воспаление в легких после вдыхания. Кроме того, графен и ГО физически повреждают клеточные мембраны, увеличивают проницаемость наружной митохондриальной мембраны и изменяют митохондриальный мембранный потенциал; повышенный уровень активных форм кислорода запускает сигнальные пути MAPK и TGF-β и активирует каспазу-3 через митохондриально-зависимые апоптотические каскады, вызывая выполнение апоптоза. ГО вызывает апоптоз уже в низких дозах и в ранние сроки, запуская рецептор смерти и канонический митохондриальный путь.
Аутофагия - это процесс саморазложения клеточных компонентов и недавно признанная неапоптотическая гибель клеток. Активация аутофагии требует образования аутофагосомы, содержащей Беклин 1, множественные аутофагические белки (ATG), микротрубочко-ассоциированные белки легкой цепи 3 (LC3) и р62. Накопление аутофагосом связано с воздействием различных наночастиц, а аутофагия может удалять внеклеточные организмы и разрушать организмы в цитозоле. Оксид графена индуцирует накопление аутофагосом и превращение LC3-I в LC3-II; ингибируют деградацию белка аутофагического субстрата р62. Кроме того, оксид графена может одновременно вызывать реакции TLR4 и TLR9 в макрофагах. Путь аутофагии связан с фагоцитозом сигнализацией TLR в макрофагах.
Некроз. Некроз-это альтернативная форма гибели клеток, вызванная воспалительными реакциями или повреждением клеток. Воздействие на клетки первичного графена вызывает апоптоз и некроз в высоких дозах (50 мг/мл) [83]. По имеющимся данным, утечка LDH и открытие переходной поры проницаемости митохондрий, индуцированное повышенным уровнем цитоплазматического Са2+, приводят к апоптозу/некрозу. Было обнаружено, что оксид графена (ГО) индуцирует макрофагический некроз, активируя сигнализацию TLR4 и впоследствии частично вызывая аутокринную продукцию TNF-α...
пигенетические изменения
Эпигенетика включает метилирование ДНК, геномный импринтинг, материнские эффекты, глушение генов и редактирование РНК. Метилирование ДНК, являющееся одной из наиболее изученных эпигенетических модификаций, включает фосфорилирование, убиквитинирование и АТФ-рибозилирование и может приводить к ремоделированию хроматина. Недавно в статье сообщалось, что воздействие различных форм оксида графена приводит к глобальному гиперметилированию ДНК за счет усиления регуляции генов DNMT3B и MBD1. Лечение с помощью GNP вызывает гипометилирование за счет снижения экспрессии генов DNMT3B и MBD1. Оксид графена может активировать регуляторный путь miRNA-360 для подавления сигнального каскада повреждения ДНК-апоптоза, воздействуя на компонент CEP-1. Вместе взятые, эти данные предполагают, что графен и его производные могут вызывать тонкие изменения в программировании экспрессии генов путем модуляции эпигенетических изменений..
В заключение следует отметить, что во многих исследованиях обсуждаются репрезентативные механизмы токсичности ГФН, включающие четыре сигнальных пути: TLRs, TGF-β, TNF-α и MAPS. Эти четыре сигнальных пути являются коррелятивными и кросс-модуляторными, делая воспалительный ответ, аутофагию, апоптоз и другие механизмы независимыми и все же связанными друг с другом. Кроме того, окислительный стресс, по-видимому, играет наиболее важную роль в активации этих сигнальных путей. Сообщалось, что в исследованиях токсичности наноматериалов существуют пересечения апоптоза, аутофагии и некроза, они взаимно ингибируют или усиливают действие в некоторых условиях. Однако сигнальные пути токсичности ГФН, исследованные в работах на сегодняшний день, являются лишь небольшой частью сложной сети, и сеть сигнальных путей нуждается в детальном изучении в будущем.
https://particleandfibretoxicology.biomedcentral.com/articles/10.1186/s12989-016-0168-y