Коллоидные растворы. Молекулярно-кинетические и оптические свойства.
Строение коллоидных частиц.
Коллоидные растворы – гетерогенные системы, состоящие из дисперсионной среды (непрерывная фаза), дисперсной фазы (прерывная) и стабилизатора.
Отличия от истинных растворов
Коллоидные (ультрамикрогетерогенные) системы
· Прозрачные, опалесцирующие – рассеивают свет, дают конус Тиндаля. Видимы в ультрамикроскоп.
· Фильтруются через бумажный фильтр
· Частицы задерживаются ультрафильтратами (целлофаны, пергамент)
· Гетерогенные
· Относительно устойчивы, расслаиваются со временем
Молекулярные и ионные (истинные) растворы
· Прозрачные, неопалесцирующие, конус Тиндаля не наблюдается. Частицы не видимы в ультрамикроскоп.
· Частицы проходят через бумажный фильтр
· Частицы проходят через ультрафильтраты (мембраны)
· Гомогенные
· Устойчивы кинетически и термодинамически, не расслаиваются
КЛАССИФИКАЦИЯ
1. По размерам частиц

2. По агрегатному состоянию (границе раздела фаз)

3. По характеру взаимодействия дисперсной фазы
с дисперсионной средой: 
4. По структурно-механическим свойствам

По природе дисперсионной среды
Жидкая - лиозоли
Воздух - аэрозоли
Твердая – солидозоли
Способы получения золей
I. Дисперсионные - из грубодисперсных систем (измельчение)
a) Механическое дробление - осуществляют с помощью шаровых и коллоидных мельниц в присутствии жидкой дисперсионной среды и стабилизатора.
b) Электрическое диспергирование - используют для получения золей металлов. При получении органозолей (дисперсионная среда – органический растворитель) применяют высокочастотный искровой заряд.
c) Измельчение с помощью ультразвука (дробление почечных камней)
d) Пептизация - раздробление свежеприготовленных рыхлых осадков на отдельные коллоидные частицы при добавлении небольшого количества электролита - пептизатора. Пептизация имеет биологическое значение: рассасывание атероскле-ротических бляшек, почечных и печеночных камней, действие антикоагулянтов при тромбофлебитах сводится, в сущности, к явлению пептизации
II. Конденсационные – из истинных растворов (укрупнение).
a) Физические - метод замены растворителя.
Раствор вещества прибавляют к жидкости, в которой растворенное вещество мало растворимо и выделяется в виде высокодисперсной фазы. Золи серы, холестерина и канифоли получают добавлением спиртовых растворов этих веществ к воде.
b) Химические
1) Реакции восстановления

 Формула мицеллы золя золота
Формула мицеллы золя золота
2) Реакции окисления

 мицелла MnO2 (при электрофорезе движется к аноду)
мицелла MnO2 (при электрофорезе движется к аноду)
3) Реакции двойного обмена




4) Реакции гидролиза

Гидролиз используют для получения золей гидроксидов тяжелых металлов, повышая температуру и с увеличивая разведение.

Молекулярно-кинетические свойства.
1. Броуновское движение
При рассматривании в микроскоп тонкой суспензии (мастика) или эмульсии (разбавленное водой молоко) наблюдается хаотическое, беспорядочное движения частиц.
Броуновское движение в коллоидах отражает характер и законы теплового движения обычных молекул и описывается уравнением А.Эйнштейна - М.Смолуховского (1906):

2. Диффузия
Процесс направленного движения вещества из области бóльших концентраций в область меньших.
Закон Фика

Масса диффундирующего вещества прямо пропорциональна коэффициенту диффузии, площади поперечного сечения, градиенту концентрации и времени.
Формула Стокса-Эйнштейна

По коэффициенту диффузии (D) можно определить размер коллоидных частиц и величину макромолекул
3. Седиментация
Процесс оседания частиц дисперсной фазы в жидкой или газообразной среде под действием силы тяжести
Закон Стокса

Исследование седиментационного равновесия проводят в ультрацентрифугах, которые позволяют превышать ускорение силы тяжести в сотни тысяч раз.
Формула Сведберга

Способность к седиментации выражают константой Сведберга (S) – отношением скорости оседания к ускорению свободного падения.
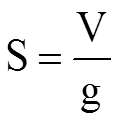 Единица измерения – Сведберг: S=1Сб=10-13 сек
Единица измерения – Сведберг: S=1Сб=10-13 сек
Ультрацентрифуги широко используются в химии белков, нуклеиновых кислот, вирусов и других клеточных структур для определения размера частиц и их фракционного состава.
Скорость оседания эритроцитов (СОЭ) – один из методов клинического анализа крови.
Проба свежей крови выдерживается в вертикально расположенном капилляре. Скорость оседания наблюдается визуально по перемещению окрашенной границы между слоями.
В норме СОЭ не превышает 10-12 мм/ч
При патологии СОЭ возрастает в связи с уменьшением агрегативной и седиментационной устойчивости крови.
4. Осмотическое давление
Величина, измеряемая минимальным гидравлическим давлением, которое нужно приложить к раствору, чтобы осмос прекратился.
Движущая сила осмоса - стремление к выравниванию концентраций.
Растворитель устремляется в область повышенной концентрации вещества. Процесс прекращается, когда давление становится равным атмосферному.
Закон Вант-Гоффа
Осмотическое давление пропорционально числу частиц растворенного вещества в единице объема раствора и не зависит от природы и массы частиц.
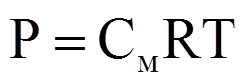
Осмотическое давление вещества в растворе равно тому давлению, которое оно оказывало, если бы находилось в том же объеме, будучи в газообразном состоянии.


Для 1М раствора любого вещества при T = 273 К; Росм = 2,27·106 Па (22,4 атм.).
Осмотическое давление коллоидных растворов незначительно и проводить наблюдения в обычных условиях очень трудно.
Коллоидная частица по сравнению с обычной молекулой обладает очень большой массой, поэтому при одинаковой массовой концентрации в коллоидном растворе содержится во много раз меньшее число частиц коллоида, чем в истинном растворе.
1%-ый коллоидный раствор золя золота с частицами в 1 ммкм имеет осмотическое давление, примерно в 20 раз меньше, чем 1%-ого раствора сахара при этих же условиях.