Пенза 2004
СОДЕРЖАНИЕ:
Введение…………………………………………………………………………3
1. Строение антител……………………………………………………………..4
1.1. Функциональные свойства антител…………………………………….4
1.2. Строение антител и их многообразие………………………………….7
1.3. Тонкая структура антител………………………………………………13
2. Молекулярные механизмы многообразия антител…………………...…….16
Список литературы………………………………………………………………28
ВВЕДЕНИЕ
По имеющимся оценкам, у мыши может вырабатываться от 106 до 1012 различных молекул антител, совокупность которых называют репертуаром. Этот репертуар, видимо, достаточно велик для того, чтобы почти для каждой антигенной детерминанты нашелся подходящий антиген-связывающий участок. Поскольку антитела представляют собой белки, а белки копируются генами, способность животного производить миллионы разных антител представляет собой чрезвычайно сложную генетическую проблему: как синтезировать миллиарды разных белков, не привлекая к этому чрезмерно большого числа генов. В решении этой проблемы участвует ряд уникальных вне генетических механизмов.
Строение антител
Иммунная система выработалась в процессе эволюции позвоночных для защиты от инфекций. Она состоит из миллиардов лимфоцитов и включает миллионы различных клонов. Лимфоциты каждого клона несут на своей поверхности рецептор, который позволяет им связывать ту или иную «антигенную детерминанту» - определенную группировку в молекуле антигена. Существуют два класса лимфоцитов: В-клетки, вырабатывающие антитела, и Т-клетки, которые осуществляют иммунные реакции клеточного типа.
Уже на ранних стадиях своего развития В- и Т-клетки с рецепторами для антигенных детерминант молекул собственного организма элиминируются или супрессируются; в результате иммунная система в норме способна отвечать только на чужеродные антигены. Связывание чужеродного антигена с лимфоцитом вызывает иммунный ответ, направленный против этого антигена. При этом некоторые из лимфоцитов пролиферируют и дифференцируются в клетки памяти, так что при вторичном воздействии того же антигена иммунный ответ развивается быстрее и оказывается гораздо более сильным.
Функциональные свойства антител
Единственная известная функция В-лимфоцитов – выработка антител. Уникальная особенность антител, отличающая их от всех других известных белков, состоит в том, что они могут существовать в миллионах разновидностей – каждая со своим уникальным участком для связывания антигена. В совокупности называемые иммуноглобулинами(сокращенно Ig) антитела образуют один из основных классов белков крови, составляя по весу примерно 20% суммарного белка плазмы.
Как и предсказывала гипотеза клональной селекции, все молекулы антител, производимые какой-то одной В-клеткой, имеют одинаковый антиген-связывающий участок. Первые антитела, синтезированные вновь образовавшейся В-клеткой, не секретируются; вместо этого они встраиваются в плазматическую мембрану, где служат рецепторами для антигена. Каждая В-клетка имеет на своей плазматической мембране приблизительно 105 таких молекул. Когда антиген присоединяется к молекулам антител на поверхности покоящейся В-клетки, это обычно инициирует сложную и малоизученную цепь событий, приводящую к клеточной пролиферации и дифференцировке с образованием клеток, секретирующих антитела. Такие клетки, вырабатывают большие количества растворимых (не связанных с мембраной) антител с таким же антиген-связывающим участком, что и у антител на поверхности клеток, и выделяют эти антитела в кровь. Активированные В-клетки могут начать секретировать антитела, будучи еще малыми лимфоцитами; конечная стадия этого пути дифференцировки - большая плазматическая клетка, которая выделяет антитела со скоростью около 2000 молекул в секунду. По-видимому, плазматические клетки используют для производства антител столь значительную часть мощности своего белоксинтезирующего аппарата, что не способны к дальнейшему росту и делению и погибают после нескольких дней секреции антител.
Простейшие молекулы антител имеют форму буквы Y с двумя идентичными антиген-связывающими участками – по одному на конце каждой из двух «ветвей» (рис. 1). Поскольку таких участков два, эти антитела называют валентными. Такие антитела могут сшивать молекулы антигена в обширную сеть, если каждая молекула антигена имеет три или большее число антигенных детерминант. Достигнув определенных размеров, такая сеть выпадает из раствора. Как мы увидим позже, тенденция больших иммунных комплексов к осаждению (преципитации)удобна для выявления антител и антигенов. Эффективность реакций связывания и сшивания антигена антителами значительно возрастает благодаря гибкому шарнирному участкув месте соединения обеих «ветвей» с «хвостом»: этот участок позволяет изменять расстояние между двумя антиген-связывающими участками (рис. 2). Защитное действие антител объясняется не просто их способностью связывать антиген. Они выполняют и целый ряд других функций, в которых участвует «хвост». Эта область молекулы определяет, что произойдет с антигеном, если он оказался связанным. Антитела с одинаковыми антиген-связывающими участками могут иметь весьма разные «хвостовые» области, а потому и разные функциональные свойства.
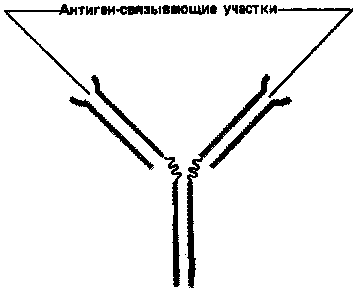
Рисунок 1. Сильно упрощенная схема молекулы антитела с двумя идентичными антиген-связывающими участками.
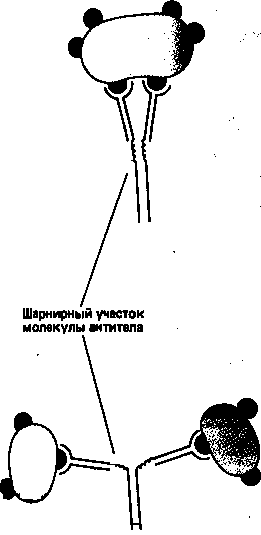
Рисунок 2. Шарнирный участок молекулы антитела повышает эффективность связывания молекул антигена и сшивания их друг с другом.
1.2. Строение антител и их многообразие
Основную структурную единицу молекулы антитела образуют четыре полипептидные цепи – две идентичные легкие (L-цепи, каждая примерно из 220 аминокислот) и две идентичные тяжелые (Н-цепи, каждая примерно из 440 аминокислот). Все четыре цепи соединены между собой с помощью некова-лентных взаимодействий и ковалентных связей (дисульфидных мостиков). Молекула состоит из двух одинаковых половинок, в которых L- и Н-цепи вносят почти равный вклад в построение двух идентичных антиген-связываю-щих участков (рис. 3).
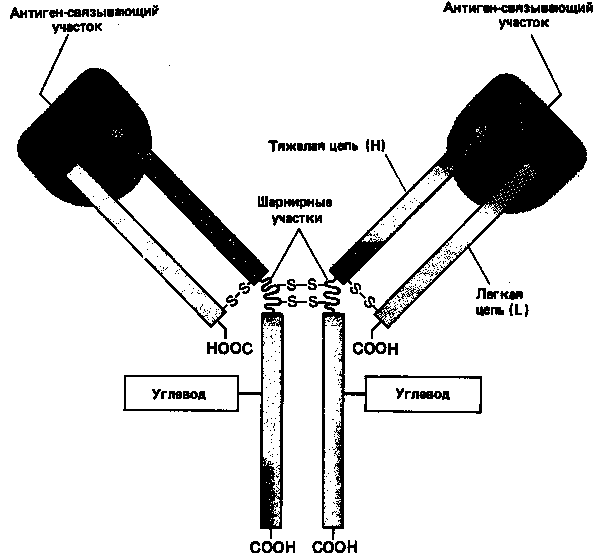
Рисунок 3. Схематическое изображение типичной молекулы антителу состоящей из двух идентичных тяжелых (Н) и двух идентичных лёгких (L) цепей. Антиген-связывающие участки формируются за счет комплекса N-концевых областей L- и Н-цепей, а область «хвоста» образуют только Н-цепи. Каждая цепь содержит одну или несколько олигосахаридных цепочек, функция которых не известна.
Протеолитические ферменты папаин и пепсин расщепляют молекулы антител на различные характерные фрагменты: папаиндает два отдельных идентичных Fab-фрагмента, каждый из которых обладает одним антиген- связывающим участком, и один Fc-фрагмент (Fab - сокращение слов fragment antigen binding; Fc означает «кристаллизующийся фрагмент» (от crystallizable).; пепсиндает один Р(аb')2-фрагмент, состоящий из двух ковалентно связанных Р(аb')-фрагмент (каждый из которых немного больше, чем Fab-фрагмент), и много более лёгких фрагментов (рис. 4). Поскольку Р(аb')2-фрагменты бивалентны в отличие от моновалентных Fab-фрагментов сохраняют способность связывать антигены и образовывать преципитаты. Ни один из этих фрагмент обладает другими биологическими свойствами нативных молекул антигенов поскольку они не содержат «хвостовой» (Fc) области, определяющей их свойства.
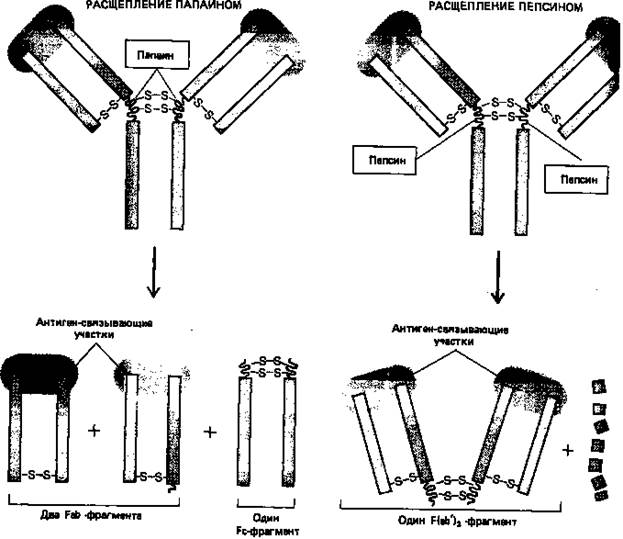
Рисунок 5. Различные фрагменты, образующиеся при расщеплении молекул антител двумя различными протеолитическими ферментами (папаином и пепсином), помогли исследователям в выяснении четырехцепочечной структуры антител.
Существует пять разных классов Н-цепей, каждый
со своими особыми биологическими свойствами
У высших позвоночных существуют пять разных классов антител – IgA IgE, IgG и IgM, каждый со своим классом Н-цепей – a, b, е, g, и m соответственно. Молекулы IgA содержат a-цепи, молекулы IgG-g-цепи. Кроме того, имеется ряд подклассов IgG и некоторых других иммуноглобулинов. Разные Н-цепи придают «хвостовым» областям антител различную конформацию и определяют характерные свойства каждого класса.
IgG-антитела составляют основной класс иммуноглобулинов, находящийся в крови. Они производятся в больших количествах при вторичномиммунном ответе. Fc-область молекул IgG связывается со специфическими рецепторами фагоцитирующих клеток, таких как макрофаги и полиморфноядерные лейкоциты, и в результате эти клетки могут более эффективно поглощать и разрушать внедрившиеся микроорганизмы, покрытые IgG-антителами (рис. 6).
Молекулы IgG-единственные антитела, которые могут переходить от матери к плоду. Клетки плаценты, соприкасающиеся с материнской кровью, имеют рецепторы, связывающие Fc-области молекул IgG и обеспечивающие тем самым их переход в плод. Антитела сначала поглощаются путем эндоци-тоза при участии рецепторов, а затем транспортируются через клетку и выводятся путем экзоцитоза в кровь плода. Антитела других классов не связываются с этими рецепторами и поэтому не могут проходить через плаценту.

Рисунок 6. Эта схема показывает, как бактерия, покрытая антителами IgG, эффективно фагоцитируется макрофагами, имеющими на своей поверхности рецепторы, способные связывать Fc-область молекулы IgG. Связывание бактерии с этими рецепторами активирует процесс фагоцитоза.
Хотя IgG-явно преобладающий класс антител, образуемых при большинстве вторичных иммунных ответов, на ранних стадиях первичного иммунного ответа в кровь поступают главным образом антитела IgM. В секретируемой форме IgM представляет собой пентамер, состоящий из пяти четырехцепочечных единиц, так что в общей сложности IgM имеет 10 антиген-связываю-щих участков. Такие пентамеры даже более эффективно, чем IgG, активируют систему комплемента, когда они связываются с антигеном. Каждый пентамер содержит полипептидную цепь еще одного типа, называемую J-цепью (joining chain, ~ 20 000 дальтон). J-цепь синтезируется IgM-секретирующими клетками, ковалентно встраивается между двумя смежными Fc-областями и, по-видимому, инициирует процесс олигомеризации. IgM-это также первый класс антител, продуцируемых развивающимися В-клетками, хотя многие В-клетки со временем переключаются на выработку антител других классов. Непосредственные предшественники В-клеток, так называемые пре-В-клетки, вырабатывают μ-цепи (но не легкие цепи) и накапливают их. Позднее, когда в пре-В-клетках начинают синтезироваться и легкие цепи, они соединяются с j-цепями, образуя с ними четырехцепочечные молекулы IgM (каждая с двумя μ-цепями и двумя легкими цепями), которые встраиваются в плазматическую мембрану, где служат рецепторами для антигена. С этого момента клетки становятся В-лимфоцитами и способны реагировать на антиген. Хотя встраиваться в мембраны (в качестве антиген-специфических рецепторов) и секретироваться в водорастворимой форме могут антитела всех классов, на поверхности большинства покоящихся В-клеток находятся главным образом антитела IgM и IgD. Удивительно, что лишь очень немногие В-клетки активируются для секреции антител IgD, и у этого класса не известно никакой функции, кроме роли рецепторов для антигена.
IgA-основной класс антител в секретах (молоке, слюне, слезах, секретах дыхательных путей и кишечного тракта). Они существуют либо в виде четы-рехцепочечного мономера (подобно IgG), либо в виде димера. Молекулы IgA в составе секретов представляют собой димеры, содержащие одну J-цепь, а также дополнительную полипептидную цепь, называемую секреторным компонентом, которую димеры IgA приобретают на поверхности эпителиальных клеток, выстилающих кишечник, бронхи или протоки молочных, слюнных или слезных желез. Секреторный компонент синтезируется эпителиальными клетками и экспонируется вначале на их базальной поверхности, где служит рецептором для связывания IgA из крови. Образующиеся комплексы IgA с секреторным компонентом поглощаются путем эндоцитоза при участии рецепторов, проходят через цитоплазму эпителиальной клетки и выводятся в проток на противоположной стороне клетки. В дополнение к такой транспортной роли секреторный компонент, возможно, защищает молекулы IgA от переваривания протеолитическими ферментами секретов.
Fc-область молекул IgE связывается со специфическими рецепторными белками на поверхности тучных клеток в тканях и базофильных лейкоцитов в крови с очень высоким сродством (> 1010 литров/моль). В свою очередь связанные молекулы IgE служат рецепторами для антигена: присоединение к ним антигена приводит к секреции клетками биологически активных аминов (в частности, гистамина, а у некоторых видов – серотонина). Их защитная функция менее ясна, однако предполагается, что они делают область воспаления более доступной для лейкоцитов, антител и компонентов комплемента.
1.3. Тонкая структура антител
Уникальная особенность антител состоит в том, что они существуют в огромном числе различных вариантов: каждый класс иммуноглобулинов содержит миллионы разных антител, каждое из которых отличается от других своим антиген-связывающим участком и аминокислотной последовательностью. Поэтому любой из таких видов антител составляет менее одной миллионной доли всех молекул иммуноглобулинов, имеющихся в крови. Этот факт поставил иммунохимиков перед чрезвычайно сложной проблемой белковой химии: каким образом можно получить достаточное количество какого-либо антитела для определения его аминокислотной последовательности и трехмерной структуры?
Проблема получения индивидуальных антител была решена благодаря специфическому свойству опухолевых клеток, образующихся при множественной миеломе – злокачественном заболевании, при котором в костном мозге развиваются множественные опухоли. Эти опухоли секретируют в кровь большие количества антител одного вида. Такие антитела гомогенны, или моноклональны, поскольку рак обычно начинается с неконтролируемого роста одной-единственной клетки; в данном случае это плазматическая клетка, секретирующая антитела. Антитело, накапливающееся в крови, называют миеломным белком.
Еще с прошлого столетия было известно, что моча больных, страдающих этим заболеванием, часто содержит необычные белки, названные белками Бене-Джонса– по имени английского врача, который их впервые описал. Однако только в 50-х годах нашего века выяснилось, что эти белки представляют собой свободные L-цепи иммуноглобулинов. Значительная часть сведений о детальной структуре антител была получена при изучении миеломных белков из мочи или крови больных или же белков от мышей, у которых были целенаправленно индуцированы аналогичные формы рака.
При сравнении аминокислотных последовательностей множества различных миеломных белков выявилась поразительная особенность, имеющая важный и неожиданный генетический подтекст. N-концевая часть последовательно как L-, так и Н-цепей чрезвычайно изменчива, а С-концевая - постоянна, пример, если сравнить аминокислотные последовательности большого числаразличных миеломных х-цепей (каждая длиной около 220 аминокислот) окажется, что С-концевые половины у них одинаковы или различаются незначительно, тогда как N-концевые половины все разные. Таким образом, L-цепи содержат константную областьпримерно из 110 аминокислот и вариабельную областьтакой же длины. N-концевая вариабельная область Н-цепи тоже состоит приблизительно из 110 аминокислот, а константная, в зависимости от класса антител, - из 330 или 440 аминокислот.
Именно N-концевые части L- и Н-цепей совместно образуют ант связывающий участок, и вариабельность их аминокислотных последователь- ностей обеспечивает структурную основу для разнообразия таких участков. В связи с существованием вариабельной и константной областей в молекулах антител возникают важные генетические проблемы. Но еще до того как стало возможным прямое изучение этих вопросов, в результате исследования миеломных белков выяснились другие черты структуры антител.
Каждая L- и Н-цепь содержит по три гипервариабельных области, которые совместно формируют антиген‑связывающий участок
Только часть вариабельной области непосредственно участвует в связывании антигена. Этот вывод вначале был сделан в результате оценки максимальных размеров антиген-связывающего участка. Первые измерения, в которых «молекулярными линейками» служили олигомеры разной величины, были проведены с использованием антител к декстрану - полимеру D-глюкозы. Так как для ингибирования связывания декстрана с антителами к нему применены сахариды, трисахариды и олигосахариды большей длины, состоящие остатков глюкозы, их действие возрастало с увеличением длины цепи примерно до шести мономеров; с олигосахаридами большей длины эффект не увеличивался. Это позволяло предполагать, что наиболее крупные антиген-связывающие участки могут контактировать самое большее с пятью или шестью сахарными остатками антигена. Поэтому казалось крайне маловероятным, что все 220 аминокислот вариабельных областей L- и Н-цепей вносят непосредственный вклад в построение антиген-связывающего участка. И действительно, теперь ясно, что связывающий участок антитела формируют всего лишь около 20-30 аминокислотных остатков вариабельной области каждой из цепей. Первым свидетельством в пользу этого явились данные об аминокислотных последовательностях, которые показали, что различия между вариабельными областями как в L-, так и в Н-цепях в основном ограничены тремя небольшими гипервариабельными областями в каждой цепи. Остальные части, известные под названием структурных областей, относительно константны. Эти данные позволяли предсказать, что антиген-связывающий участок образуют всего лишь 5-10 аминокислот каждой гипервариабельной области. Это предсказание было впоследствии подтверждено рентгеноструктурным анализом антител.
2. Молекулярные механизмы многообразия антител
После ознакомления с тем фактом, что громаднейшее разнообразие антител является необходимым условием правильного функционирования защитной системы организма, рассмотрим обеспечивающие это условие механизмы.