Введение
Цели работы определены следующим образом:
1. Изучить строение и свойства, а так же особенности строения ацетоуксусного эфира (АУЭ) на основе электронных представлений;
2. Рассмотреть особенности строения и свойств других β – дикарбонильных соединений;
3. Изучить кето-фенольную таутомерию моно- и β-дикарбонильных соединений экспериментально;
4. Изучить двойственную реакционную способность на примере АУЭ;
5. Изучить синтезы на основе АУЭ.
Задачи работы:
1. Подтвердить строение и свойства АУЭ на основе эксперимента;
2. Доказать связь ацетоуксусного эфира с другими классами органических соединений.
Обзор литературы
Класификация дикарбонильных соединений
Таблица 1. Физические свойства некоторых альдегидо- и кетокислот
| Кислота | Мr | Формула | Темпера- тура плавле- ния, 0 °С | Температу- ра кипения, 0 °С |
| Глиоксиловая Пропионовая | OHC-COOH | – 22 | – | |
| Пировиног-радная Масляная | CH3COCOOH | 13,6 – 6 | ||
| Ацетоуксус- ная Валериановая | CH3COCH2COOH | __ – 34 | 180 с разложением | |
| Левулиновая Капроновая | CH3COCH2CH2COOH | – 3 | 245 с разложением |
В таблице 1 приведены некоторые физические свойства первых представителей гомологического ряда альдегидо- и кетокислот. В сравнении с предельными одноосновными карбоновыми кислотами с той же молекулярной массой, оксокислоты заметно отличаются по физическим свойствам. Альдегидо- и кетокислоты обладают свойствами как карбоновых кислот, так и карбонильных соединений (альдегидов и кетонов). Кроме того они обнаруживают ряд специфических превращений, связанных с присутствием обеих функций и их взаимным влиянием. Оксокислоты проявляют более сильные кислотные свойства по сравнению с незамещенными карбоновыми кислотами. Повышение кислотных свойств связано с довольно сильным электроноакцепторным действием карбонильной группы (– I), которое приводит к усилению мезомерного эффекта карбоксильной группы и увеличению поляризации связи O – H. Индуктивный характер влияния подтверждается достаточно резким падением кислотных свойств по мере удаления карбонильной группы от карбоксильной вследствие затухания индукционного эффекта.

Ацетоуксусная кислота и ее эфир как С – Н кислоты
Гомологический ряд β-кетонокислот начинается ацетоуксусной кислотой. Она может быть получена осторожным омылением ее эфиров или присоединением воды к дикетену:
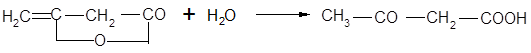
Важную роль в органическом синтезе играет этиловый эфир этой кислоты:

Он применяется для получения различных кетонов и кислот.
Одной из наиболее важных в синтетическом отношении реакций сложных эфиров, происходящих под действием оснований, является автоконденсация этилацетата, вызываемая этилатом натрия и приводящая к ацетоуксусному эфиру. Эта реакция носит название конденсации Кляйзена.

Этилацетат Ацетоуксусный эфир
Она интересна тем, что должна быть термодинамически невыгодной. Такое предположение оправдывается на практике. Было приложено немало усилий для того, чтобы отыскать условия, при которых выходы продукта конденсации имели практическую значимость.
Механизм конденсации Кляйзена: первая стадия представляет собой образование аниона этилацетата, который, будучи чрезвычайно сильным нуклеофилом, атакует карбонильный атом углерода второй молекулы сложного эфира. Элиминирование этилат-иона приводит далее к эфиру β – кислоты, этилацетоацетату.
С2Н5О- + Н+ – СН2СО2С2Н5  :- СН2СО2С2Н5 + С2Н5ОН
:- СН2СО2С2Н5 + С2Н5ОН

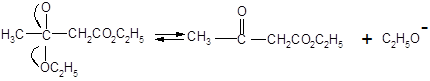
Все эти стадии в итоге приводят к невыгодному положению равновесия и удовлетворительные выходы β – кетоэфиров получают только в том случае, если равновесие оказывается возможным сдвинуть, удаляя один из продуктов. Это может быть достигнуто отгонкой этилового спирта; может, однако, оказаться трудным довести эту отгонку до завершения, а если исходный сложный эфир имеет низкую температуру кипения, то этот метод, естественно неприменим.
С другой стороны, можно применять большой избыток этилата натрия. Этот метод оказывается эффективным, так как этанол – более слабая кислота, чем фенол сложного эфира, и избыток этилата сдвигает равновесие вправо вследствие превращения β-кетоэфира в соль фенола.

Очевидно, что продукт конденсации необходимо получать из соли фенола и выделять в условиях, предотвращающих обратную реакцию распада на исходные реагенты. Наилучшим методом оказывается «замораживание» реакционной смеси, для чего ее вливают в избыток холодной разбавленной кислоты.
Особенностью ацетоуксусного эфира является то, что в одних реакциях он ведет себя как кетон, а в других как непредельный спирт. Эта необычная реакционная способность объясняется тем, что ацетоуксусный эфир представляет собой смесь двух таутомерных форм.
Под таутомерией понимается достаточно быстро устанавливающееся равновесие между изомерами, которые в обычных условиях не могут быть отделены друг от друга. Особенно распространена в органической химии так называемая прототропная таутомерия, при которой таутомерные изомеры отличаются друг от друга положением атома Н с одновременным перераспределением π – электронов. К ней относится триадная прототропная таутомерия.
По существу, прототропная таутомерия соответствует положению, когда одному и тому же основанию, благодаря наличию нескольких центров основности, соответствует несколько сопряженных кислот.
Классическим примером триадной прототропной таутомерии является кето-енольная таутомерия.
Ацетоуксусный эфир обычно существует в виде равновесной смеси кетонного и енольного таутомеров в отношении 92,5 к 7,5.

Кето-форма (92,5%) Енольная форма (7,5%)
Взаимопревращение енольной и кетонной форм ацетоуксусного эфира чрезвычайно чувствительно к катализу основаниями и, в меньшей степени, кислотами.

Однако в том случае, если контакт с веществами кислого или основного характера полностью исключен, скорость взаимного превращения снижается настолько, что оказывается возможным отделить более низкокипящий енол от кето-формы путем фракционной перегонки при пониженном давлении. Разделенные таким образом таутомеры устойчивы в течение сколь угодно долгого времени при хрании в кварцевых сосудах и t0 =800С.
Для установления содержания енольной и кето-форм в равновесной смеси разработан ряд методов. Обычно наиболее точными являются физические методы, так как при проведении химических определений всегда есть опасность сдвига равновесия под влиянием химического воздействия. Для установления состава аллелотропной смеси в случае ацетоуксусного эфира Кнорр применил рефрактометрический метод, он определил показатели преломления чистых десмотропных форм и показатель преломления их аллелотропной смеси.
Таблица 2
| nD10 | |
| Кето-форма | 1, 4225 |
| Енольная форма | 1, 4480 |
| Эфир (аллелотропная смесь) | 1, 4230 |
На основании того, что в данном случае между изменениями показателей преломления и изменением состава смеси имеется прямая зависимость, Кнорр рассчитал, что ацетоуксусный эфир содержит 2% енола и 98% кето-формы. Однако в дальнейшем было показано, что в этом случае рефрактометрический метод оказался непригодным вследствие того, что стекло призмы катализирует кето-енольное превращение ацетоуксусного эфира. Впоследствии было произведено определение показателя преломления тщательно очищенных обеих десмотропных форм ацетоуксусного эфира с учетом их изомеризации во время измерения. На основании этих данных было установлено, что обычный ацетоуксусный эфир содержит 7,4% енола.
Химическое определение содержания енольной и кето-форм может быть применено только в том случае, когда известно, что под влиянием реагента не происходит сдвига равновесия во время опыта. Вследствие этого реакция с FeCl3 не может быть применена.
Химический метод определения состава кето-енольной смеси был разработан Мейером. Он основан на том, что енольная форма практически моментально реагирует с бромом. Определение производят следующим образом. К спиртовому раствору ацетоуксусного эфира при – 70 С прибавляют избыток брома; поскольку нарушенное при бромировании равновесие постепенно вновь восстанавливается за счет перехода кето-формы в енол, избыток брома уничтожают путем добавления α-нафтола. Так как образовавшееся бромкетосоединение, содержание которого соответствует содержанию енола в аллелотропной смеси, количественно реагирует с HI с выделением свободного йода, к исследуемому раствору добавляют KI и серную кислоту; выделившийся йод оттитровывают. Весь процесс можно представить следующей схемой:
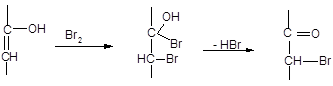

Вся работа до оттитровывания йода должна проводиться очень быстро (~ 15 сек).
В этих условиях бромистый водород, обычно способствующий енолизации ацетоуксусного эфира, не оказывает каталитического действия. Таким путем было установлено, что ацетоуксусный эфир содержит 7,7% енольной и 92,3% кето-формы. Свежеперегнанный эфир значительно более богат енольной формой, так как последняя имеет более низкую температуру кипения, чем кето-форма, вследствие чего положение равновесия кето-форма енол частично сдвигается вправо.
В различных растворителях содержание енольной формы различно: чем более полярен растворитель, тем большее содержание кетонной формы:
Таблица 3. Содержание енольной формы в различных растворителях
| Растворитель | Содержание енола, % |
| Вода | 0,4 |
| Метиловый спирт | 6,9 |
| Этиловый спирт | 12,0 |
| Диэтиловый эфир | 27,1 |
| Гексан | 46,4 |