енольный дикарбонильный эфир ацетоуксусный
1. Алкилирование ацетоуксусного эфира.
Анионы сложных эфиров типа ацетоуксусного могут быть проалкилированы алкилгалогенидами. Сложный эфир превращается при действии сильного основания в енолят-анион, и последний далее алкилируется по SN2 реакции алкилгалогенидом. Обычно преобладает С – алкилирование.
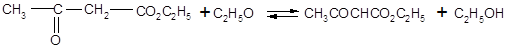
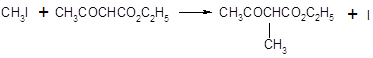
Ацетоуксусный эфир может быть гидролизован в кислых условиях до соответствующих кислот, которые при нагревании легко декарбоксилируются. Из алкилацетоуксусных эфиров при этом образуются метилалкилкетоны:
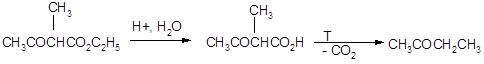
2. Ацилирование ацетоуксусного эфира.
Анионы сложных эфиров взаимодействуют с ацилгалогенидами, образуя продукты ацилирования. Эти реакции осуществляются с наибольшим успехом, если использовать для получения соли енол????????, а гидрид натрия, так как в этом случае не происходит образования спирта, способного реагировать с ацилгалогенидом.


3. Синтезы с АУЭ.
АУЭ широко используется в органическом синтезе. С его помощью можно синтезировать кетоны, модифицировать эфир с образованием различных производных. Целый ряд дополнительных возможностей для синтеза обеспечивают еноляты АУЭ, которые способны подвергаться алкилированию и ацилированию с образованием разнообразных замещенных ацетоуксусного эфира. В отличае от натриймалонового эфира эти реакции могут протекать как по атому гидроксильного кислорода, так и по соседнему углеродному атому. Механзм реакций SN2 в качестве нуклеофила выступает енолят – ион.
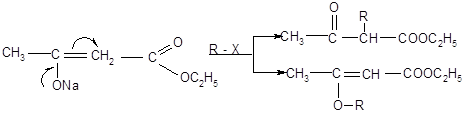
Направление замещения определяется несколькими факторами. Наиболее важным является природа реагента R – X. Чем более мягкой кислотой будет уходящая группа «Х», тем легче будет идти реакция по мягкому реакционному центру – атому углерода. Это и происходит при алкилировании енолята – аниона алкил – йодидами и – бромидами.
Возможности применения АУЭ в синтезах разнообразных продуктов расширяются благодаря его способности подвергаться расщеплению в двух направлениях. При нагревании с разбавленными растворами щелочей или кислот происходит распад образующейся после гидролиза ацетоуксусной кислоты с образованием кетонов. Обработка концентрированными растворами щелочей приводит к образованию из АУЭ двух молекул уксусной кислоты (кислотное расщепление):

Механизм кислотного расщепления состоит в нуклеофильной атаке гидроксил-ионом карбонильного углерода, несущего частичный положительный заряд. После присоединения гидроксида неустойчивый продукт распадается:
Пример синтеза с использованием АУЭ:

Экспериментальная часть
Опыт 1. Кислотные свойства ацетоуксусного эфира
Реактивы, посуда и приборы
Ацетоуксусный эфир………….5 мл Цилиндр (100 мл)………..1
Едкий натр (2% раствор)……100 мл Капельная воронка………1
Соляная кислота (10%)……….50 мл
Выполнение опыта
В цилиндр с ацетоуксусным эфиром приливают из капельной воронки разбавленную щелочь, пока не получится прозрачный раствор. При прибавлении соляной кислоты до кислой реакции (на бумажку конго) вновь выделяется ацетоуксусный эфир в виде маслянистого слоя.
Опыт 2. Получение натриевого производного ацетоуксусного эфира
Реактивы, посуда и приборы
Ацетоуксусный эфир (свеже – Колба (500 мл)………….1
перегнанный) ………………100 мл Холодильник……………1
Натрий металлический (в керосине Водяная баня……………1
или лигроине) ………………… 7 г Банка (50 мл)……………1
Фильтровальная бумага
Выполнение опыта
В колбу с обратным холодильником вводят ацетоуксусный эфир и бросают через холодильник мелконарезанные пластинки натрия, очищенные от корочки и обтертые от керосина. После того как весь натрий прореагирует, колбу с реакционной смесью охлаждают в бане с ледяной водой; при этом выпадает в осадок натриевое производное ацетоуксусного эфира. Так как натрий иногда не успевает в течении лекции раствориться полностью, осаждение натриевого производного можно показать на следующей лекции.
Опыт 3. Взаимодействие ацетоуксусного эфира с хлорным железом.
Реактивы и посуда
Ацетоуксусный эфир……….2 мл Цилиндр (200 мл)………1
Этиловый спирт (50%)….…50 мл
Хлорное железо (2%
раствор)……………….10 мл
Выполнение опыта
В цилиндре смешивают ацетоуксусный эфир со спиртом и приливают хлорное железо; появляется сине-фиолетовое окрашивание, характерное для енольной формы ацетоуксусного эфира.
Опыт 4. Взаимодействие ацетоуксусного эфира с уксуснокислой медью.
Реактивы и посуда
Ацетоуксусный эфир…….10 мл Цилиндр с притертой пробкой
Этиловый спирт…………..10 мл (50 мл)….………………………1
Уксусная медь (насыщенный
раствор)………………….10 мл
Аммиак (конц. раствор)… 3–5 мл
Выполнение опыта
В цилиндре смешивают ацетоуксусный эфир, спирт и уксуснокислую медь. При энергичном взбалтывании прибавляют несколько капель аммиака. Вскоре образуется кристаллическая масса, окрашенная в светло-зеленый цвет, – медное производное ацетоуксусного эфира.
Опыт 5. Кетонное расщепление ацетоуксусного эфира.
Реактивы, посуда и приборы
Ацетоуксусный эфир………10 мл Круглодонная колба (100 мл)…..1
Серная кислота (10%)……..20 мл Промывная склянка Тищенко….1
Баритовая вода……………..30 мл Стеклянные и резиновые трубки
Соответствующих размеров
Сборка прибора
Колбу соединяют с обратным холодильником, верхний конец которого закрывают пробкой с изогнутой вниз трубкой; последнюю соединяют с промывной склянкой, в которую налита баритовая вода.
Выполнение опыта
В колбу наливают ацетоуксусный эфир и серную кислоту. Реакционную смесь нагревают до кипения. При этом происходит разложение эфира с образованием ацетона и углекислого газа; последний с баритовой водой образует осадок углекислого газа.
Опыт 6. Таутомерия ацетоуксусного эфира
Реактивы, посуда и приборы
Ацетоуксусный эфир…..5 мл Цилиндр (200 мл)…………………..1
Хлорное железо (2% раст – Капельные воронки………………..2
вор)……………………25 мл
Бромная вода………….25 мл
Выполнение опыта
В цилиндре растворяют ацетоуксусный эфир в 100 мл воды и приливают из капельной воронки несколько миллилитров хлорного железа; через некоторое время появляется сине-фиолетовая окраска комплексной железной соли енольной формы. При прибавлении из второй капельной воронки бромной воды бром присоединяется к енольной форме и раствор обесцвечивается. Через несколько секунд окраска появляется снова, так как равновесие смещается и вновь появляется енольная форма; при дальнейшем прибавлении бромной воды окраска исчезает.
Опыт 7. Титрование енольной формы ацетоуксусного эфира
Реактивы, посуда и приборы
Ацетоуксусный эфир…..5 мл Капельные воронки ………………2
В-нафтол х.ч. (10% спир – Бюксы (маленькие)………………..3
товой раствор)………30 мл Конические колбы широкогорлые
Йодистый калий (5% (250 мл)…………………………..3
раствор) …………….30 мл Бюретки……………………………2
Этиловый спирт……..250 мл Склянка с притертой пробкой
Тиосульфат натрия (100 мл)…………………………..1
(0,1 н. раствор)…….150 мл Чашки фарфоровые ……………….2
Бром…………………..25 мл Водяная баня………………………1
Выполнение опыта
До лекции берут три навески ацетоуксусного эфира (приблизительно по 1.5.г). Спиртовой раствор β-нафтола, йодистый калий и спирт охлаждают в бане со льдом.
Приготовляют спиртовой раствор брома, для чего в склянку с притертой пробкой вливают 50 мл охлажденного спирта и приливают из капельной воронки бром до появления светло-красной окраски.
На лекции осторожно вносят бюкс с навеской ацетоуксусного эфира в коническую колбу, приливают 25 мл охлажденного спирта и колбу встряхивают до растворения эфира. К полученному раствору быстро прибавляют при взбалтывании спиртовой раствор брома до появления светло-красной окраски, после чего приливают спиртовой раствор β-нафтола до полного обесцвечивания. Затем из капельной воронки при охлаждении прибавляют раствор йодистого калия так, чтобы появился бурый цвет йода, и титруют тиосульфатом до исчезновения окраски йода.
Выводы
1. АУЭ относится к β-дикарбонильным соединениям;
2. Изучены особые свойства АУЭ. Разработан демонстрационный опыт по кето-енольной таутомерии АУЭ
3. Разработан видеофрагмент «Кето-енольная таутомерия АУЭ»