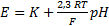Живой организм с точки зрения электрохимии можно рассматривать как открытую систему, состоящую из клеток и межклеточного пространства, заполненного раствором электролитов.
Удельная электрическая проводимость клеток составляет приблизительно 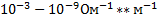 , а межклеточной жидкости -
, а межклеточной жидкости -  .
.
По электрической проводимости биологические жидкости и ткани можно расположить в такой последовательности: кровь, лимфа, ликвор, желчь  мышечная ткань, серое вещество мозга
мышечная ткань, серое вещество мозга  ткань легких, сердечная мышца, ткань печени
ткань легких, сердечная мышца, ткань печени 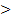 жировая ткань, костная ткань
жировая ткань, костная ткань 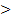 роговой слой эпидермиса кожи.
роговой слой эпидермиса кожи.
Изменение электрической проводимости тканей и клеток широко используют для диагностических целей. Патологические процессы, а также отмирание тканей приводят к изменению проницаемости клеточных мембран. Это, в свою очередь, приводит к тому, что уменьшается зависимость электрической проводимости от частоты тока, а при полной гибели клеток она вообще перестает зависеть от частоты тока. Так как электрическая проводимость клеток и тканей определяется концентрацией свободных ионов, по электр. проводимости судят о проницаемости клеточных мембран для ионов. Повышение электрической проводимости указывает на увеличение содержания свободных ионов, а уменьшение – на то, что их концентрация падает. Сравнение электрических проводимостей цитоплазмы и водного раствора, имеющего изоионный состав, позволяет определить долю свободных и связанных ионов.
Вопрос 18) Если две фазы содержат заряженные частицы (ионы и электроны), то при их контакте возможен переход частиц в неэквивалентном количестве из одной фазы в другую фазу. При этом в поверхностных слоях каждой из фаз возникают электрические заряды, равные по величине, но противоположные по знаку. Образуется двойной электрический слой (ДЭС)
ДЭС – это упорядоченное распределение противоположно заряженных частиц на границе двух фаз.
ДЭС характеризуется возникновением скачка потенциала. В зависимости от природы соприкасающихся фаз различают четыре вида электрических потенциалов:
1. Электродный потенциал, возникающий на границе металл-раствор, содержащий катионы этого металла.
2. Окислительно-восстановительный (редокс) потенциал, возникающий на границе инертный металл-раствор, содержащий сопряженную окислительно-восстановительную пару.
3. Диффузионный потенциал, возникающий на границе двух растворов, содержащих разные ионы или разные концентрации одних и тех же ионов.
4. Мембранный потенциал, возникающий по обе стороны мембраны, обладающей избирательной проницаемостью, разделяющей растворы различной концентрации. В живом организме содержится множество различных соприкасающихся фаз, содержащих ионы, поэтому возникновение межфазных потенциалов имеет важное значение для жизнедеятельности организма.
Электродные потенциалы. Электрод состоит из металла (электронного проводника) и раствора соли этого металла (ионного проводника). Схема электрода:
Ме │ Меz+
электронный проводник ионный проводник
Величина потенциала на границе металл–раствор зависит от: а) природы металла; б) активности ионов металла в растворе; в) температуры.
Стандартный электродный потенциал. Стандартный электродный потенциал 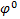 возникает на границе металл–раствор при активности потенциалопределяющих ионов в растворе 1 моль/л и Т = 298 К. Абсолютное значение о измерить или рассчитать невозможно. Определяют относительно стандартного электрода. По Международному соглашению в качестве стандартного электрода используют стандартный водородный электрод.
возникает на границе металл–раствор при активности потенциалопределяющих ионов в растворе 1 моль/л и Т = 298 К. Абсолютное значение о измерить или рассчитать невозможно. Определяют относительно стандартного электрода. По Международному соглашению в качестве стандартного электрода используют стандартный водородный электрод.
Вопрос 19) Гальванический элемент – это устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в электрическую энергию за счет пространственного разделения процессов окисления и восстановления.
Гальванический элемент состоит из двух электродов, соединенных во внешней цепи металлическим проводником, а во внутренней цепи – электролитическим мостиком – стеклянной трубкой, заполненной насыщенным раствором КСl, или пористой перегородкой. В гальваническом элементе различают анод и катод.
Анод – электрод, на котором протекает процесс окисления. Катионы металла переходят в раствор, масса анода уменьшается. Анод заряжается отрицательно.
Катод – электрод, на котором протекает процесс восстановления катионов металла из раствора, масса катода увеличивается. Катод заряжается положительно.
Условная запись гальванического элемента:
(–) Анод | Анодный раствор || Катодный раствор | Катод (+)
Способность гальванического элемента к переносу электронов во внешней цепи характеризуется электродвижущей силой (ЭДС). В обратимых условиях ЭДС гальванического элемента равна разности потенциалов катода и анода: Е = 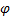 (катода) –
(катода) – 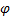 (анода).
(анода).
ЭДС гальванического элемента зависит от: 1) природы электродов; 2) активности потенциалопределяющих ионов в анодном и катодном растворах; 3) температуры.
Вопрос 20) Мембранный потенциал возникает между сторонами избиратель- но проницаемой мембраны, разделяющей два раствора различного состава, в результате направленного перехода ионов через эту мембрану.
Электрические потенциалы устанавливаются на клеточных мембранах возбудимых клеток. К возбудимым клеткам относятся нервные, мышечные и железистые клетки. Электрический импульс может передаваться вдоль мембраны. Возникновение биоэлектрических потенциалов определяется, главным образом, калий – натриевой избирательностью мембран и неравно- мерным распределением ионов между клеткой и внеклеточной средой, которое поддерживается механизмами активного переноса ионов, локализованными в мембране.
Мембранные потенциалы клеток подразделяются на потенциалы по- коя и потенциалы действия. Потенциал покоя – мембранный потенциал, возникающий между внутренней и наружной сторонами клеточной мембраны, находящейся в невозбужденном состоянии.
Согласно теории Ходжкина-Хаксли-Катца клеточная мембрана в состоянии покоя проницаема в основном для ионов калия. Ионы калия диффундируют по градиенту концентраций через клеточную мембрану в окружающую жидкость, анионы не могут проникать через мембрану и ос- таются на ее внутренней стороне, поэтому внутренняя поверхность мембраны имеет отрицательный заряд, а внешняя – положительный. Измеренное значение потенциала покоя во многих случаях соответствует вычисленному по уравнению Нернста. В некоторых случаях между измеренной и вычисленной величинами имеются значительные отличия. Это объясняется тем, что на величину потенциала покоя оказывает влияние диффузия ионов натрия.
Потенциал действия – амплитуда колебания (деполяризация и реполяризация) мембранного потенциала, возникающая при возбуждении клетки.
Потенциал действия, генерируемый нервной клеткой, может быть передан в мышечную клетку. Например, каждому биению сердца предшествует генерация большого по величине потенциала действия. Этот потенциал действия создает ток, который удается регистрировать с помощью электродов, размещенных на грудной клетке (электрокардиография).
Вопрос 21)
Окислительно- восстановительные (ОВ) или редокс- (redox) электроды (от латинских слов rеductio – восстановление и oxidatio – окисление) состоят из инертно- го металла, например, платины, погруженного в раствор, содержащий окисленную и восстановленную форму вещества: Pt | Ох, Red. Инертный металл в окислительно-восстановительных электродах не участвует непосредственно в электродной реакции, он является посредником в передаче электронов от восстановленной формы вещества (Red) к окисленной (Ох), а также ускоряет медленно устанавливающееся электродное равновесие, то есть служит катализатором электродной реакции: Ох + nē Red. Рассмотрим механизм возникновения окислительно-восстановительного потенциала. Если в водный раствор, содержащий частицы окисленной и восстановленной форм одного вещества, опустить платиновую пластинку, то в системе будет происходить обмен электронами. Частицы окисленной формы вещества могут присоединять электроны платины, превращаясь в восстановленную форму. Возможен и обратный процесс. Частицы восстановленной формы вещества, отдавая электроны пластине, будут превращаться в окисленную форму. В зависимости от природы окислительно-восстановительной системы и состава раствора возможны следующие случаи.
1. Активная концентрация восстановленной формы больше активной концентрации окисленной формы. В этом случае скорость процесса окисления в начальный момент будет больше скорости процесса восстановления, поэтому часть электронов останется на пластине и она приобретет относительно раствора отрицательный заряд.
2. Активная концентрация восстановленной формы меньше активной концентрации окисленной формы. При избытке в растворе окисленной формы вещества в начальный момент скорость окисления будет меньше скорости восстановления, по- этому часть электронов платины перейдет на частицы окисленной фор- мы вещества и платина приобретет относительно раствора положительный заряд.
3. Активные концентрации окисленной и восстановленной форм равны, но электронодонорная способность восстановленной формы не совпадает с электроноакцепторной способностью окисленной формы. В этом случае платиновая пластинка заряжается положительно, если преобладает электроноакцепторная способность системы, или отрицательно, если выше электронодонорные свойства.
Величина потенциала окислительно-восстановительных электродов зависит от: 1) природы окислительно-восстановительной пары; 2) соотношения активностей окисленной и восстановленной форм; 3) температуры.
Уравнение напишете сами.
Вопрос 22) Диффузионный потенциал возникает на границе раздела двух растворов, содержащих один электролит различной концентрации, или двух растворов различных электролитов вследствие различия в подвижности их катионов и анионов. Например, если два раствора хлороводородной кислоты разной концентрации разделить пористой перегородкой и привести в контакт между собой, то на границе раздела возникает процесс взаимной диффузии.
Так как подвижность ионов 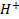 больше подвижности ионов
больше подвижности ионов 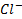 , то они распределяются неравномерно по отношению к границе раздела. Раствор 2 с меньшей концентрацией НСl приобретает заряд более подвижных ионов Н+. Возникающая разность потенциалов называется диффузионным потенциалом (
, то они распределяются неравномерно по отношению к границе раздела. Раствор 2 с меньшей концентрацией НСl приобретает заряд более подвижных ионов Н+. Возникающая разность потенциалов называется диффузионным потенциалом (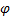 диф.). Диффузионный потенциал тормозит более «быстрые» ионы и ускоряет более «медленные», так как силы электрического поля направлены против сил диффузии. Диффузионный потенциал не является равновесным, но в обычных условиях остается – постоянным в течение долгого времени. Диффузионный потенциал рассчитывают по уравнению Гендерсона.
диф.). Диффузионный потенциал тормозит более «быстрые» ионы и ускоряет более «медленные», так как силы электрического поля направлены против сил диффузии. Диффузионный потенциал не является равновесным, но в обычных условиях остается – постоянным в течение долгого времени. Диффузионный потенциал рассчитывают по уравнению Гендерсона.
В биологических системах диффузионный потенциал возникает при механическом повреждении клеток, поэтому его называют потенциалом повреждения.
Вопрос 23)
Потенциометрия – физико-химический метод анализа, позволяющий определять активности (концентрации) ионов на основании измерения электродвижущей силы (ЭДС) обратимой гальванической цепи, состоящей из электрода сравнения и электрода определения, опущенных в исследуемый раствор.
Электрод, потенциал которого зависит от активности (концентрации) определяемых ионов в растворе, называется индикаторным или электродом определения. Для измерения потенциала индикаторного электрода в раствор погружают второй электрод, потенциал которого не зависит от концентрации определяемых ионов. Такой электрод называется электродом сравнения. В потенциометрии используют два основных класса индикаторных электродов. 1) Электроды, на межфазных границах которых протекают реакции с участием электронов. Такие электроды называют электронообменными. 2) Электроды, на межфазных границах которых протекают ионообменные реакции. Такие электроды называют мембранными или ионообменными, их называют также ионоселективными. Потенциометрический анализ широко применяется для непосредственного определения активности ионов, находящихся в растворе (прямая потенциометрия – ионометрия), а также для индикации точки эквивалентности при титровании по изменению потенциала индикаторного электрода в ходе титрования (потенциометрическое титрование).
Вопрос 24)
Электрод сравнения – это электрод потенциал которого практически постоянен, легко воспроизводим и не зависит от протекания побочных реакций. Наиболее часто применяемым электродом сравнения является хлорсеребряный электрод, который состоит из серебряной проволоки, покрытой слоем хлорида серебра. Электрод погружают в раствор хлорида калия, который находится в сосуде, связанном с анализируемым раствором солевым мостиком.
Схема хлорсеребряного электрода: Ag | AgCl, KCl
Постоянство потенциала электрода сравнения достигается поддержанием в контактирующем внутреннем растворе постоянной концентрации вещества (хлорида калия), на которое реагирует электрод.
Вопрос 25) Электрод, потенциал которого зависит от активности (концентрации) определяемых ионов в растворе, называется индикаторным или электродом определения.
Индикаторные электроды. Электронообменные электроды. В окислительно-восстановительных реакциях в качестве индикаторных электродов часто применяют инертные металлы, например, платину, золото. Металлические индикаторные электроды изготавливают из плоской металлической пластинки, скрученной проволоки или металлизированного стекла. Отечественная промышленность выпускает тонкослойный платиновый электрод. Ионоселективные электроды (ИСЭ). Ионоселективные электроды делят на группы: стеклянные; твердые электроды с гомогенной или гетерогенной мембраной; жидкостные электроды (на основе ионных ассоциатов, хелатов металлов или нейтральных лигандов); газовые электроды; электроды для измерения активности биологических веществ. Ионоселективные электроды состоят из ионоселективной мембраны, внутреннего контактирующего раствора и внутреннего электрода сравнения:
внешний раствор | мембрана | внутренний раствор, AgCl | Ag
ИСЭ
Стеклянный водородный электрод состоит из тонкостенного шарика из электродного стекла, заполненного раствором хлороводородной кислоты с концентрацией 0,1 моль/л. В раствор хлороводородной кислоты погружен хлорсеребряный электрод. Стеклянная мембрана является неорганическим катионитом на основе оксида кремния и оксидов щелочных и щелочноземельных металлов. В результате ионного обмена при вымачивании электрода в растворе HCl на поверхности стекла образуется тонкая пленка геля поликремниевой кислоты, незначительно диссоциированной на ионы:
Анионы поликремниевой кислоты сообщают поверхности стекла отрицательный заряд. Ионы водорода заряжают прилегающий к поверхности стекла слой раствора положительно, поэтому скачок потенциала на границе раздела стекловодный раствор зависит от рН среды.
Схема стеклянного электрода:
| стекло | HCl (a = 0,1М), AgCl | Ag
Вопрос 26)
Для определения рН биологических жидкостей составляют гальванический элемент из стеклянного водородного электрода и хлорсеребряного электрода сравнения.
Схема гальванического элемента для измерения
рН Ag, AgCl | HCl | стекло | исследуемый раствор || KCl | AgCl, Ag
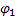
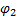
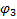
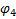
Электрод определения электрод сравнения
ЭДС этой цепи определяется алгебраической суммой потенциалов: 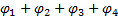 . Скачки потенциалов
. Скачки потенциалов 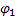 ,
, 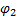 ,
, 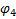 постоянны, следовательно, ЭДС цепи изменяется в зависимости от потенциала 3, зависящего от рН исследуемого раствора:
постоянны, следовательно, ЭДС цепи изменяется в зависимости от потенциала 3, зависящего от рН исследуемого раствора: