Дамы и господа – удачи на экзамене
1.Поясните понятие идеальный газ. Какие параметры характеризуют состояние газа? Как определяется абсолютное давление газа?
Идеальный газ – газ, между частицами которого отсутствуют силы взаимодействия, а частицы, имеющие массу, рассматриваются как материальные точки, не имеющие объема.
К параметрам, характеризующим состояние газа, относятся давление р, температура Т и объем V. Давление р газа (Па) – сила газа, действующая на единицу площади стенки сосуда, в котором заключен газ; эта сила обусловлена ударами беспорядочно движущихся молекул газа о стенки сосуда. 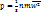 n – концентрация молекул (число молекул, содержащихся в единице объема), m – масса молекулы, n – концентрация молекул (число молекул, содержащихся в единице объема), m – масса молекулы, 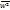 – среднеквадратическая скорость. Температура Т (К)– параметр, характеризующий среднюю кинетическую энергию теплового движения частиц – среднеквадратическая скорость. Температура Т (К)– параметр, характеризующий среднюю кинетическую энергию теплового движения частиц 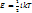 , где , где  – число степеней свободы молекул газа ( – число степеней свободы молекул газа (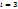 для 1-атомных газов, для 1-атомных газов, 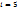 для 2-атомных газов, для 2-атомных газов, 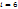 для многоатомных газов), для многоатомных газов),  =1,38∙10-23 Дж/К – постоянная Больцмана. Объем V (м3), Удельный объем – объем единицы массы вещества. V=V/M, м3/кг. Плотность – масса единицы объема вещества. ρ=M/V, кг/м3.
Абсолютное давление в атмосфере рабс=рбар измеряется барометром Вt, мм. рт. ст. В закрытом сосуде при давлении больше атмосферного рабс= рбар+ризб, избыточное давление измеряется манометром. В закрытом сосуде при давлении меньше атмосферного рабс=рбар-рразр, разрежение измеряется вакууметром. =1,38∙10-23 Дж/К – постоянная Больцмана. Объем V (м3), Удельный объем – объем единицы массы вещества. V=V/M, м3/кг. Плотность – масса единицы объема вещества. ρ=M/V, кг/м3.
Абсолютное давление в атмосфере рабс=рбар измеряется барометром Вt, мм. рт. ст. В закрытом сосуде при давлении больше атмосферного рабс= рбар+ризб, избыточное давление измеряется манометром. В закрытом сосуде при давлении меньше атмосферного рабс=рбар-рразр, разрежение измеряется вакууметром.
| 2.Напишите уравнение состояния идеального газа для 1 кг, для любого количества газа в кг, для 1 киломоля, для любого количества газа в киломолях. Поясните физический смысл индивидуальной и универсальной газовых постоянных.
Для 1 кг – pV=RT Для М кг – pV=MRT Для 1 кмоля – pVµ=RµT Для N кмолей – pVµ=RµNT
R (Rµ/µ) – индивидуальная газовая постоянная. Она представляет собой работу изменения объема, совершаемую 1 кг рабочего тела при изменении его температуры на 1 К в изобарном процессе, Дж/(кг∙К).
Rµ – универсальная газовая постоянная. Она представляет собой работу изменения объема, совершаемую 1 киломолем рабочего тела при изменении его температуры на 1 К в изобарном процессе, Дж/(кмоль∙К) Rµ=8314 Дж/(кмоль∙К)
| | 3.Сформулируйте закон Дальтона и напишите его математическое выражение. Поясните понятие массовая доля, объемная доля, молярная доля. Докажите равенство объемной и молярной долей.
Закон Дальтона – давление смеси идеальных газов равно сумме парциальных давлений каждого газа в смеси. р=∑рi; рi=pri
Массовая доля компонента смеси есть отношение массы компонента к массе смеси. gi=Mi/M, ∑gi=1
Объемная доля компонента смеси есть отношение объема компонента к объему всей смеси. ri=Vi/V=Ni/N
Молярная доля компонента смеси есть отношение числа киломолей компонента к общему числу киломолей всех веществ имеющихся в смеси. ni=Ni/N
Обозначив молярный объем компонента Vµi, а смеси Vµ, имеем Ni=Vi/ Vµi; N=V/ Vµ, ni=Vi/V=ri, следовательно, для идеальных газов молярные и объемные доли численно равны друг другу.
| 4.Поясните понятие парциальное давление и парциальный объем. Приведите запись уравнения состояния для газовой смеси и 1-го компонента газовой смеси с использованием парциального давления и парциального объема.
Парциальным называется давление, которое имел бы газ, входящий в состав смеси, если бы он один занимал объем, равный объему смеси, при той же температуре.
Объем, который занимал бы компонент смеси при температуре и давлении смеси, называется парциальным объемом.
рсмVcм=МсмRсмТ; рсмVcм=8314NсмТ piVсм=МiRiT; piVсм=8314NiT рсмVi=MiRiT; рсмVi=8314 NiT
| | 5.Дайте определение понятия «удельная теплоемкость». Рассмотрите зависимость теплоемкости от природы вещества, от состояния газа (температуры и давления), от характера процесса. Поясните понятие истинной и средней теплоемкостей. Как определить среднюю теплоемкость для интервала температур Т1…Т2, пользуясь зависимостью средних теплоемкостей в интервале температур от 0 до Т и зависимостью истинной теплоемкости от температуры?
Удельная теплоемкость – количество теплоты, необходимое для изменения температуры единицы количества газа в данном процессе на 1 К. В зависимости от единицы количества газа используется теплоемкость: массовая (с, Дж/(кг∙К), объемная (с’, Дж/(м3∙К), молярная (сµ, Дж/(кмоль∙К).
Влияние природы газа: чем больше атомов в молекуле (не более трех), тем больше теплоемкость.
Влияние температуры: теплоемкость двух- и многоатомных газов с ростом температуры увеличивается, а показатель адиабаты уменьшается; теплоемкость и показатель адиабаты 1-го атомного газа от температуры не зависит. Теплоемкость реальных газов зависит так же от давления.
Влияние характера процесса: в общем случае теплота затрачивается на изменение внутренней энергии газа и на совершение им работы. Таким образом, чем больше доля подводимой теплоты, которая идет на совершение работы, тем больше теплоемкость.
| 5(продолжение).
Истинная теплоемкость – отношение бесконечно малого количества теплоты, подведенного к единице газа, к вызываемому при этом бесконечно малому повышению его температуры. 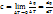 Средняя теплоемкость – количество теплоты, необходимой для нагревания единицы количества газа на 1 К в среднем за рассматриваемый интервал изменения температуры от Т1 до Т2.
Средняя теплоемкость – количество теплоты, необходимой для нагревания единицы количества газа на 1 К в среднем за рассматриваемый интервал изменения температуры от Т1 до Т2. 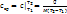 , , 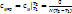
 При известной Зависимости с При известной Зависимости с  =f(T) в процессе 1–2 q12=c =f(T) в процессе 1–2 q12=c  T2 - c T2 - c  T1, с другой стороны q12= T1, с другой стороны q12= 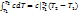 , поэтому с , поэтому с 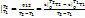 . По зависимости истинной теплоемкости с=f(T) вместо интегрирования приближенно определяют . По зависимости истинной теплоемкости с=f(T) вместо интегрирования приближенно определяют 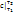 при средней температуре Тср= при средней температуре Тср= 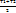 , с , с 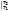 ≈c(Тср) ≈c(Тср)
| | 6.Докажите, что теплоемкость в изобарном процессе больше, чем в изохорном. Запишите Уравнение Майера. В каких процессах теплоемкость имеет отрицательное значение? Поясните физический смысл отрицательного значения теплоемкости.
В изохорном процессе вся подводимая теплота идет на изменение внутренней энергии, а в изобарном часть теплоты затрачивается на совершение газом работы, то есть для 1 кг газа при ∆Т=1К; СV=∆U; CP=∆U+l; CP-CV=l, где l – работа 1 кг газа при нагревании 1 К при постоянном давлении, по этому определению l=R.
Уравнение Майера: CP-CV=R; CµP-CµV=Rµ=8314 Дж/(кг∙К)
В каких процессах теплоемкость имеет отрицательное значение? Поясните физический смысл отрицательного значения теплоемкости.
| 7.Сформулируйте первый закон термодинамики и приведите его аналитическое выражение. Что означает невозможность осуществления вечного двигателя первого рода? Поясните понятие «коэффициент разветвления теплоты». Приведите дифференциальные уравнения, устанавливающие для реального и идеального газов зависимость внутренней энергии и энтальпии от параметров состояния. Почему внутренняя энергия и энтальпия считаются функциями состояния газа?
Первый закон термодинамики – частный случай всеобщего закона сохранения энергии: энергия не исчезает и не создается вновь, она лишь может переходить от одного тела к другому или превращаться из одного вида в другой в равных количествах. Теплота, подводимая к рабочему телу, затрачивается на изменение его внутренней энергии и совершение им работы. dQ=dU+dL, для 1 кг dq=du=dl, q=∆u=l=CV(T2-T1)+ 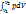 .
Невозможно в каком либо механизме периодически получать работу, не подводя энергию извне. Таким образом, вечный двигатель первого рода невозможен. Вечный двигатель первого рода – гипотетический двигатель, способный производить работу, не получая энергию извне. Теплота, подведенная к рабочему телу, расходуется на увеличение его энтальпии и располагаемой работы. dq=dh+dl0, q=cP(T2-T1)- .
Невозможно в каком либо механизме периодически получать работу, не подводя энергию извне. Таким образом, вечный двигатель первого рода невозможен. Вечный двигатель первого рода – гипотетический двигатель, способный производить работу, не получая энергию извне. Теплота, подведенная к рабочему телу, расходуется на увеличение его энтальпии и располагаемой работы. dq=dh+dl0, q=cP(T2-T1)- 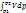 .
Поясните понятие «коэффициент разветвления теплоты» .
Поясните понятие «коэффициент разветвления теплоты»
| 7(продолжение 1) 
| 7(продолжение №2) 
| 8, Первый закон термодинамики.
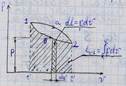
- Равновесное состояние –если каждый из параметров системы имеет одинаковые численные значения во всех точках системы.
-Обратимый процесс-процесс который может происходить как в прямом так и в обратном направлении,при возвращении в первоначально состояние,система проходит все равовесные состояния но в обратном порядке.
-Усл-я обратимости проц.: бесконечо медленное прохождение при бесконечно малой разности давлений системы и окр. Среды.время перехода от одного равновесног состояния к другому больше времени релаксации(переход от неравновес к равновес сост).;
обментеплотой между системой и окр. Средой при малой разности температур.
 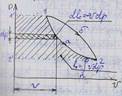 Реальные процессы необратимы так как невозможно вернуть затраченную энергию.
в природе нет строго консервативных систем, в любой реальной системе действуют силы трения.
Реальные процессы необратимы так как невозможно вернуть затраченную энергию.
в природе нет строго консервативных систем, в любой реальной системе действуют силы трения.
| 9. Термодинамические процессы
Политропный процесс-при неизменной теплоемкости с.
(PV)^n=const
n=(C-Cp)/(C-Cv) – показатель политропы.
С=Сv*(n-k)/(n-1) –теплоемкость политропного процесса, где k=Cp/Cv –показ.адиабаты.
При условии независимости изохорной теплоемкости от температуры в политропном процессе остается неизменным,а распределение подведенной теплоты на изменение внутр энергии рабочего тела и совершение работы.
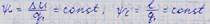 ψu - коэффициент разветвления теплоты
ψu + ψ l = 1 ψu=(n-1)/(n-k) q=Cv*(n-k)*(T2-T1)/(n-1)
ʌU=Cv*(T2-T1) - для нахождения показателя политропы логарифмируем уравнение PV^n = const
ψu - коэффициент разветвления теплоты
ψu + ψ l = 1 ψu=(n-1)/(n-k) q=Cv*(n-k)*(T2-T1)/(n-1)
ʌU=Cv*(T2-T1) - для нахождения показателя политропы логарифмируем уравнение PV^n = const
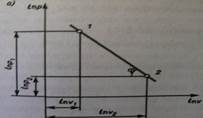 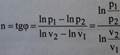

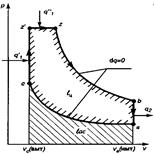
| 10.Термодинамические процессы идеальных газов, их изображение на PV, TS и HS- диаграммах.
В общем случае любой термодинамический процесс можно описать уравнением pυm = const
1. изохорный процесс υ = const (m = ∞)
2. изобарный процесс p = const (m = 0)
3. изотермический процесс T = const (m = 1)
4. адиабатный процесс S = const, Δq = 0 (m = k = cp/cυ)
5. политропный процесс pυn = const (m = n = (-∞;+∞))
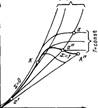
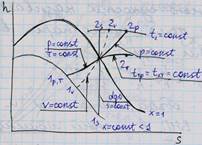
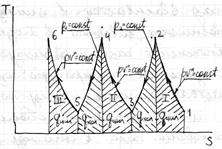
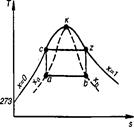
На рис показано взаимное расположение на р, v- и Т, 5-диаграммах политропных процессов с разными значения-ми показателя политропы. Все процессы начинаются в одной точке («в центре»). Изохора (л = ± ∞) делит поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой, так как сопровождаются расширением рабочего тела; для процессов, расположенных левее изохоры, характерна отрицательная работа. Процессы, расположенные правее и выше адиабаты, идут с подводом теплоты к рабочему телу; процессы, лежащие левее и ниже адиабаты, протекают с отводом теплоты. Для процессов, расположенных над изотермой (n=1), характерно увеличение внутренней энергии газа; процессы, расположенные под изотермой, сопровождаются уменьшением внутренней энергии.
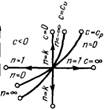 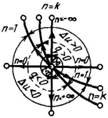 Изображение основных термодинамических процессов идеального газа в pV и Тs -координатах Изображение основных термодинамических процессов идеального газа в pV и Тs -координатах
| 10.(продолжение) 
 Выводы:
-при dV>0 происходит расширение газа с совершением работы dL>0,при dV<0 сжатие газа с затратой работы dL<0
-чем больше n тем круче линия процесса
-в проц, где линии расположены правее адиабаты q –подводится,а левее –отводится.
-в проц лини которых выше изотермы T –увеличивется,а если ниже,то уменьшется.
-в проц где линии между адиабатой и изотермой,теплоемкость отрицательна. Выводы:
-при dV>0 происходит расширение газа с совершением работы dL>0,при dV<0 сжатие газа с затратой работы dL<0
-чем больше n тем круче линия процесса
-в проц, где линии расположены правее адиабаты q –подводится,а левее –отводится.
-в проц лини которых выше изотермы T –увеличивется,а если ниже,то уменьшется.
-в проц где линии между адиабатой и изотермой,теплоемкость отрицательна.
| 11.

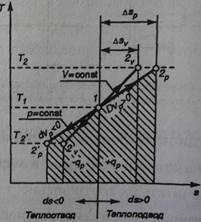
| 12. Изобарный и изохорный процессы.
| 13. Реальные газы.Водяной пар как пример реального газа.
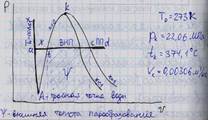
Наиболее простым и качественно верно отображающим поведение реального газа, является уравнение Ван-дер-Ваальса:
(P + a/v2)·(v – b) = R·T. (6.3)
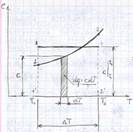
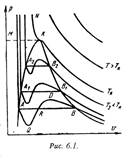 а, b – постоянные величины, первая учитывает силы взаимодействия, вторая учитывает размер молекул. a/v2 – характеризует добавочное давление, под которым находится реальный газ вследствие сил сцепления между молекулами и называется внутренним давлением. Для жидких тел это давление имеет большие значения (например, для воды при 200С составляет 1050 Мпа), а для газов из-за малых сил сцепления молекул оно очень мало. Поэтому внешнее давление, под которым находится жидкость, оказывает ничтожное влияние на её объем, и жидкость считают несжимаемой. В газах в виду малости значения a/2 внешнее давление легко изменяет их объем. Уравнение Ван-дер-Ваальса качественно верно отображает поведение жидких и газообразных веществ, для двухфазных состояний оно неприменимо. На PV – диаграмме (рис.6.1) показаны изотермы построенные по уравнению Ван-дер-Ваальса. Из кривых видно, что при сравнительно низких температурах имеются волнообразные участки. Чем выше температура, тем короче эти части кривых. Эти волнообразные кривые указывают на непрерывный переход от жидкого состояния в парообразное при данной температуре. а, b – постоянные величины, первая учитывает силы взаимодействия, вторая учитывает размер молекул. a/v2 – характеризует добавочное давление, под которым находится реальный газ вследствие сил сцепления между молекулами и называется внутренним давлением. Для жидких тел это давление имеет большие значения (например, для воды при 200С составляет 1050 Мпа), а для газов из-за малых сил сцепления молекул оно очень мало. Поэтому внешнее давление, под которым находится жидкость, оказывает ничтожное влияние на её объем, и жидкость считают несжимаемой. В газах в виду малости значения a/2 внешнее давление легко изменяет их объем. Уравнение Ван-дер-Ваальса качественно верно отображает поведение жидких и газообразных веществ, для двухфазных состояний оно неприменимо. На PV – диаграмме (рис.6.1) показаны изотермы построенные по уравнению Ван-дер-Ваальса. Из кривых видно, что при сравнительно низких температурах имеются волнообразные участки. Чем выше температура, тем короче эти части кривых. Эти волнообразные кривые указывают на непрерывный переход от жидкого состояния в парообразное при данной температуре.
| 13.(продолжение 1)
Точка А соответствует состоянии жидкости, точка В относится парообразному состоянии вещества.В действительности переход из жидкого состояния в парообразное всегда происходит через двухфазное состояние вещества. При этом при данной температуре процесс перехода происходит также и при постоянном давлении. Этот действительный переход из жидкого состояния в парообразное изображается прямой линией АВ. Практически для особо чистых веществ возможно осуществление участков волнообразной кривой AQ и DB. В первом случае имеют место неустойчивые состояния перегретой жидкости, а во втором – переохлажденного пара.
При определенной температуре изотерма уравнения Ван-дер-Ваальса не будет иметь волнообразного участка (точка К). Эту температуру называют критической. Если соединить точки А1, А2, А3 … и В1, В2, В3... получим кривую похожую на параболу. Кривая АК называется нижней пограничной кривой и соответствует в состоянии кипения жидкости. Кривая КВ называется верхней пограничной кривой и соответствует состояния сухого насыщенного пара. Таким образом, для реального вещества PV – диаграмму можно разбить на 3 области: 1 - область жидкого состояния, расположена левее нижней пограничной кривой; 2 - область двухфазных состояний (влажный пар), расположена между нижней и верхней пограничной кривой); 3 – область перегретого пара, расположена правее верхней пограничной кривой и выше критической точки. Условно область жидкости ограничивают сверху линией КМ – критическая изобара. Критическую температуру Д.И.Менделеев называл абсолютной температурой кипения, при которой поверхностное натяжение в жидкости становится равным нулю, т.е. исчезает различие между жидкостью и парообразным состоянием вещества (насыщенным паром). Связь между критическими параметрами и постоянными уравнения Ван-дер-Ваальса:
Тк = 8·а/(27·R·b); Pк = a/(27·b2); (6.4) а = (27· R2 ·Т2к)/(64 ·Pк); b = (27· R ·Тк)/(8 ·Pк). (6.5)
| 13.(продолжение 2)
Уравнение Ван-дер-Ваальса при больших плотностях газа дает значительные ошибки. Кроме этого экспериментальным путем доказана, что коэффициенты а, b зависят от температуры и давления, причем эта зависимость очень сложная. М.П.Вукалович и И.И.Новиков в 1939 г. предложили новое универсальное уравнение состояния реальных газов с учетом ассоциации и диссоциации их молекул, который имеет следующий вид: (P + a/2)·( – b) = R·T (1 – С/( ·Т(3+2m)/2), (6.6) где a, b – постоянные уравнения Ван-дер-Ваальса; С, m – постоянные, определяемые на основании опытных данных.
-Тройная точка воды
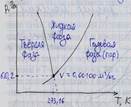 
| 13.(продолжение 3)
а-жидкость при нуле градусов
ав- подогрев жидкости при постоянном давлении р до стояния кипения(испарение,парообразованиес поверхности)
в-начало кипения
вс-изобарно-изотермический проц.парообраз. с потреблением теплоты при кипении
с-испарение последней капли жидкости(весь пар сухой насыщеннй
сd-изобарный перегрев пара.степень перегрева(разность температат перегретого пара и сух.насыщенного при постоянном давлении.
Изображение основных термодинамических процессов водяного пара на PV, TS и HS- диаграммах.
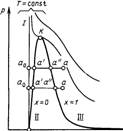
 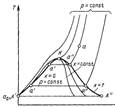 А' А" V рV-диаграмма водяного пара Т s-диаграмма водяного пара
hs -диаграмма водяного пара
s(ось абсцисс на последнем графике) А' А" V рV-диаграмма водяного пара Т s-диаграмма водяного пара
hs -диаграмма водяного пара
s(ось абсцисс на последнем графике)
| 14.
Теплота парообразования-кол-во r(дж/кг) теплоты необходимой для полного превращения 1 кг кипящей жидкости в сухой насыщенный пар.с увеличением давлении –уменьшается.
Степен сухости- массовая доля сухого пара во влажном.
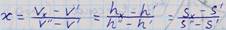 Vx hx Sx -объем энтальпия и энтрапия ВНП
V` h` S` - объем энтальпия и энтропия кипящ. Жидкости в точке b(начале кипения)
V`` h`` S`` -параметры сухого насыщенного пара в сточке с.
Энтальпия перегретого пара растет с увеличением давления
Степень перегрева – разность ПП и СНП. При постоянном давлении.
Vx hx Sx -объем энтальпия и энтрапия ВНП
V` h` S` - объем энтальпия и энтропия кипящ. Жидкости в точке b(начале кипения)
V`` h`` S`` -параметры сухого насыщенного пара в сточке с.
Энтальпия перегретого пара растет с увеличением давления
Степень перегрева – разность ПП и СНП. При постоянном давлении.
| 14.(продолжение 1)
Степенью сухости пара (х); х=mсух пара/mвл пара=mс.п./mс.п.+mводы. Сухость пара – это массов-я доля сух-о пара во влажном. 0£х£1; Если х=0 – кипящая вода, х=1 – сухой нас-й пар, 0<х<1 – влажный нас-й пар. Перегретый пар – если сухой нас-й пар нагрев-ть дальше, то увел-ся t. – это пар, t кот-го выше, чем t насыщ-я, при данном Р. Хаар-ся 2мя пара-ми: Обычно Р и t, а разница (t-ts) – степень перегрева. Ур-е сост-я: Ур-е Менделеева - Клапейрона справ-во д/реального Г. Перегр-й вод пар при больших степенях перегрева и умеренных Р не плохо соотв-т модели идеал-го Г, однако чем ближе пар насыщ-я, тем хуже его св-ва описыв-ся Ур-ем М-К, т.к. проявляются: 1) силы межмолек-го взаимод-я; 2) нельзя не учит-ть V мол-л вод-го пара. Ур-е сост-я предложил Ван-дер-Ваальс: (p+а/v2)(v-b)=RT; Если сжимать идеал Г изотермически (RT=const), то pv=const; при увел-и р (р--¥)== v—0. Если сжимать изотерм-ки реал-й Г, то р--¥, то (v-b)—0 или v—b; b можно рассм-ть собств-й V мол-л реального Г; а,b,R – const, зав-е от вида Г; a/v2 – учит-т взаимод-е м/д мол-ми; Ур-е Ван-дер-Ваальса качеств-но правильно опис-т измен-е пар-ров сост-я реального Г, а кол-во дает знач-е погреш-ти == на пр-ке в наст время не примен-ся.
--- Если температура пара выше температуры насыщенного пара того же давления, то такой пар называется перегретым. Разность между температурой перегретого пара и температурой насыщенного пара того же давления называется степенью перегрева. Так как удельный объем перегретого пара больше удельного объема насыщенного пара, то плотность перегретого пара меньше плотности насыщенного пара. Поэтому перегретый пар является ненасыщенным паром. В момент испарения последней капли жидкости в ограниченном пространстве без изменения температуры и давления образуется сухой насыщенный пар. Состояние такого пара определяется одним параметром - давлением.
| 14. (Продолжение 2)
Механическая смесь сухого и мельчайших капелек жидкости называется влажным паром. Массовая доля сухого пара во влажном паре называется степенью сухости – х.
х = mсп / mвп, (6.7)
mсп - масса сухого пара во влажном; mвп - масса влажного пара. Массовая доля жидкости во влажном паре нызвается степенью влажности – у.
у = 1 – . (6.8)
Для кипящей жидкости при температуре насыщения = 0, для сухого пара – = 1.

| 14. (продолжение 3) 
| 15 Сформулируйте и приведите запись первого закона термодинамики для движущегося газа, поясните входящие в уравнение величины. Представьте уравнение 1- го закона термодинамики для движущегося газа в "тепловой" и "механической" формах. Как определяется скорость звука и что называется числом Маха? При каких условиях параметры движущегося газа называются критическими?
Уравнение 1-го закона термодинамики для потока газа будет иметь вид:
q = h2 – h1 + (w22 – w21)/2 + g·(z2 –z1) + lтехн.
w1,w2 – скорости потока в начале и в конце канала;
z1, z2 – высота положения начала и конца канала.
Введем понятия энтальпии, который обозначим через величину:
h = u + Pх, (энтальпия) h2 = u2 + P2·n 2; h1 = u1 + P1·n 1.
lтехн. – техническая (полезная) работа
Число Маха является мерой влияния сжимаемости среды в потоке данной скорости на его поведение
 где v — скорость потока, а a — местная скорость звука,
Поскольку скорость звука
где v — скорость потока, а a — местная скорость звука,
Поскольку скорость звука 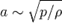 , то относительное изменение плотности в газовом потоке пропорционально квадрату числа Маха: , то относительное изменение плотности в газовом потоке пропорционально квадрату числа Маха:
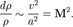 ( (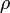 — локальная плотность газа, — локальная плотность газа, 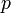 — локальное давление.)
Параметры газового потока, когда скорость газа равна местной скорости звука, называются критическими — локальное давление.)
Параметры газового потока, когда скорость газа равна местной скорости звука, называются критическими
| 16 Дайте определения сопла и диффузора. Как изменяются вдоль сопла и диффузора удельный объем, температура, скорость звука? Покажите, какую форму канала должны иметь сопло и диффузор при различных режимах течения. Каким должно быть сопло для получения сверхзвуковой скорости истечения газа?
Если перемещение газа по каналу происходит его расширение с уменьшением давления и увеличением скорости, то такой канал называется соплом.
Если в канале происходит сжатие рабочего тела с увеличением его давления и уменьшением скорости, то такой канал называют диффузором. 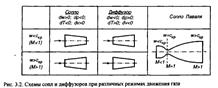


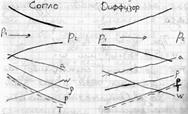
| 17 Рассмотрите в vp координатах процесс расширения газа при истечении через суживающееся сопло для случаев, когда отношение давлений р0/р1 больше, равно и меньше критического. Покажите графически характер изменения скорости и секундного расхода газа в зависимости от отношения давлений β = р0 /p1* при истечении газа через суживающееся сопло.

| 17(Продолжение)
 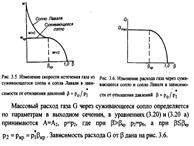
| 18 Изобразите графически характер изменения параметров газового потока (давления, температуры, удельного объема, скорости течения, скорости звука) подлине сопла Лаваля. Покажите графически характер изменения скорости и секундного расхода газа в зависимости от отношения давлений β= р0/р1*
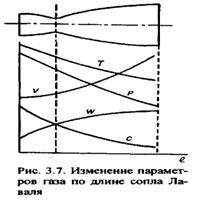
| 18(Продолжение) 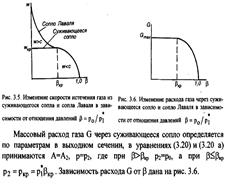
| 19 Какие круговые процессы (циклы) называются прямыми и какие — обратными? Что называется термическим КПД и средним давлением цикла? Что они характеризуют? Рассмотрите прямой обратимый цикл Карно. Изобразите его в vp- и sT- координатах. Приведите уравнение КПД цикла. Какие выводы можно сделать на основании анализа уравнения КПД цикла Карно? Рассмотрите обратный обратимый цикл Карно. Идеальным циклом каких установок он является? Приведите выражения для холодильного и отопительного коэффициентов. Как эти коэффициенты зависят от температуры горячего и холодного источников.
Циклом называется замкнутый круговой процесс, при осуществлении которого рабочее тело, пройдя ряд последовательных состояний, возвращается в исходное. Если каждое из пройденных состояний равновесно, то цикл обратим, т.е. он может протекать как в одном. так и в противоположном направлениях.
Прямой цикл - цикл, в котором теплота превращается в работу (линия расширения проходит выше линии сжатия, то есть цикл протекает по направлению часовой стрелки).
Обратный цикл – цикл, в котором теплота от «холодного» источника передается «горячему» источнику при затрате работы (линия сжатия проходит выше линии расширения).
Термодинамическим КПД называется отношение работы цикла к подведенной теплоте 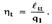 Он показывает, какая часть подведенной теплоты превращена в работу цикла, т.е. является количественной мерой качества теплоис- пользования в цикле.
Он показывает, какая часть подведенной теплоты превращена в работу цикла, т.е. является количественной мерой качества теплоис- пользования в цикле. 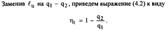 Другим важным показателем, характеризующим цикл в целом, является среднее давление цикла
Другим важным показателем, характеризующим цикл в целом, является среднее давление цикла
 
| 19.1 Прямой обратимый цикл Карно является самым экономичным циклом. Цикл состоит из 2ух изотермических и 2ух адиабатных обратимых процессов при наличии 2ух источников теплоты-горячего и холодного
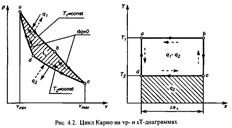
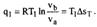
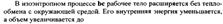
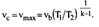 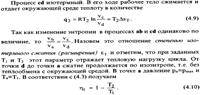 КПД цикла Карно зависит от максимальной Т2 и минимальной Т1 температур. КПД нельзя получить равным 1. Термический КПД цикла Карно не зависит от природы рабочего тела
КПД цикла Карно зависит от максимальной Т2 и минимальной Т1 температур. КПД нельзя получить равным 1. Термический КПД цикла Карно не зависит от природы рабочего тела
| 19.2Обратный обратимый цикл Карно состоит из следующих процессов:
12-адиабатное расширение,23-изотермическое расширение, 34- адиабатное сжатие, 41- изотермическое сжатие
В процессе 23 (Т2=const) к рабочему телу подводится теплота q2 от холодного источника, в процессе 41(T1=const) теплота q1 отводится в горячий источник
Обратные циклы характерны для холодильных машин и тепловых насосов
Для осуществления цикла затрачивается работа lц

 Увеличивается при уменьшении Т1 и увеличении Т2
Увеличивается при уменьшении Т1 и увеличении Т2
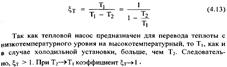 Оптимальный коэффициент теплового насоса, работающего по обратному циклу Карно, найдем по уравнению
Увеличивается при возрастании Т1 и уменьшении Т2 (>1) Оптимальный коэффициент теплового насоса, работающего по обратному циклу Карно, найдем по уравнению
Увеличивается при возрастании Т1 и уменьшении Т2 (>1)
| 20 Приведите формулировки второго закона термодинамики. Что понимается под вечным двигателем второго рода?
Формулировки 2ого закона термодинамики:
1)Томсон: невозможно превратить в работу энергию какого-либо тела, не производя никакого другого действия, кроме охлаждения этого тела.
2)Оствальд: вечный двигатель второго рода невозможен. Вечный двигатель второго рода - воображаемый тепловой двигатель, в котором возможно полное превращение подведенной теплоты в работу.
3)Теплота не может самопроизвольно переходить от более холодного к более теплому телу. 
| 21 Приведите схему и рассмотрите процессы поршневого компрессора с вредным пространством в vp- координатах. Приведите выражение для определения производительности компрессора. С помощью vp - диаграммы покажите влияние вредного объема и степени повышения давления в одной ступени на производительность компрессора. Покажите в vp - координатах цикл компрессора без вредного пространства. Дайте вывод уравнения для определения работы на привод компрессора.

| 21(продолжение 1) 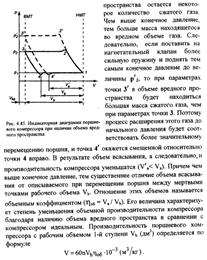
| 21(продолжение 2) 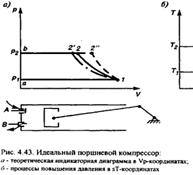
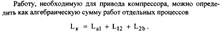
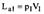 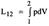 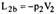
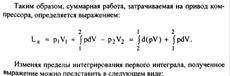
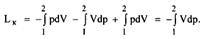
| 22 Покажите в sT- диаграмме различные варианты процесса сжатия (адиабатное, политропное, изотермическое) газа в поршневом компрессоре. Какое сжатие является экономически целесообразным? Как на практике обеспечивают уменьшение затрат работы? Рассмотрите многоступенчатое сжатие в vp - и sT - координатах. Какое распределение степеней повышения давления наиболее целесообразно? Что обеспечивает промежуточное охлаждение газа? Как с использованием sT- диаграммы определить количество теплоты, отводимой от газа в цилиндре компрессора и в промежуточных охладителях. Как определить мощность мотора для привода многоступенчатого компрессора?
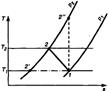 12-политропное сжатие
12’-изотермическое сжатие
12’’-адиабатное сжатие
Работа, необходимая для привода компрессора 12-политропное сжатие
12’-изотермическое сжатие
12’’-адиабатное сжатие
Работа, необходимая для привода компрессора
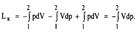 Для 1 кг
Для 1 кг 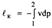 Эта работа имеет максимальное значение в адиабатном процессе, а минимальное – в изотермическом (n=1), поэтому последний является экономически наиболее целесообразно. На практике n=1,2..1,25
Эта работа имеет максимальное значение в адиабатном процессе, а минимальное – в изотермическом (n=1), поэтому последний является экономически наиболее целесообразно. На практике n=1,2..1,25
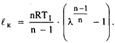 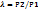 - степень повышения давления.
Для обеспечения экономии в затрате работы необходимо поступление газа с более низкой температурой - степень повышения давления.
Для обеспечения экономии в затрате работы необходимо поступление газа с более низкой температурой
| 22.1 а-1 - газ всасывается в цилиндр I
1-2 - повышение давления в I ступени
2-в - вытеснение газа из цилиндра в…
В холодильнике температура газа понижается, благодаря чему понижается его (удельный) объем.
в-3 - всасывание газа в цилиндр II
3-4 - сжимание газа во II ступени и т.д.
Условия: Т1=Т3=Т5; Т2=Т4=Т6; nI=nII=nIII=n
Тогда Р2/Р1=Р4/Р3=Р6/Р5=λ
Тогда λ3=Р6/Р1
Таким образом, для i-ступенчатого компрессора наиболее целесообрасной будет степень повышения давления 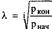
 количество теплоты, отводимой от газа в цилиндре компрессора и в промежуточных охладителях количество теплоты, отводимой от газа в цилиндре компрессора и в промежуточных охладителях
| 22.2
Теоретическая мощность N0,Вт, затрачиваемая на привод компрессора, может быть определена по равенству: N0=i*G*li, где G-массовая производительность компрессора, кг/с; i-число ступеней компрессора; li-теоретическая работа на сжатие 1кг газа в одной ступени (lI=lII=lIII), Дж/кг.
Для определения действительной (эффективной) мощности Ne, необходимой для привода компрессора, нужно знать потери работы на преодоление сопротивлений клапанов и трубопроводов и на трение в соприкасающихся частях компрессора, которые учитываются механическим КПД
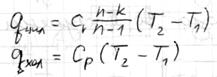 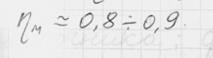 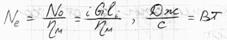
|  23. 1.Почему цикл Карно не применяется в качестве цикла поршневого двигателя? 23. 1.Почему цикл Карно не применяется в качестве цикла поршневого двигателя?
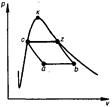 
| 23(продолжение 1) 2.Почему в цилиндре поршневого двигателя не осуществляется полное расширение газа с понижением давления до начального цикла?
Поршневые ДВС неполного объёмного расширения (степень сжатия = степени расширения) характеризуются высокими начальными параметрами рабочих газов (давление, температура), но не обеспечивают их полного срабатывания из-за низкой степени расширения, обусловленной несовершенством кривошипно-шатунного кинематического механизма (КШМ), используемого для преобразования потенциальной энергии в механическую энергию вращения вала. Степени сжатия и расширения равны, но после воспламенения сжатой топливовоздушной смеси давление продуктов сгорания повышается ещё в несколько (4-5) раз, при этом, не обеспечивается их расширение до атмосферного давления и они, имея высокое давление и температуру, выпускаются в атмосферу и при этом наносят вред окружающей среде.
4.Изобразите в vp- координатах цикл Тринклера со смешанным подводом теплоты
Цикл Тринклера- цикл со смешанным подводом  : частично при v=const и частично при p=const(расчётный цикл современных дизелей с впрыскиванием топлива под давлнием) : частично при v=const и частично при p=const(расчётный цикл современных дизелей с впрыскиванием топлива под давлнием)
| 23(продолжение 2) 5.Каковы характерные отношения объёмов и давлений.  -объём камеры сжатия; -объём камеры сжатия;  -полный объём; -полный объём;  -рабочий объём; -рабочий объём; 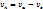 Ɛ=
Ɛ=  Ɛ-степень сжатия
ƛ= Ɛ-степень сжатия
ƛ= 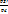 = = 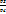 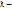 степень повышения степень повышения
 -степень предварительного расширения -степень предварительного расширения 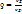 ß-степень последующего расширения ß=
ß-степень последующего расширения ß= 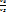 ; Ɛ= ; Ɛ=  *ß
6.Запишите уравнения *ß
6.Запишите уравнения 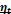 и и 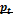 для циклов Отто с подводом теплоты при постоянном объёме и Дизеля с подводом теплоты при постоянном давлении.
Цикл Отто- цикл с подводом для циклов Отто с подводом теплоты при постоянном объёме и Дизеля с подводом теплоты при постоянном давлении.
Цикл Отто- цикл с подводом  при v=const(расчётный цикл ПДВС с искровым зажиганием) при v=const(расчётный цикл ПДВС с искровым зажиганием)
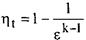 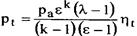  =1
Цикл Дизеля- цикл с подводом =1
Цикл Дизеля- цикл с подводом  при р=const(расчётный цикл первых дизелей с компрессорным распыливанием топлива) при р=const(расчётный цикл первых дизелей с компрессорным распыливанием топлива)
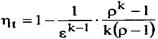 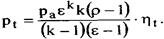  =1 =1
| 24.Проанализируйте влияние различных факторов(степени сжатия, показателя адиабаты, количества подведённой теплоты, доли теплоты, подводимой при постоянном объёме в ВМТ, нача |
|
Поиск по сайту:
|
 n – концентрация молекул (число молекул, содержащихся в единице объема), m – масса молекулы,
n – концентрация молекул (число молекул, содержащихся в единице объема), m – масса молекулы,  – среднеквадратическая скорость. Температура Т (К)– параметр, характеризующий среднюю кинетическую энергию теплового движения частиц
– среднеквадратическая скорость. Температура Т (К)– параметр, характеризующий среднюю кинетическую энергию теплового движения частиц 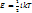 , где
, где  – число степеней свободы молекул газа (
– число степеней свободы молекул газа (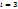 для 1-атомных газов,
для 1-атомных газов, 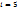 для 2-атомных газов,
для 2-атомных газов, 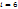 для многоатомных газов),
для многоатомных газов),  =1,38∙10-23 Дж/К – постоянная Больцмана. Объем V (м3), Удельный объем – объем единицы массы вещества. V=V/M, м3/кг. Плотность – масса единицы объема вещества. ρ=M/V, кг/м3.
Абсолютное давление в атмосфере рабс=рбар измеряется барометром Вt, мм. рт. ст. В закрытом сосуде при давлении больше атмосферного рабс= рбар+ризб, избыточное давление измеряется манометром. В закрытом сосуде при давлении меньше атмосферного рабс=рбар-рразр, разрежение измеряется вакууметром.
=1,38∙10-23 Дж/К – постоянная Больцмана. Объем V (м3), Удельный объем – объем единицы массы вещества. V=V/M, м3/кг. Плотность – масса единицы объема вещества. ρ=M/V, кг/м3.
Абсолютное давление в атмосфере рабс=рбар измеряется барометром Вt, мм. рт. ст. В закрытом сосуде при давлении больше атмосферного рабс= рбар+ризб, избыточное давление измеряется манометром. В закрытом сосуде при давлении меньше атмосферного рабс=рбар-рразр, разрежение измеряется вакууметром.
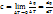 Средняя теплоемкость – количество теплоты, необходимой для нагревания единицы количества газа на 1 К в среднем за рассматриваемый интервал изменения температуры от Т1 до Т2.
Средняя теплоемкость – количество теплоты, необходимой для нагревания единицы количества газа на 1 К в среднем за рассматриваемый интервал изменения температуры от Т1 до Т2. 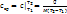 ,
, 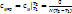
 При известной Зависимости с
При известной Зависимости с  =f(T) в процессе 1–2 q12=c
=f(T) в процессе 1–2 q12=c 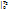 T2 - c
T2 - c 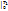 T1, с другой стороны q12=
T1, с другой стороны q12= 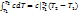 , поэтому с
, поэтому с 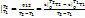 . По зависимости истинной теплоемкости с=f(T) вместо интегрирования приближенно определяют
. По зависимости истинной теплоемкости с=f(T) вместо интегрирования приближенно определяют 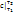 при средней температуре Тср=
при средней температуре Тср= 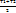 , с
, с 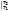 ≈c(Тср)
≈c(Тср)
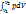 .
Невозможно в каком либо механизме периодически получать работу, не подводя энергию извне. Таким образом, вечный двигатель первого рода невозможен. Вечный двигатель первого рода – гипотетический двигатель, способный производить работу, не получая энергию извне. Теплота, подведенная к рабочему телу, расходуется на увеличение его энтальпии и располагаемой работы. dq=dh+dl0, q=cP(T2-T1)-
.
Невозможно в каком либо механизме периодически получать работу, не подводя энергию извне. Таким образом, вечный двигатель первого рода невозможен. Вечный двигатель первого рода – гипотетический двигатель, способный производить работу, не получая энергию извне. Теплота, подведенная к рабочему телу, расходуется на увеличение его энтальпии и располагаемой работы. dq=dh+dl0, q=cP(T2-T1)- 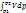 .
Поясните понятие «коэффициент разветвления теплоты»
.
Поясните понятие «коэффициент разветвления теплоты»



 Реальные процессы необратимы так как невозможно вернуть затраченную энергию.
в природе нет строго консервативных систем, в любой реальной системе действуют силы трения.
Реальные процессы необратимы так как невозможно вернуть затраченную энергию.
в природе нет строго консервативных систем, в любой реальной системе действуют силы трения.
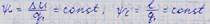 ψu - коэффициент разветвления теплоты
ψu + ψ l = 1 ψu=(n-1)/(n-k) q=Cv*(n-k)*(T2-T1)/(n-1)
ʌU=Cv*(T2-T1) - для нахождения показателя политропы логарифмируем уравнение PV^n = const
ψu - коэффициент разветвления теплоты
ψu + ψ l = 1 ψu=(n-1)/(n-k) q=Cv*(n-k)*(T2-T1)/(n-1)
ʌU=Cv*(T2-T1) - для нахождения показателя политропы логарифмируем уравнение PV^n = const

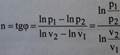


 Изображение основных термодинамических процессов идеального газа в pV и Тs -координатах
Изображение основных термодинамических процессов идеального газа в pV и Тs -координатах

 Выводы:
-при dV>0 происходит расширение газа с совершением работы dL>0,при dV<0 сжатие газа с затратой работы dL<0
-чем больше n тем круче линия процесса
-в проц, где линии расположены правее адиабаты q –подводится,а левее –отводится.
-в проц лини которых выше изотермы T –увеличивется,а если ниже,то уменьшется.
-в проц где линии между адиабатой и изотермой,теплоемкость отрицательна.
Выводы:
-при dV>0 происходит расширение газа с совершением работы dL>0,при dV<0 сжатие газа с затратой работы dL<0
-чем больше n тем круче линия процесса
-в проц, где линии расположены правее адиабаты q –подводится,а левее –отводится.
-в проц лини которых выше изотермы T –увеличивется,а если ниже,то уменьшется.
-в проц где линии между адиабатой и изотермой,теплоемкость отрицательна.


 а, b – постоянные величины, первая учитывает силы взаимодействия, вторая учитывает размер молекул. a/v2 – характеризует добавочное давление, под которым находится реальный газ вследствие сил сцепления между молекулами и называется внутренним давлением. Для жидких тел это давление имеет большие значения (например, для воды при 200С составляет 1050 Мпа), а для газов из-за малых сил сцепления молекул оно очень мало. Поэтому внешнее давление, под которым находится жидкость, оказывает ничтожное влияние на её объем, и жидкость считают несжимаемой. В газах в виду малости значения a/2 внешнее давление легко изменяет их объем. Уравнение Ван-дер-Ваальса качественно верно отображает поведение жидких и газообразных веществ, для двухфазных состояний оно неприменимо. На PV – диаграмме (рис.6.1) показаны изотермы построенные по уравнению Ван-дер-Ваальса. Из кривых видно, что при сравнительно низких температурах имеются волнообразные участки. Чем выше температура, тем короче эти части кривых. Эти волнообразные кривые указывают на непрерывный переход от жидкого состояния в парообразное при данной температуре.
а, b – постоянные величины, первая учитывает силы взаимодействия, вторая учитывает размер молекул. a/v2 – характеризует добавочное давление, под которым находится реальный газ вследствие сил сцепления между молекулами и называется внутренним давлением. Для жидких тел это давление имеет большие значения (например, для воды при 200С составляет 1050 Мпа), а для газов из-за малых сил сцепления молекул оно очень мало. Поэтому внешнее давление, под которым находится жидкость, оказывает ничтожное влияние на её объем, и жидкость считают несжимаемой. В газах в виду малости значения a/2 внешнее давление легко изменяет их объем. Уравнение Ван-дер-Ваальса качественно верно отображает поведение жидких и газообразных веществ, для двухфазных состояний оно неприменимо. На PV – диаграмме (рис.6.1) показаны изотермы построенные по уравнению Ван-дер-Ваальса. Из кривых видно, что при сравнительно низких температурах имеются волнообразные участки. Чем выше температура, тем короче эти части кривых. Эти волнообразные кривые указывают на непрерывный переход от жидкого состояния в парообразное при данной температуре.




 А' А" V рV-диаграмма водяного пара Т s-диаграмма водяного пара
hs -диаграмма водяного пара
s(ось абсцисс на последнем графике)
А' А" V рV-диаграмма водяного пара Т s-диаграмма водяного пара
hs -диаграмма водяного пара
s(ось абсцисс на последнем графике)
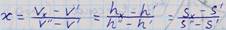 Vx hx Sx -объем энтальпия и энтрапия ВНП
V` h` S` - объем энтальпия и энтропия кипящ. Жидкости в точке b(начале кипения)
V`` h`` S`` -параметры сухого насыщенного пара в сточке с.
Энтальпия перегретого пара растет с увеличением давления
Степень перегрева – разность ПП и СНП. При постоянном давлении.
Vx hx Sx -объем энтальпия и энтрапия ВНП
V` h` S` - объем энтальпия и энтропия кипящ. Жидкости в точке b(начале кипения)
V`` h`` S`` -параметры сухого насыщенного пара в сточке с.
Энтальпия перегретого пара растет с увеличением давления
Степень перегрева – разность ПП и СНП. При постоянном давлении.



 где v — скорость потока, а a — местная скорость звука,
Поскольку скорость звука
где v — скорость потока, а a — местная скорость звука,
Поскольку скорость звука 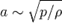 , то относительное изменение плотности в газовом потоке пропорционально квадрату числа Маха:
, то относительное изменение плотности в газовом потоке пропорционально квадрату числа Маха:
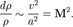 (
(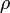 — локальная плотность газа,
— локальная плотность газа, 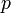 — локальное давление.)
Параметры газового потока, когда скорость газа равна местной скорости звука, называются критическими
— локальное давление.)
Параметры газового потока, когда скорость газа равна местной скорости звука, называются критическими









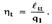 Он показывает, какая часть подведенной теплоты превращена в работу цикла, т.е. является количественной мерой качества теплоис- пользования в цикле.
Он показывает, какая часть подведенной теплоты превращена в работу цикла, т.е. является количественной мерой качества теплоис- пользования в цикле. 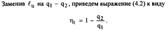 Другим важным показателем, характеризующим цикл в целом, является среднее давление цикла
Другим важным показателем, характеризующим цикл в целом, является среднее давление цикла



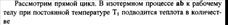
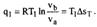
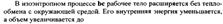
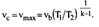
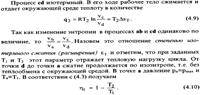 КПД цикла Карно зависит от максимальной Т2 и минимальной Т1 температур. КПД нельзя получить равным 1. Термический КПД цикла Карно не зависит от природы рабочего тела
КПД цикла Карно зависит от максимальной Т2 и минимальной Т1 температур. КПД нельзя получить равным 1. Термический КПД цикла Карно не зависит от природы рабочего тела

 Увеличивается при уменьшении Т1 и увеличении Т2
Увеличивается при уменьшении Т1 и увеличении Т2
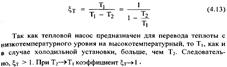 Оптимальный коэффициент теплового насоса, работающего по обратному циклу Карно, найдем по уравнению
Увеличивается при возрастании Т1 и уменьшении Т2 (>1)
Оптимальный коэффициент теплового насоса, работающего по обратному циклу Карно, найдем по уравнению
Увеличивается при возрастании Т1 и уменьшении Т2 (>1)




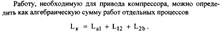
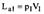
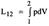
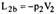
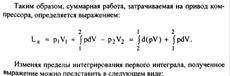
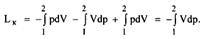
 12-политропное сжатие
12’-изотермическое сжатие
12’’-адиабатное сжатие
Работа, необходимая для привода компрессора
12-политропное сжатие
12’-изотермическое сжатие
12’’-адиабатное сжатие
Работа, необходимая для привода компрессора
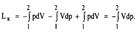 Для 1 кг
Для 1 кг 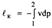 Эта работа имеет максимальное значение в адиабатном процессе, а минимальное – в изотермическом (n=1), поэтому последний является экономически наиболее целесообразно. На практике n=1,2..1,25
Эта работа имеет максимальное значение в адиабатном процессе, а минимальное – в изотермическом (n=1), поэтому последний является экономически наиболее целесообразно. На практике n=1,2..1,25
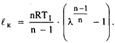
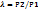 - степень повышения давления.
Для обеспечения экономии в затрате работы необходимо поступление газа с более низкой температурой
- степень повышения давления.
Для обеспечения экономии в затрате работы необходимо поступление газа с более низкой температурой
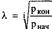
 количество теплоты, отводимой от газа в цилиндре компрессора и в промежуточных охладителях
количество теплоты, отводимой от газа в цилиндре компрессора и в промежуточных охладителях
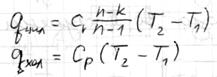
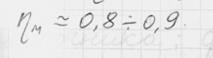
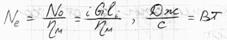
 23. 1.Почему цикл Карно не применяется в качестве цикла поршневого двигателя?
23. 1.Почему цикл Карно не применяется в качестве цикла поршневого двигателя?


 : частично при v=const и частично при p=const(расчётный цикл современных дизелей с впрыскиванием топлива под давлнием)
: частично при v=const и частично при p=const(расчётный цикл современных дизелей с впрыскиванием топлива под давлнием)

 -объём камеры сжатия;
-объём камеры сжатия;  -полный объём;
-полный объём;  -рабочий объём;
-рабочий объём; 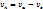 Ɛ=
Ɛ=  Ɛ-степень сжатия
ƛ=
Ɛ-степень сжатия
ƛ= 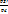 =
= 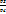
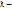 степень повышения
степень повышения
 -степень предварительного расширения
-степень предварительного расширения 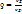 ß-степень последующего расширения ß=
ß-степень последующего расширения ß= 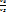 ; Ɛ=
; Ɛ=  *ß
6.Запишите уравнения
*ß
6.Запишите уравнения 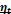 и
и 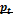 для циклов Отто с подводом теплоты при постоянном объёме и Дизеля с подводом теплоты при постоянном давлении.
Цикл Отто- цикл с подводом
для циклов Отто с подводом теплоты при постоянном объёме и Дизеля с подводом теплоты при постоянном давлении.
Цикл Отто- цикл с подводом  при v=const(расчётный цикл ПДВС с искровым зажиганием)
при v=const(расчётный цикл ПДВС с искровым зажиганием)
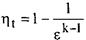
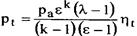
 =1
Цикл Дизеля- цикл с подводом
=1
Цикл Дизеля- цикл с подводом  при р=const(расчётный цикл первых дизелей с компрессорным распыливанием топлива)
при р=const(расчётный цикл первых дизелей с компрессорным распыливанием топлива)
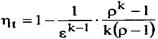
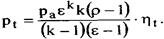
 =1
=1