Термодинамические системы
В термодинамике изучаются физические системы, состоящие из большого числа частиц и находящиеся в состоянии термодинамического равновесия или близком к нему. Такие системы называются термодинамическими системами.
Термодинамическое равновесие
Утверждается, что любая замкнутая термодинамическая система, для которой внешние условия остаются неизменными, с течением времени переходит в равновесное состояние, в котором прекращаются все макроскопические процессы.
Термодинамические параметры
Термодинамика не рассматривает особенности строения тел на молекулярном уровне. Равновесные состояния термодинамических систем могут быть описаны с помощью небольшого числа макроскопических параметров, таких как температура, давление, плотность, концентрации компонентов и т. д., которые могут быть измерены макроскопическими приборами. Описанное таким образом состояние называется макроскопическим состоянием, и законы термодинамики позволяют установить связь между макроскопическими параметрами.
Термодинамические процессы
При изменении внешних параметров или при передаче энергии в систему в ней могут возникать сложные процессы на макроскопическом и молекулярном уровне, в результате которых система переходит в другое состояние.
Нулевое начало термодинамики
названо так потому, что оно было сформулировано уже после того, как первое и второе начало вошли в число устоявшихся научных понятий. Оно утверждает, что изолированная термодинамическая система с течением времени самопроизвольно переходит в состояние термодинамического равновесия и остаётся в нём сколь угодно долго, если внешние условия сохраняются неизменными.
Первое начало термодинамики
Выражает универсальный закон сохранения энергии применительно к задачам термодинамики и исключает возможность создания вечного двигателя первого рода, то есть устройства, способного совершать работу без соответствующих затрат энергии.
Внутреннюю энергию U термодинамической системы можно изменить двумя способами, совершая над ней работу или посредством теплообмена с окружающей средой. Первое начало термодинамики утверждает, что теплота, полученная системой, идёт на увеличение внутренней энергии системы и на совершение этой системой работы, что можно записать как δQ = δA + dU. Здесь dU — полный дифференциал внутренней энергии системы, δQ — элементарное количество теплоты, переданное системе, а δA — бесконечно малая или элементарная работа, совершённая системой.
Второе начало термодинамики
Второе начало термодинамики задаёт ограничения на направление процессов, которые могут происходить в изолированной системе, и исключает возможность создания вечного двигателя второго рода.
Постулат Кельвина: «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счёт охлаждения теплового резервуара». Такой круговой процесс называется процессом Томсона-Планка, и постулируется, что такой процесс невозможен.
Постулат Клаузиуса: «Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому»
функция термодинамического состояния S=S(T,x,N), называется энтропией
2) Параметры и состояние системы.
Все макроскопические признаки, характеризующие систему и ее
отношение к окружающей среде, называются макроскопическими
параметрами или параметрами системы. Термодинамические параметры
– физические величины, характеризующие состояние термодинамической
системы (температура, объем, плотность, давление, масса, намагниченность,
электрическая поляризация, теплоемкость при постоянном объеме и другие),
т.е. любые признаки, имеющие количественную меру и относящиеся к
системе в целом или к ее макроскопическим частям (кроме характеристик
потоков энергии и массы, в размерность которых входит время). Свойства,
заимствованные термодинамикой у физики, химии, техники
рассматриваются в зависимости от типичной термодинамической
характеристики – температуры.
Величины, количественно выражающие термодинамические
параметры (свойства), называют также термодинамическими переменными.
Поскольку все они взаимосвязаны, их разделяют на независимые переменные
и функции, что эквивалентно делению математических величин на аргументы
и функции. Параметры, поддающиеся прямому измерению, считаются
основными (температура, давление, плотность, объем, концентрация).
Внутренняя энергия, энтропия, энтальпия и другие аналогичные параметры
считаются функциями основных параметров. Так как параметры
взаимосвязаны, то для характеристики состояния системы достаточно
задать только определенное число переменных. Эти переменные называют
независимыми, остальные рассматриваются как функции независимых
переменных. Таким образом, одна и та же характеристика в зависимости
от контекста может называться термодинамической величиной,
переменной, параметром, функцией или просто свойством.
Параметры разделяют на внешние и внутренние.
Внешние параметры – это величины, определяемые положением не входящих в систему тел - (объем, магнитная индукция, напряженность электрического поля)
Внешние параметры являются функциями координат внешних тел.
Внутренние параметры – это величины, определяемые совокупным
движением и распределением в пространстве входящих в систему частиц
(температура, давление, внутренняя энергия, плотность, поляризованность,
намагниченность)
Равновесные и неравновесные состояния:
Термодинамически равновесное состояние тела или системы это такое состояние теплового и механического равновесия элементов тела или системы, которое без внешнего воздействия может сохраняться сколь угодно долго.
Равновесная система это система тел, находящихся в термодинамическом равновесии, в противном случае она будет называться неравновесной системой. Так, без учета гравитационных сил, равновесное состояние тела или системы есть такое их состояние, при котором по всему их объему давления и температуры имеют одинаковые значения. Равенство только давления во всех точках обусловливает механическое равновесие, равенство температур - термическое равновесие.
3) Тепловой процесс и его свойства
Тепловой процесс (термодинамический процесс) — изменение макроскопического состояния термодинамической системы.
Система, в которой идёт тепловой процесс, называется рабочим телом.
Тепловые процессы можно разделить на равновесные и неравновесные.
Прямой и обратимый процессы:
Обратимый – процесс, при котором система проходит все те же состояния что и в прямом направлении, но в обратном порядке, при этом остаточных изменений в окружающей среде не наблюдается.
Круговые процессы - при которых система из начального состояния проходит ряд последовательных состояний и в него же возвращается.
4) Внутренняя энергия термодинамической системы.
Внутренняя энергия термодинамической системы (обозначается как E или U) — это сумма энергий теплового движения молекул и межмолекулярных взаимодействий.
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы.
5) Теплота и работа термодинамического процесса. Физическая сущность, выражение теплоты и работы через параметры состояния системы. Графическое определение теплоты и работы по диаграммам в координатах P-V и T-S.
Энергия, которую получает или теряет тело в процессе теплообмена с окружающей средой, называется количеством теплоты или просто теплотой.
Термодинамическая работа — способ передачи энергии, связанный с изменением внешних параметров системы. Определяется, как:
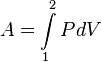
Теплота и работа определяются для разных видов процессов по первому закону термодинамики
Q = Δ u + l
Для изохорного:
Q=Cv Δ T
Cv - изохорная теплоемкость
L=0
Δ u=Cv Δ Т
Для изобарного:
Q=Cp Δ Т = Δ i
i - Энтальпия
L=p Δ V
Δ u=qV
Для изотермического:
Δ u=Cv Δ Т
Q=L
L=RTln(p1/p2)
Для адиабатного
Q=0
L=- Δ u
Δ u=Cv Δ Т
6. Идеальный газ- газ, молекулы которого представляют собой материальную точку,а силы взаимодействия между молекулами отсутствуют.
Основные законы идеального газа
1)Бойль-Мариотта
Т=const p1v1=p2v2 pv=const
2)Гей-Люсака
P=const T1/v1=T2/v2 T/v=const
3)Шарль
V=const p1/T1=p2/T2 p/T=const
4)Клапейрон
P1v1/T1=p2v2/T2 pv/T=const
Pv/T=R
R-газовая постоянная
Ro-универсальная газовая постоянная =8,314 Дж/моль К
PV=RT – уравнение состояния идеального газа,уравнение Клапейрона
PV=(m/(мю)) Ro T – основное уравнение состояния идеального газа, уравнение Менделеева- Клапейрона.
7 вопрос
Теплоемкость тела — это физическая величина, определяемая отношением количества теплоты, поглощенной телом при нагревании, к изменению его температуры:
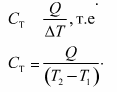
Физический смысл теплоемкости тела: теплоемкость тела равна количеству теплоты, поглощенному телом при нагревании или выделенному при его охлаждении на 1К.
Так как теплоемкости переменные величины, то различают среднюю и истинную теплоемкости.
Под средней теплоемкостью понимают отношение количества теплоты q, подведенной к единице количества вещества (газа), к изменению его температуры от t1 до t2 при условии, что разность температур t2– t1 является величиной конечной.
Средние массовая, объемная и мольная теплоемкости соответственно обозначаются через cm, cm ’ и  m.
m.
Из определения средней теплоемкости следует, что если температура газа повышается от t1 до t2 то его средняя теплоемкость [кДж/(кг*К)]
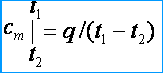
Под истинной теплоемкостью понимают теплоемкость газа, соответствующую бесконечно малому изменению температуры газа, соответствующую бесконечно малому изменению температуры dt, т. е.
c = dq/dt,
откуда dq = cdt.
Удельная теплоемкость — это способность разных веществ к поглощению теплоты при их нагревании.
Удельная теплоемкость вещества определяется отношением количества теплоты, полученной им при нагревании, к массе вещества и изменению его температуры, если 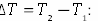 :
:
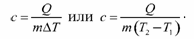
8 вопрос
соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера):
Cp = CV + R.
ИЛИ БОЛЕЕРАЗВЕРНУТО
Теплоёмкость идеального газа
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c.
c = Q / (mΔT).
Во многих случаях удобно использовать молярную теплоемкость C:
C = M · c,
где M – молярная масса вещества.
Определенная таким образом теплоемкость не является однозначной характеристикой вещества. Согласно первому закону термодинамики изменение внутренней энергии тела зависит не только от полученного количества теплоты, но и от работы, совершенной телом. В зависимости от условий, при которых осуществлялся процесс теплопередачи, тело могло совершать различную работу. Поэтому одинаковое количество теплоты, переданное телу, могло вызвать различные изменения его внутренней энергии и, следовательно, температуры.
Такая неоднозначность определения теплоемкости характерна только для газообразного вещества. При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе (p = const).
В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует
QV = CVΔT = ΔU.
Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры.
Для процесса при постоянном давлении первый закон термодинамики дает:
Qp = ΔU + p(V2 – V1) = CVΔT + pΔV,
где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует:
Отношение ΔV / ΔT может быть найдено из уравнения состояния идеального газа, записанного для 1 моля:
pV = RT,
где R – универсальная газовая постоянная. При p = const
Таким образом, соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера):
Cp = CV + R.
Газовая постоянная численно равна работе расширения 1 моля идеального газа под постоянным давлением при нагревании на 1 K.
R = pV/T = 1.01•105•22.4•10-3/273[Па•м3/моль]/K =8.31(44) Dж/(моль•K)
Универсальная газовая постоянная — универсальная, фундаментальная физическая константа R, равная произведению постоянной Больцмана k на постоянную Авогадро
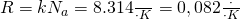
Физический смысл: Газовая постоянна я численно равна работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К
В системе СГС Газовая постоянная равна: 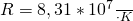
Удельная Газовая постоянная равна: 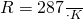
Показатель адиабаты (иногда называемый коэффициентом Пуассона) — отношение теплоёмкости при постоянном давлении (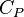 ) к теплоёмкости при постоянном объёме (
) к теплоёмкости при постоянном объёме (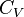 ). Иногда его ещё называют фактором изоэнтропийного расширения. Обозначается греческой буквой
). Иногда его ещё называют фактором изоэнтропийного расширения. Обозначается греческой буквой 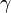 (гамма) или
(гамма) или 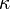 (каппа). Буквенный символ в основном используется в химических инженерных дисциплинах. В теплотехнике используется латинскаябуква
(каппа). Буквенный символ в основном используется в химических инженерных дисциплинах. В теплотехнике используется латинскаябуква 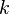 [1].
[1].
9 вопрос
Смесью газов называется совокупность нескольких разнородных газов, которые при рассматриваемых условиях не вступают друг с другом в химические реакции.
Смесь газов – гомогенная термодинамическая система (внутри которой нет поверхностей раздела, отделяющих друг от друга макроскопические части системы, различающиеся по своим свойствам и составу).
Парциальным давлением Pii-го газа в смеси называется давление, под которым находился бы этот газ, если бы из смеси были удалены все остальные газы, а V и T остались прежними.
Закон Дальтона — Давление смеси газов, не взаимодействующих друг с другом химически, равно сумме парциальных давлений этих газов.
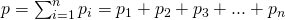
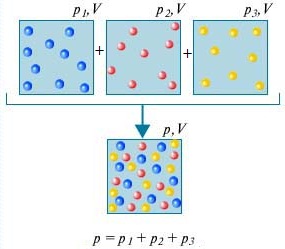
Для того чтоб понять, что представляет из себя закон Дальтона, рассмотрим для этого воздух в комнате. Он представляет собой смесь нескольких газов: азота (80%), кислорода (20%). Парциальное давление каждого из этих газов — это давление, которое имел бы газ, если бы он один занимал весь объем. К примеру, если бы все газы, кроме азота, удалили из комнаты, то давление того, что осталось, и было бы парциальным давлением азота. Закон Дальтона утверждает, что общее давление всех газов вместе взятых равно сумме парциальных давлений каждого газа в отдельнсти. (Строго говоря, закон применим только к идеальным газам, но с достаточно хорошим приближением он описывает также и реальные газы.)
10 вопрос
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение Δ U внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
|
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
|