Химические свойства этилена и его гомологов обусловлены особенностями их строения, а именно наличием в их молекулах двойной углерод-углерод ной связи.
Для непредельных соединений характерны реакции присоединения.
Одна из наиболее важных реакций присоединения для этилена — его взаимодействие с водой в присутствии катализатора (кислоты): 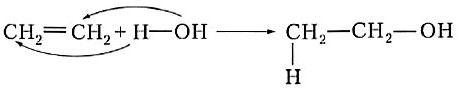
Обычно эту реакцию записывают так: 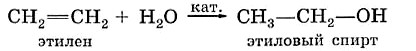
| Реакции присоединения воды по кратным связям молекул органических веществ называют реакциями гидратации. |
В результате реакции гидратации этилена получают технический этиловый спирт. Его используют только в качестве растворителя, горючего, сырья для химических производств — словом, везде, кроме пищевой промышленности.
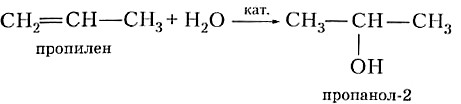
Присоединение воды к гомологу этилена — пропилену происходит по правилу, сформулированному выдающимся русским химиком, учеником Бутлерова В. В. Марковниковым.
| Правило Марковникова.Атом водорода присоединяется к тому из двух углеродных атомов двойной связи, у которого больше атомов водорода. |
Этиленовые углеводороды вступают в реакции присоединения галогеноводородов — реакции гидрогалогенирования: 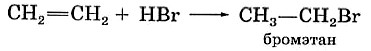
И в этих реакциях, как и в реакциях гидратации, соблюдается правило Марковникова: 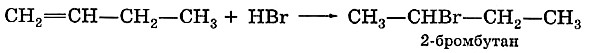
К реакциям присоединения относят также взаимодействие этиленовых углеводородов с галогенами — реакции галогенирования. В отличие от алканов, которые с галогенами вступают в реакцию замещения, алкены присоединяют молекулу галогена за счёт разрыва связи С=С: 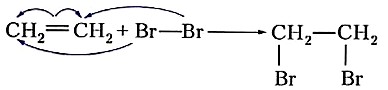
или 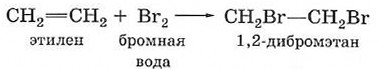
В качестве реагента для реакции бромирования этилена можно использовать раствор брома в воде — так называемую бромную воду. При этом жёлтая окраска бромной воды исчезает. Поскольку реакция сопровождается характерными видимыми изменениями, обесцвечивание бромной воды можно использовать как качественную реакцию на этилен и другие непредельные соединения.
Вещества, содержащие двойную углерод-углеродную связь, можно обнаружить с помощью ещё одной качественной реакции. При пропускании этилена через водный раствор перманганата калия происходит обесцвечивание этого раствора. В упрощённом виде, обозначив окислитель (КМnO4) как [О], уравнение реакции записывают так: 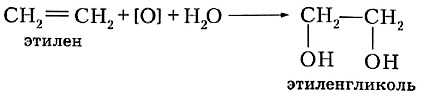
В качестве продукта этой реакции образуется органическое вещество этиленгликоль, с которым вы более подробно познакомитесь при изучении темы «Спирты».
Разновидностью реакции присоединения можно считать процесс полимеризации.
| Реакции, в которых множество молекул исходного вещества соединяются в огромную макромолекулу, называют реакциями полимеризации. |
Под действием высокой температуры и давления двойные углерод-углеродные связи в этилене разрываются, и за счёт освободившихся валентностей атомы углерода соединяются друг с другом:
… + СН2=СН2 + СН2=СН2 + СН2=СН2 + … →
→ …—СН2—СН2—СН2—СН2—СН2—СН2— …
Исходное вещество (в данном случае — этилен) называют мономером, а продукт реакции (в нашем примере — полиэтилен) — полимером. В результате реакции полимеризации образуются длинные цепи, состоящие из фрагментов этилена —СН2—СН2—. Многократно повторяющуюся в полимерной цепи группу атомов называют структурным звеном полимера. Число структурных звеньев в макромолекуле обозначают буквой п и называют с тепенью полимеризации. Относительная молекулярная масса таких гигантских молекул может составлять от нескольких тысяч до нескольких миллионов. Поскольку эта величина не является постоянной, говорят о средней молекулярной массе полимера. Уравнение реакции полимеризации этилена записывают так: 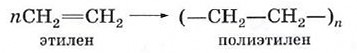
Этилен — важное химическое сырьё для производства полиэтилена, галогенпроизводных (используются, например, в качестве растворителей), этилового спирта, этиленгликоля и других продуктов химической промышленности.
Алкены — не единственные представители углеводородов, содержащих в молекуле двойную связь.
Конец формы
Для закрепления выполните задания из учебника:
Глава IV параграф 1. Задания после параграфа № 5, 9, 10,13, 14а,