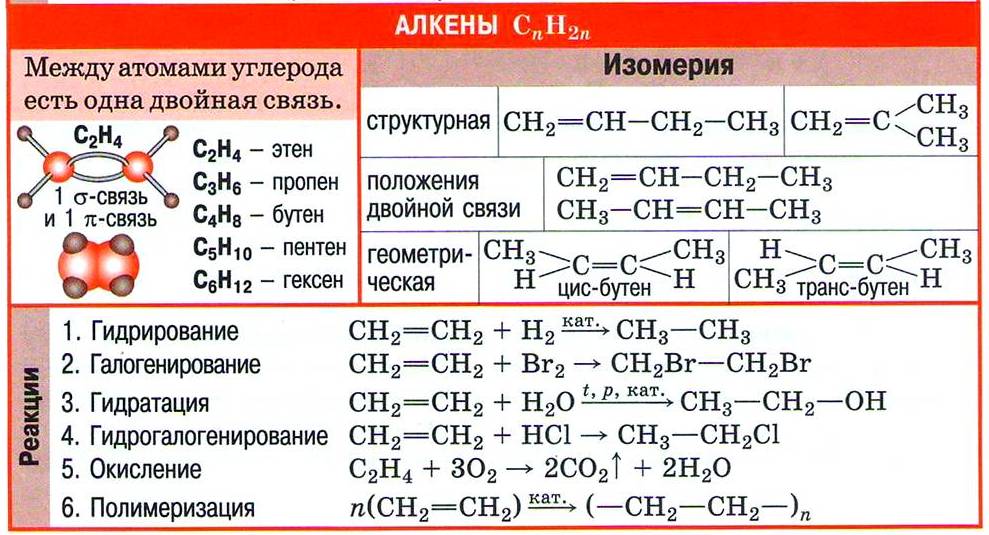
Гомологический ряд алкенов
Слово «полиэтилен» давно перестало быть научным термином. Каждому из вас знакомы прочные, прозрачные, не пропускающие газы и жидкости полиэтиленовые плёнки. Стеклянная упаковка косметических и гигиенических средств бытовой химии давно уступила пальму первенства небьющимся контейнерам из полиэтилена. Нередко металлические водопроводные трубы в квартирах заменяют на нержавеющие, лёгкие и гибкие полиэтиленовые. Многие бытовые предметы (ручки зубных щёток и корпуса шариковых ручек, ящики для овощей, посуда, игрушки) тоже изготовлены из полиэтилена.
Полиэтилен получают из углеводорода этилена С2Н4. В молекуле этилена два атома углерода связаны не одинарной, а двойной связью, что отражает структурная формула СН2=СН2. Этилен — первый представитель гомологического ряда этиленовых углеводородов, или алкенов.
| Углеводороды, содержащие в молекулах одну двойную связь и имеющие общую формулу СnН2n, называют алкенами. |
 Наличие в молекуле одной двойной связи С=С показывает, что валентности углеродных атомов не полностью насыщены атомами водорода, поэтому такие углеводороды называют непредельными углеводородами.
Наличие в молекуле одной двойной связи С=С показывает, что валентности углеродных атомов не полностью насыщены атомами водорода, поэтому такие углеводороды называют непредельными углеводородами.
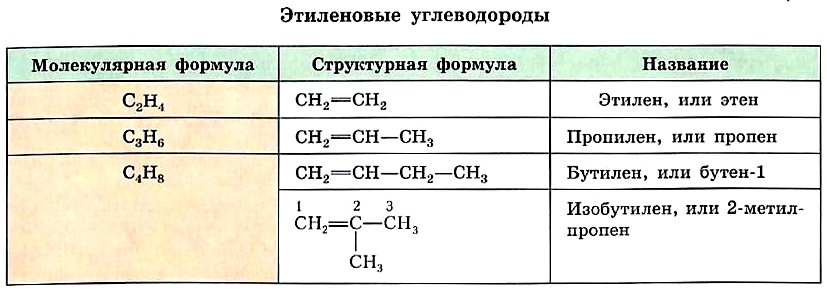
Этиленовые углеводороды образуют свой гомологический ряд. Как и в случае алканов, состав двух гомологов отличается на одну или несколько групп СН2. Приведём молекулярные и структурные формулы ближайших гомологов этилена.
Номенклатура
Два последних углеводорода в таблице 2 имеют одинаковый состав, но различное химическое строение, т. е. это изомеры. Однако у бутена изомерия проявляется не только в строении углеродной цепи (линейная или разветвлённая), но и в положении двойной связи в молекуле. В конце названия алкена арабской цифрой указывают атом углерода, за которым следует двойная связь: 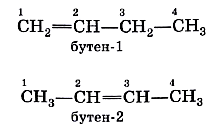
Изомерия положения двойной связи — тоже один из видов структурной изомерии.
Особенности пространственного строения этиленовых углеводородов приводят к появлению в гомологическом ряду алкенов ещё одного вида изомерии — пространственной изомерии.
Для бутена-2 возможно написание двух различных структурных формул. В первом случае углеродная цепь алкена расположена по одну сторону от линии двойной связи, а во втором — по разные стороны: 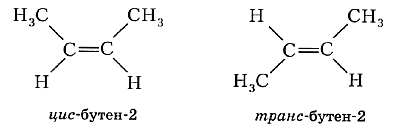
Эти два углеводорода имеют разные физические свойства (температуры кипения, плавления и др.). Каждое вещество имеет состав С4Н8, неразветвлённую цепь углеродных атомов, одинаковое положение кратной связи в цепи, но различаются они взаимным расположением атомов в пространстве. Следовательно, эти углеводороды являются изомерами. Первый называют цис -бутен-2, второй — транс -бутен-2. Такой вид пространственной изомерии носит название геометрической или цис-транс- изомерии (от лат. cis — на одной стороне и trans — напротив).
Физические свойства алкенов
Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом,
немного легче воздуха, малорастворим в воде.
С2 – С4 (газы)
С5 – С17 (жидкости)
С18 – (твёрдые)
§ Алкены не растворяются в воде, растворимы в органических
растворителях (бензин, бензол и др.);
§ Легче воды;
Способы получения алкенов
В отличие от предельных углеводородов, алкены встречаются в природе нечасто. Промышленные способы их получения основаны на превращении алканов в алкены. В качестве природных источников алкенов используют главным образом нефть и природный газ.
Один из способов получения алкенов — уже знакомая вам реакция дегидрирования соответствующих предельных углеводородов.
Главным промышленным способом получения алкенов является крекинг (от англ, crack — расщеплять) предельных углеводородов нефти и попутного нефтяного газа. Сущность процесса заключается в нагревании алканов без доступа воздуха в присутствии катализатора (каталитический крекинг) или при высокой температуре (термический крекинг). Цепь углеродных атомов разрывается примерно пополам, при этом образуются молекулы предельного и непредельного углеводородов: 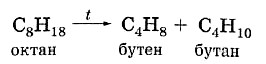
К лабораторным способам получения алкенов относят реакции отщепления. Для образования в молекуле двойной связи от соседних атомов углерода нужно отнять по одному связанному с ними атому или группе. Тогда освободившиеся валентности превращаются во вторую углерод-углеродную связь.
В лаборатории этилен получают из этилового спирта с помощью концентрированной серной кислоты (водоотнимающего средства) при нагревании: 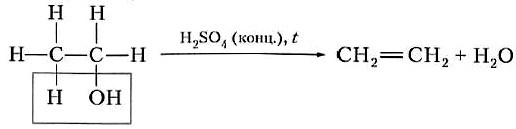
или 
| Реакции отщепления воды от молекул органических веществ называют реакциями дегидратации. |