Государственное образовательное учреждение
Высшего профессионального образования
Уфимский государственный нефтяной технический университет
Кафедра «Промышленная теплоэнергетика»
Ф.Ф. АБУЗОВА, Р.А.МОЛЧАНОВА, М.А.ГИЗЗАТОВ,
В.В.РЕПИН, В.В.КУЗНЕЦОВА
УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ
По выполнению курсового проекта
По дисциплине «Теплотехника»
Учебно-методическое пособие предназначено для выполнения курсового проекта по дисциплине «Теплотехника» для подготовки дипломированных специалистов и бакалавров техники и технологии по направлению 130500 «Нефтегазовое дело» специальности 130504 «Ьурений нефтяных и газовых скважин».
Курсовой проект состоит из двух частей: часть 1 – термодинамические процессы с идеальными углеводородными смесями, часть 2 – тепловой расчет теплообменного аппарата. Исходные данные к расчету принять в таблицах исходных данных, расположенных в методических указаниях к каждой части курсового проекта.
В учебно-методическом пособии обобщены многолетний опыт и методические материалы преподавателей кафедры.
Авторы: профессор, д.т.н. Ф.Ф.Абузова;
доцент, канд.техн.наук Молчанова Р.А;
доцент, канд.техн.наук Гиззатов М.А.;
доцент, канд.техн.наук Репин В.В.;
доцент, канд.техн.наук Кузнецова В.В..
СОДЕРЖАНИЕ
| Основные условные обозначения..................................................................... | ||
| Введение………………………………………………………………………… | ||
| ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫС ИДЕАЛЬНЫМИ УГЛЕВОДОРОДНЫМИ СМЕСЯМИ............................................................... | ||
| 1.1 | Политропный процесс………………………………………………………….. | |
| 1.2 | Изобарный процесс……………………………………………………………... | |
| 1.3 | Изохорный процесс …………………………………………………………….. | |
| 1.4 | Изотермический процесс……………………………………………………….. | |
| 1.5 | Адиабатный процесс …………………………………………………………… | |
| 1.6 | Термодинамический расчет процессов с идеальной газовой углеводородной смесью..................................................................................... | |
| Задание для первого раздела…………………………………………………. | ||
| Сводная таблица результатов термодинамического расчета........................ | ||
| Исходные данные............................................................................................... | ||
| Вопросы для самопроверки............................................................................... | ||
| Литература........................................................................................................... | ||
| Приложение 1.1...................................................................................................... | ||
| РАСЧЕТ ТЕПЛООБМЕННОГО АППАРАТА...................... | ||
| 2.1 | Типы теплообменных аппаратов....................................................................... | |
| 2.2 | Методика теплового расчета рекуперативного теплообменного аппарата... | |
| 2.2.1 | Конструктивный тепловой расчет теплообменного аппарата....................... | |
| 2.2.2 | Расчет коэффициента теплоотдачи................................................................. | |
| Задание для второго раздела ……………….................................................. | ||
| Исходные данные................................................................................................ | ||
| Вопросы для самопроверки.............................................................................. | ||
| Литература.............................................................................................................. | ||
| Приложение 2.1...................................................................................................... | ||
| Приложение 2.2..................................................................................................... | ||
| Методические указания по оформлению курсового проекта | ||
| Приложение 3.1...................................................................................................... | ||
ОСНОВНЫЕ УСЛОВНЫЕ ОБОЗНАЧЕНИЯ
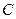
| – теплоемкость политропная, 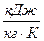 ; ;
|
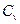
| – теплоемкость изохорная, 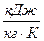 ; ;
|
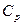
| – теплоемкость изобарная, 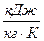 ; ;
|
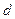
| – знак дифференциала; |
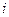
| – энтальпия удельная, 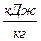 ; ;
|
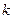
| – показатель адиабаты; |
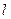
| – работа удельная термодинамическая (закрытой системы), 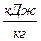 ; ;
|
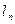
| – работа удельная потенциальная (открытой системы), 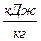 ; ;
|
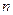
| – показатель политропы; |
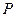
| – давление, Па; |
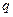
| – теплота удельная, 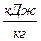 ; ;
|
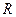
| – газовая постоянная, 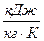 ; ;
|
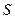
| – энтропия удельная, 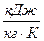 ; ;
|
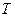
| – термодинамическая (абсолютная) температура, К; |
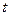
| – температура, ºС; |
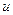
| – внутренняя энергия удельная, 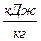 ; ;
|
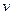
| – объем удельный, 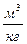 ; ;
|
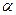
| – коэффициент распределения энергии; |
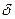
| – знак элементарной величины; |
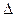
| – знак изменения конечной величины. |
ВВЕДЕНИЕ
В настоящее время невозможно назвать ни одну область производственной деятельности человека, где бы ни использовалась теплота.
Бурно развивающаяся мировая экономика требует все больших энергетических затрат, непрерывного роста энерговооруженности стран мира.
Основным источником теплоты является органическое топливо, которое сжигается в топках котельных агрегатов, камерах сгорания двигателей, газотурбинных газоперекачивающих агрегатов, различных печах и т.д. В целом более 90% всей используемой человечеством энергии приходится на ископаемые органические топлива.
Высокие цены на топливо на мировом рынке заставляют резко увеличивать степень использования добываемого топлива.
Главная роль в разработке энергосберегающих технологий принадлежит проектировщикам-технологам – неэнергетикам. Ее невозможно решить без глубоких знаний основных законов теплотехники.
Теплотехника – наука, которая изучает методы получения, преобразования, передачи и использования теплоты, а также принципы действия и конструктивные особенности тепловых машин, аппаратов и устройств.
Теоретическими разделами теплотехники являются:
1 - термодинамика;
2 - теплообмен.
1 ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫС ИДЕАЛЬНЫМИ УГЛЕВОДОРОДНЫМИ СМЕСЯМИ
Простейшими процессами в термодинамике являются: изохорный (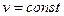 ); изобарный (
); изобарный (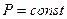 ); изопотенциальный (
); изопотенциальный (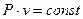 ); последний называется изотермическим, поскольку для идеального газа
); последний называется изотермическим, поскольку для идеального газа 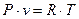 , где
, где 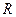 – удельная газовая постоянная. Уравнение процесса может быть задано условием о равенстве нулю какого-либо эффекта в этом термодинамическом процессе (например, равенство нулю теплоты
– удельная газовая постоянная. Уравнение процесса может быть задано условием о равенстве нулю какого-либо эффекта в этом термодинамическом процессе (например, равенство нулю теплоты 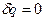 – адиабатный процесс и т.п.)
– адиабатный процесс и т.п.)
Рассмотрим задачи и методы исследования на примере политропного процесса.
1.1 Политропный процесс
1.1.1 Уравнение процесса
Для вывода уравнения обратимого политропного процесса идеального газа запишем уравнение первого начала – затрату элементарной теплоты в любом процессе
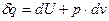 или или
| |
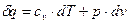 , ,
| (1) |
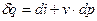 или или
| |
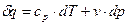 , ,
| (2) |
кроме того, можно выразить теплоту через политропную теплоемкость 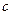 :
:
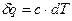
| (3) |
Заменив в левой части уравнения (1) и (2) 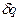 по выражению (3) и преобразовав их, имеем
по выражению (3) и преобразовав их, имеем
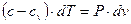
| (4) |
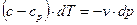
| (5) |
Разделив уравнение (5) на (4), получим
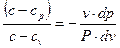
| (6) |
Обозначим
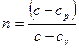 – –
| (7) |
показатель политропы.
Таким образом, из (6):
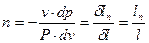 . .
| (8) |
Это значит, что постоянный показатель политропы равен отношению элементарных или конечных значений потенциальной работы к термодинамической работе. Как зивестно, конечные потенциальная и термодинамическая работы определяются соответствующими площадями в P-v-координатах (рис. 1.1):
площадь 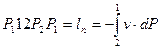 ,
,
площадь 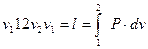 .
.
Используя далее 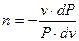 , можно получить
, можно получить
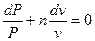 . .
| (9) |
Последовательно интегрируя и потенцируя, получим уравнение политропы в P-v-координатах (10):
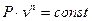 . .
| (10) |
Показатель политропы 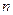 для данного процесса величина постоянная, но может иметь любые числове значения от
для данного процесса величина постоянная, но может иметь любые числове значения от 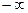 до
до 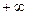 .
.
Поскольку рассматриваемый газ идеальный, может быть использовано уравнение состояния
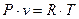
| (11) |
Используя совместно уравнения (10) и (11), получим уравнение политропы в T-v-координатах:
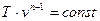 . .
| (12) |
и в P-T-координатах:
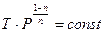 . .
| (13) |
1.1.2 Взаимосвязь между параметрами в разных состояниях
Записав уравнение (10) в виде
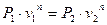 , ,
| (14) |
получим 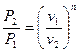 и аналогично из (12) и (13):
и аналогично из (12) и (13):
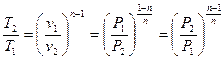 . .
| (15) |
1.1.3 Работа расширения (термодинамическая) политропного процесса
Из выражения (8) 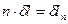 , поэтому, с одной стороны:
, поэтому, с одной стороны:
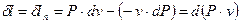 , ,
| (16) |
с другой стороны,
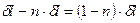 . .
| (17) |
Используя (16) и (17), получим
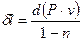
| (18) |
или
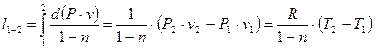 . .
| (19) |
1.1.4 Изменение внутренней энергии
Для идеального газа
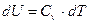 , ,
| (20) |
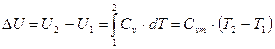 . .
| (21) |
Из (21) имеем: 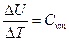 – в политропном процессе изменение внутренней энергии идеального газа при изменении температуры на один градус остается неизменным.
– в политропном процессе изменение внутренней энергии идеального газа при изменении температуры на один градус остается неизменным.
1.1.5 Изменение энтальпии
Для идеального газа 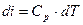 :
:
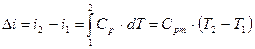 . .
| (22) |
Из (22) 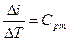 – в политропном процессе изменение энтальпии идеального газа при изменении температуры на один градус остается неизменным.
– в политропном процессе изменение энтальпии идеального газа при изменении температуры на один градус остается неизменным.
1.1.6 Теплота процесса
Используя (3), получим
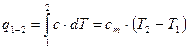 . .
| (23) |
1.1.7 Изменение энтропии
Известно, что
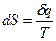 . .
| (24) |
Используя (24) совместно с (3), имеем
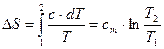 . .
| (25) |
1.1.8 Теплоемкость политропного процесса
Уравнение (1) в конечных величинах
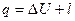 . .
| (26) |
Используем уравнения (19), (21) и (23) и поставим их в выражение (26):
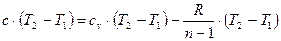 . .
| (27) |
После сокращения на 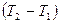 получим
получим 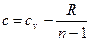 и, учитывая, что
и, учитывая, что 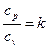 , после преобразований имеем окончательно
, после преобразований имеем окончательно
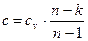 . .
| (28) |
1.1.9. Коэффициент распределения энергии
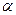 показывает долю внешней теплоты, затраченной на изменение внутренней энергии:
показывает долю внешней теплоты, затраченной на изменение внутренней энергии:
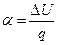 . .
| (29) |
Используя (21) и (23) совместно с (29) и (28), получим
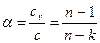 . .
| (30) |
1.1.10. Показатель политропы
В данной работе будут рассматриваться процессы, для которых показатель политропы 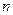 величина постоянная для каждого конкретного процесса, но может иметь любые численные значения от
величина постоянная для каждого конкретного процесса, но может иметь любые численные значения от 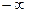 до
до 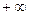 .
.
В логарифмических координатах 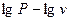 политропа (10) с постоянным показателем представляет собой прямую линию (рис. 1.2), причем показатель
политропа (10) с постоянным показателем представляет собой прямую линию (рис. 1.2), причем показатель 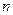 равен тангенсу угла наклона этой линии в координатах
равен тангенсу угла наклона этой линии в координатах 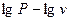 . Из уравнения (10) имеем
. Из уравнения (10) имеем
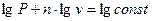 . .
| (31) |
Анализ различных термодинамических процессов показывает, что не все процессы в координатах 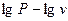 изображаются прямой линией, т.е. не все имеют постоянный показатель. Подробнее о процессах с переменным показателем можно узнать в [3].
изображаются прямой линией, т.е. не все имеют постоянный показатель. Подробнее о процессах с переменным показателем можно узнать в [3].
1.6 ТЕРМОДИНАМИЧЕСКИЙ РАСЧЕТ ПРОЦЕССОВ С ИДЕАЛЬНОЙ ГАЗОВОЙ УГЛЕВОДОРОДНОЙ СМЕСЬЮ
Общие указания
К выполнению первой части курсовой работы следует приступать после изучения раздела 1 и разделов учебной литературы, перечисленных ниже:
· Основные понятия и определения технической термодинамики. Газовые смеси: способы задания, вычисление параметров, определение кажущейся молярной массы и газовой постоянной смеси.
· Первый закон термодинамики: сущность, аналитическое выражение, выражение работы и теплоты через параметры состояния, внутренняя энергия, энтальпия, энтропия, теплоемкость и зависимость ее от температуры, средняя теплоемкость, теплоемкость смеси идеальных газов.
· Второй закон термодинамики: сущность, термодинамическая шкала температур, аналитическое выражение.
· Термодинамические процессы: классификация процессов изменения состояния, общие методы исследования процессов изменения состояния. Политропные процессы: уравнение политропы, определение показателя политропы, анализ процессов на основе сравнения показателей политропы, процессы в координатах P-v и T-S, частные случаи политропного процесса: изохорный, изобарный, изотермический и адиабатный.
Исходные данные для выполнения первой части курсовой работы выбираются из табл. 2 и 3 по последней цифре шифра (номера зачетной книжки) студента. Вариант работы должен соответствовать заданию и шифру студента.
Работы, выполненные не по своему варианту, не рассматриваются.
При выполнении курсовой работы необходимо соблюдать следующие условия:
- выписать условие задания и исходные данные;
- при расчете указать условное обозначение, расчетную формулу или способ получения для каждой величины;
- поместить подробный расчет величины для адиабатного процесса (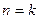 ), при этом рекомендуется пользоваться микрокалькулятором;
), при этом рекомендуется пользоваться микрокалькулятором;
- вычисления вести до третьего знака после запятой, проводить их в единицах СИ, подставлять размерности;
- до выполнения вычислений на ПЭВМ необходимо представить расчеты для проверки преподавателю;
- по результатам расчета для всех показателей необходимо представить сводную таблицу (форма, табл. 1);
- после выполнения задания нужно дать краткий анализ полученных результатов и сделать выводы.
Изображение процессов в P-v- и T-S-координатах необходимо оформить на миллиметровке.
Порядок расчета величин и основных характеристик термодинамических процессов с идеальной газовой смесью должен соответствовать изложению раздела 1.
Контроль правильности расчета проводится по следующим основным признакам:
- конечные параметры состояния и величины в сводной табл. 1 должны по величине постепенно возрастать и уменьшаться по мере увеличения показателя от 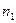 до
до 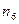 ;
;
- относительная ошибка расчета, вычисленная путем подстановки найденных значений величин в уравнение первого начала (26), не должна превышать 3%.
На основании полученных расчетом параметров 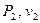 и
и 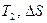 термодинамические процессы для всех заданных показателей политропы изображаются в P-v- и T-S-координатах.
термодинамические процессы для всех заданных показателей политропы изображаются в P-v- и T-S-координатах.
Построение P-v- и T-S-диаграмм начинают с выбора масштаба координатных осей (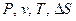 ) с таким расчетом, чтобы на II формате миллиметровки поместить наибольшие изменения параметров (от
) с таким расчетом, чтобы на II формате миллиметровки поместить наибольшие изменения параметров (от 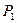 до
до 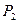 , от
, от 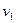 до
до 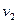 и т.д.) при конкретных исходных данных.
и т.д.) при конкретных исходных данных.
Затем при построении P-v-диаграммы наносят начальное состояние (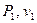 ), конечное (
), конечное (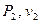 ) и при необходимости промежуточные точки для каждого процесса (каждого значения
) и при необходимости промежуточные точки для каждого процесса (каждого значения 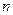 ), по этим точкам проводят процессы (от начального до конечного состояния).
), по этим точкам проводят процессы (от начального до конечного состояния).
На рис. 1.12 в координатах P-v изображено примерное расположение политропных процессов с общим начальным состоянием (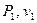 ) для различных значений показателя политропы (
) для различных значений показателя политропы (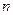 ) при сжатии.
) при сжатии.
При построении диаграммы T-S после выбора масштаба наносят на диаграмму точку 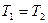 и проводят изотерму
и проводят изотерму 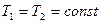 , затем проводят адиабату
, затем проводят адиабату 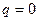 (
(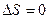 ); точка пересечения изотермы (
); точка пересечения изотермы (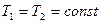 ) и адиабаты (
) и адиабаты (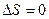 ) изображает начальное состояние для всех процессов; конечные состояния для каждого процесса (каждого значения) находят по соответствующим конкретным для процесса значениям
) изображает начальное состояние для всех процессов; конечные состояния для каждого процесса (каждого значения) находят по соответствующим конкретным для процесса значениям 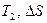 .
.
Если в итоге построения соединение конечных состояний всех процессов дает плавную кривую, имеющую направление изохоры в T-S-диаграмме, то расчеты и построение произведены правильно.
На рис. 1.13 изображена примерная T-S-диаграмма политропных процессов для расширения.

Рис. 1.12 – PV-диаграмма политропных процессов (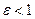 )
)
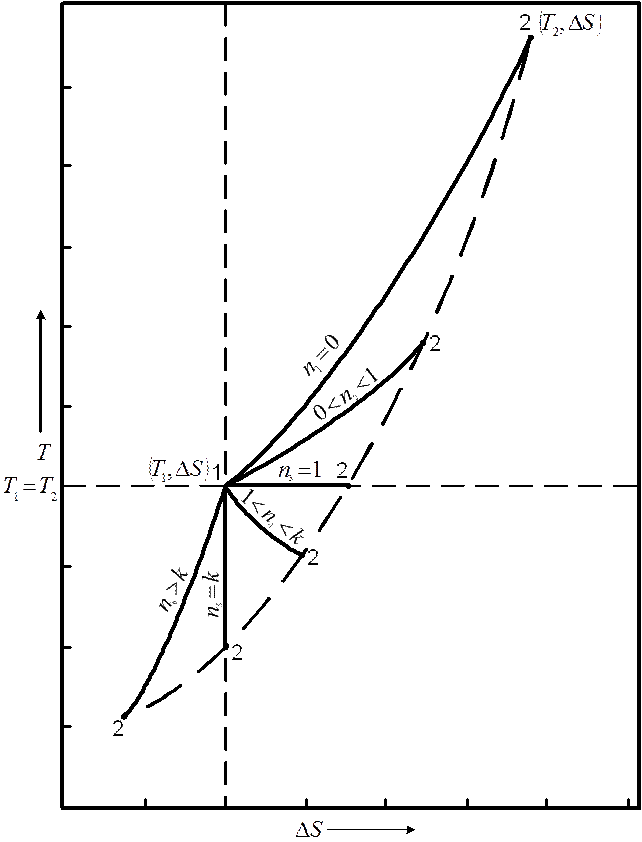
Рис. 1.13 – TS-диаграмма политропных процессов (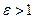 )
)
ЗАДАНИЕ ДЛЯ ПЕРВОГО РАЗДЕЛА КУРСОВОГО ПРОЕКТА
1 кг газовой смеси в распределительной газовой сети (в емкости хранения сжиженных нефтяных газов, в газовом пространстве резервуара для нефти) в зависимости от состава совершает термодинамические процессы от состояния 1 до состояния 2 с показателями 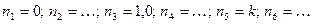 .
.
Объем газовой смеси во всех процессах изменяется в 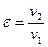 раз.
раз.
Смесь обладает свойствами идеального газа.
Начальное (в состоянии 1) давление 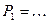 .
.
Определить основные параметры газовой смеси в состоянии 1 (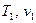 ) и состоянии 2 (
) и состоянии 2 (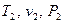 ), изменение внутренней энергии, энтальпии, энтропии смеси, работу, внешнюю теплоту процесса, коэффициент распределения энергии в процессах.
), изменение внутренней энергии, энтальпии, энтропии смеси, работу, внешнюю теплоту процесса, коэффициент распределения энергии в процессах.
Исходные данные для варианта ___ принять по двум последним цифрам шифра зачетной книжки по табл. 2 и 3.
Таблица 1
СВОДНАЯ ТАБЛИЦА РЕЗУЛЬТАТОВ ТЕРМОДИНАМИЧЕСКОГО РАСЧЕТА
| Показатель политропы | 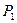
| 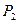
| 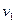
| 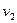
| 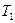
| 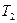
| 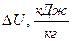
| 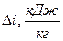
| 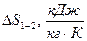
| 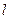
| 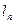
| 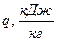
| 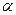
| Относительная ошибка расчета, % |
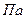
| 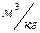
| 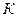
| 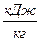
| |||||||||||
Таблица 2
ИСХОДНЫЕ ДАННЫЕ
| Наименование величины | Последняя цифра шифра | ||||||||||
| Вариант – 1 (для процессов в распределительной газовой сети) | |||||||||||
| Состав газовой смеси по объему, % | 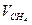
| ||||||||||
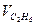
| - | - | - | ||||||||
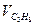
| - | - | - | - | |||||||
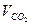
| - | ||||||||||
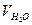
| - | ||||||||||
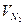
| - | ||||||||||
Давление 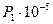 , Па , Па
| |||||||||||
Температура 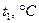
| |||||||||||
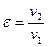
| 1,5 | 1,3 | 1,5 | 1,7 | 1,2 | 1,4 | 1,6 | 1,8 | 1,2 | 1,5 | |
| Вариант – 2 (для процессов в распределительной газовой сети) | |||||||||||
| Состав газовой смеси по объему, % | 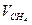
| ||||||||||
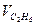
| - | - | - | ||||||||
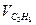
| - | - | - | - | |||||||
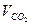
| - | ||||||||||
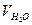
| - | ||||||||||
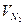
| - | ||||||||||
Давление 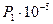 , Па , Па
| |||||||||||
Температура 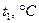
| |||||||||||
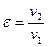
| 1,8 | 2,0 | 2,2 | 1,7 | 1,9 | 2,1 | 1,3 | 1,5 | 1,2 | 1,4 | |
| Продолжение таблицы 2 | |||||||||||
| Наименование величины | Последняя цифра шифра | ||||||||||
| Вариант – 3 (для процессов в емкостях хранения сжиженных нефтяных газов) | |||||||||||
| Состав газовой смеси по объему, % | 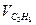
| ||||||||||
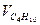
| |||||||||||
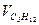
| - | - | - | - | - | ||||||
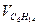
| - | - | - | ||||||||
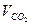
| 1,5 | - | |||||||||
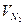
| 0,5 | - | |||||||||
Давление 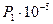 , Па , Па
| 1,3 | 1,4 | 1,5 | 1,6 | 1,7 | 1,8 | 1,45 | 1,55 | 1,65 | 1,75 | |
Температура 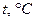
| |||||||||||
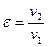
| 0,8 | 1,2 | 1,2 | 1,3 | 1,4 | 1,5 | 0,9 | 1,2 | 1,1 | 1,2 | |
| Вариант – 4 (для процессов в газовых пространствах емкостей для нефти) | |||||||||||
| Состав газовой смеси по объему, % | 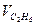
| - | - | 1,0 | - | - | - | ||||
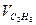
| |||||||||||
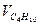
| |||||||||||
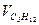
| |||||||||||
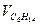
| - | - | - | - | - | ||||||
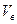 * *
| |||||||||||
Давление 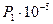 , Па , Па
| 1,1 | 1,08 | 1,06 | 1,04 | 1,02 | 1,00 | 1,02 | 1,00 | 1,02 | 1,00 | |
Температура 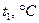
| |||||||||||
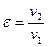
| 1,2 | 1,16 | 1,14 | 1,12 | 1,10 | 0,90 | 0,92 | 0,92 | 0,90 | 0,92 | |
* 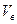 – содержание воздуха в газовой смеси, % – содержание воздуха в газовой смеси, %
| |||||||||||
| Продолжение таблицы 2 | |||||||||||
| Наименование величины | Последняя цифра шифра | ||||||||||
| Вариант – 5 (для процессов в газовых пространствах емкостей для бензина, реактивного керосина) | |||||||||||
| Состав газовой смеси по объему, % | 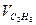
| 1,0 | 0,5 | 1,0 | 0,5 | 0,2 | 1,0 | 0,5 | 1,0 | 0,5 | 0,2 |
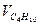
| 12,0 | 10,0 | 8,0 | 9,0 | 10,0 | 12,0 | 10,0 | 8,0 | 9,0 | 10,0 | |
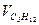
| 5,0 | 4,0 | 8,0 | 5,0 | 8,8 | 5,0 | 4,0 | 8,0 | 5,0 | 8,8 | |
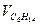
| 2,0 | 0,5 | 3,0 | 0,5 | 1,0 | 2,0 | 0,5 | 3,0 | 0,5 | 1,0 | |
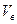 * *
| 80,0 | 85,0 | 80,0 | 85,0 | 80,0 | 80,0 | 85,0 | 80,0 | 85,0 | 80,0 | |
Давление 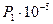 , Па , Па
| 2,0 | 1,8 | 1,6 | 1,5 | 1,4 | 1,0 | 1,0 | 1,2 | 1,3 | 1,4 | |
Температура 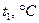
| |||||||||||
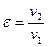
| 1,5 | 1,4 | 1,3 | 1,2 | 1,1 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 | |
* 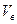 – содержание воздуха в газовой смеси, % – содержание воздуха в газовой смеси, %
|
Таблица 3
| Наименование величины | Последняя цифра шифра | |||||||||||
| Варианты 1 – 5 | ||||||||||||
| Показатель политропы | 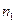
| 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | |
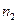
| 0,20 | 0,40 | 0,40 | 0,50 | 0,60 | 0,70 | 0,20 | 0,30 | 0,40 | 0,50 | ||
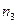
| 1,00 | 1,00 | 1,00 | 1,00 | 1,00 | 1,00 | 1,00 | 1,00 | 1,00 | 1,00 | ||
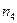
| 1,10 | 1,15 | 1,20 | 1,25 | 1,25 | 1,20 | 1,15 | 1,10 | 1,05 | 1,20 | ||
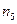
| k | k | k | k | k | k | k | k | k | k | ||
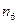
| 1,50 | 1,60 | 1,70 | 1,80 | 1,90 | 2,00 | 1,55 | 1,65 | 1,75
Поиск по сайту©2015-2026 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование. Дата создания страницы: 2020-11-02 Нарушение авторских прав и Нарушение персональных данных |
Поиск по сайту: Читайте также: Деталирование сборочного чертежа Когда производственнику особенно важно наличие гибких производственных мощностей? Собственные движения и пространственные скорости звезд |