· Потенциометрические измерения Электроды
Для любых электрохимических измерений необходима электрохимическая цепь или электрохимическая ячейка, составной частью которой являются анализируемый раствор (электролит) и электроды
Потенциал отдельного электрода экспериментально определить невозможно, поэтому для потенциометрических измерений используют два электрода.
Один из электродов электрохимической ячейки должен обратимо реагировать на изменение состава анализируемого раствора, чтобы, но наличию (или отсутствию) аналитического сигнала и его интенсивности можно было судить о том, присутствует ли интересующий нас компонент в растворе и каково его количество. Этот электрод называют измерительным или индикаторным.
Другой электрод, относительно которого измеряют потенциал индикаторного электрода, должен быть: химически индифферентным к определяемым ионам и обладать высокой воспроизводимостью, т.е. сохранять постоян-ство потенциала при хранении и работе в различных условиях. Такой электрод называют электродом сравнения или стандартным электродом.
· Индикаторные электроды
Индикаторные электроды могут быть условно отнесены к двум группам:
-электроды, на межфазных границах которых и протекают реакции с участием электронов (электронообменные электроды).
-электроды, на которых протекают ионообменные реакции (ионообменные или мембранные электроды).
К электронообменным электродам относят:
- металлические электроды, потенциал которых определяется только концентрацией собственных ионов в растворе, например, серебряный электрод. Его потенциал в растворе, содержащем ионы Ag+, имеет вид:
φ Ag+/Ag0= φ0 Ag+/Ag0 + 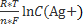
- окислительно-восстановительные электроды - это металлические электроды из инертных металлов (Pt, Pd, Au, реже – W, Ni, угольный), которые погружают в раствор, содержащий одновременно окисленную и восстановленную формы какого-либо вещества, например: Pt | ок/вос Инертные металлические электроды не участвуют в реакциях, а служат лишь для переноса электронов от восстановленной формы к окисленной.
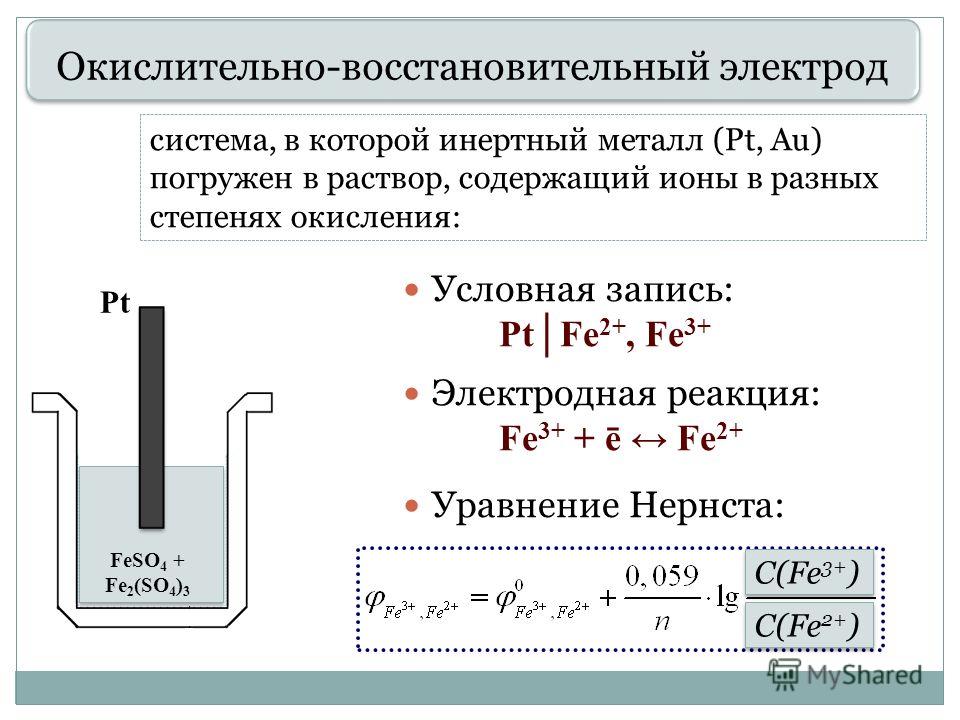
Рисунок 1- металлический и окислительно-восстановительный электроды
К ионообменным электродам относятся мембранные электроды, обладающие ионной проводимостью
Ионоселективные электроды (ИСЭ) - это сенсоры (чувствительные элементы, датчики), потенциал которых линейно зависит от логарифма активности определяемого иона в растворе, они позволяют избирательно определять активность одних ионов в присутствии других.
Потенциал мембранного электрода возникает за счет обмена заряженными частицами (ионами) между раствором и мембраной электрода. Полупроницаемая мембрана отделяет внутреннюю часть электрода (внутренний раствор) от анализируемого (внешнего) раствора и обладает способностью пропускать преимущественно ионы одного вида. Активность ионов, к которым мембрана проницаема, во внутреннем растворе постоянна.
При потенциометрических измерениях с использованием ИСЭ измеряют ЭДС следующей ячейки:
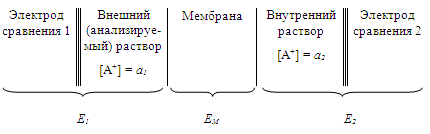

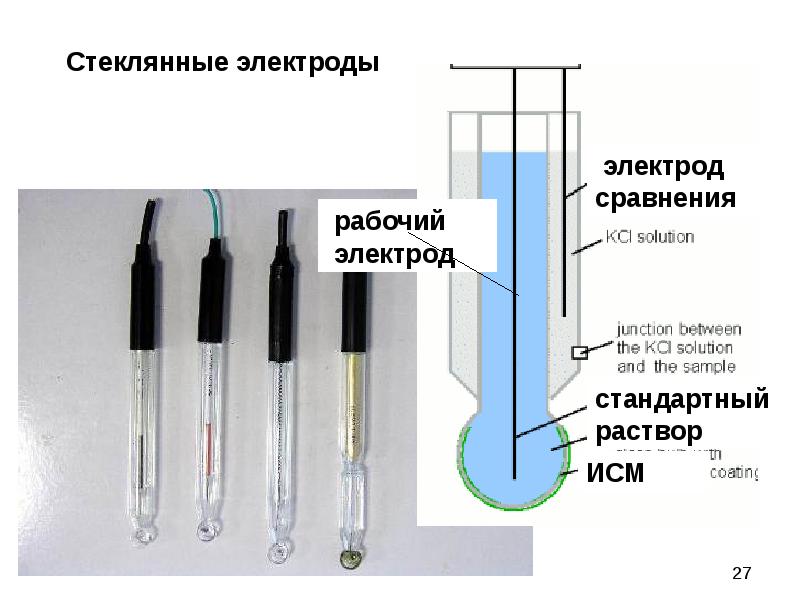
Рисунок 2-Мембранные электроды
Широко известным примером мембранного электрода является стеклянный электрод для измерения рН растворов.
Электродом является стеклянный шарик (мембрана) диаметром 15-20 мм с толщиной стенок 0,06 - 0.1 мм, изготовленный из стекла особого состава (Me2O·Al2O3·SiO2 где Me - Li, Na), расположенный на конце стеклянной трубки (рис.2). Внутри шарика - раствор с определенным значением рН (0,1-0,01 м HCI), в который погружен электрод сравнения хлорсеребряный или каломельный. Перед работой стеклянный электрод некоторое время вымачивается в 0,1 м HCI. При этой ионы H+ из раствора обмениваются на ионы Na+ из мембраны, и в системе устанавливается равновесие:
SiONa+ + H+ <↔> SiOH+ + Na+
стекло- раствор стекло- раствор
Если подготовленный таким образом электрод опустить в раствор, содержащий ионы Н+, произойдет обмен ионами водорода между анализируемым раствором и внешней поверхностью мембраны, т.е. протекает электродная реакция
H+ <↔> Н+
раствор стекло,
приводящая к возникновению потенциала. Величина этого потенциала зависят от активности ионов Н+ в анализируемом растворе:
На внутренней поверхности стекла также возникает потенциал, который остается постоянным в растворе с постоянной активностью ионов водорода.
Для определения рН в исследуемый раствор погружается стеклянный индикаторный электрод и хлорсеребряный электрод сравнения (иногда вся система комбинируется в одном электроде – комбинированный электрод).
Поскольку активность ионов водорода во внутреннем растворе постоянна, потенциал стеклянного электрода становится мерой активности ионов водорода во внешнем растворе, т. е. электрод обладает водородной функцией:
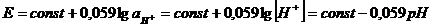
Стеклянный электрод пригоден для измерения рН от 0 до 10,
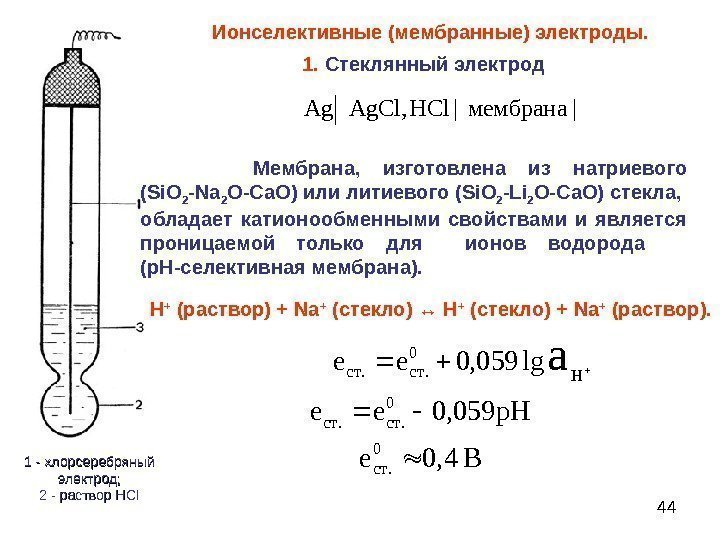
Рисунок 3- стеклянный электрод
· Электроды сравнения
Электрод сравнения должен обладать постоянным потенциалом, не зависящим от состава исследуемого раствора. В качестве электродов сравнения чаще используют хлоридсеребряный и насыщенный каломельный электроды.
Хлорсеребряный электрод (х.с.э.) – электрод, чувствительный к анионам Cl−, которые образуют осадки с катионами металла электрода (Ag+). Он представляет собой серебряную проволоку, покрытую равномерным слоем AgCl, который хорошо проводит электрический ток. Проволоку погружают в насыщенный раствор КСl. В растворе устанавливается равновесие: AgCl(тв) + e-→Ag(тв) + Cl−, т.е. его потенциал определяется концентрацией Cl− – ионов. Потенциал данного хлорсеребряного электрода равен +0,201 В.
Насыщенный каломельный электрод (н.к.э.) изготовлен на основе металлической ртути и каломели Hg2Cl2. Электрохимическое уравнение, характеризующее поведение электрода, описывается полуреакцией Hg2Cl2 + 2e-→2Hg + 2Cl−.
Так же, как и в случае х.с.э. потенциал зависит от концентрации Cl−–ионов. При использовании в качестве электролита насыщенного раствора КСl, потенциал электрода равен +0,244 В.
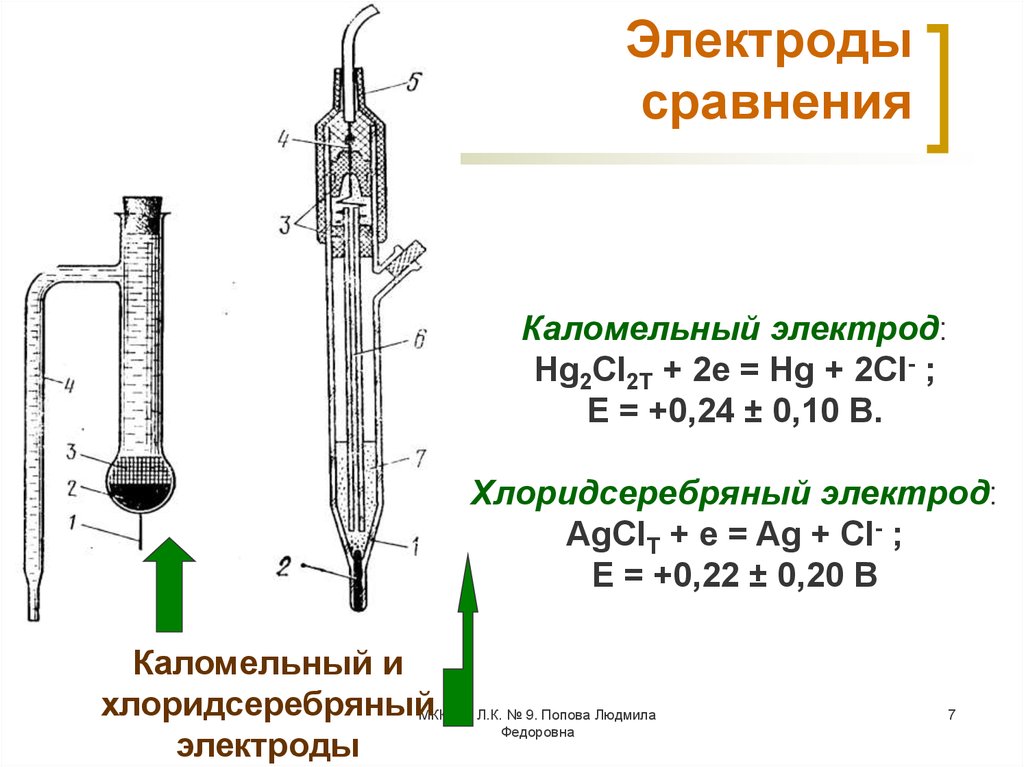
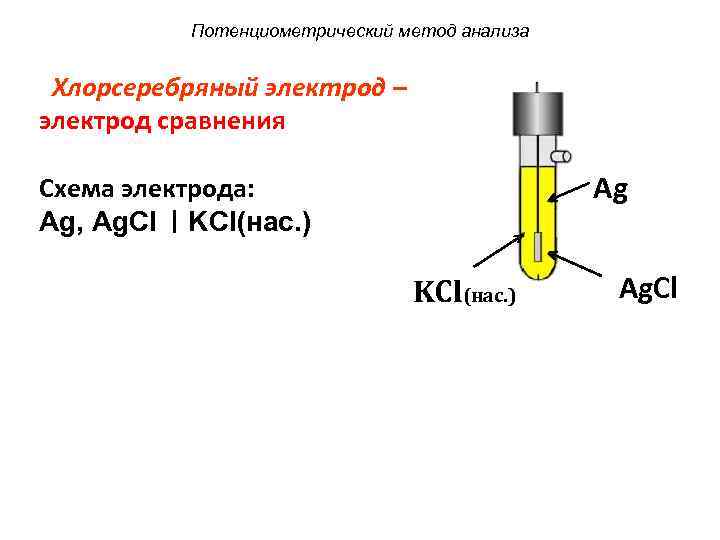
Рисунок 4- Электроды сравнения
· Виды потенциометрических определений
Различают прямую потенциометрию и потенциометрическое титрование.
Прямая потенциометрия основана на непосредственном применении уравнения Нернста для определения активности или концентрации определяемого компонента по экспериментально измеренной ЭДС или потенциалу электрода.
Для проведения потенциометрического анализа собирают гальванический элемент, состоящий из индикаторного электрода и электрода сравнения.
Е = Еинд - Еср
Электродвижущая сила исследуемого элемента (Е) выражается как разность между потенциалом индикаторного электрода (Еинд) и потенциалом электрода сравнения (Еср).
Следует особо отметить, что потенциометрическое титрование можно проводить компенсационным и некомпенсационным способами.
Компенсационный способ - во время титрования определяют ЭДС ячейки потенциометрического титрования (титруемый раствор с электродами индикаторным и сравнения). Искомую разность потенциалов (ЭДС) измеряют при отсутствии тока в цепи. При отсутствии поляризации электродов получают истинное значение ЭДС ячейки, которая зависит только от изменения потенциала индикаторного электрода (Еинд), отличаясь от него на постоянную величину (Ест): Е = Еинд - Ест.
Для проведения компенсационного титрования ЭДС ячейки уравновешивают (компенсируют) противоположно направленной ЭДС (~2 В) внешнего источника постоянного тока (сухих батарей или аккумулятора)
. 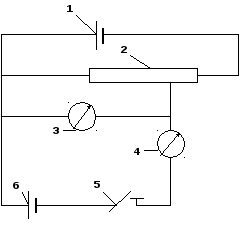
Рисунок 5-Схема компенсационного измерения ЭДС
Ток от аккумулятора 1 подается к клеммам реостата 2, с помощью которого напряжение равномерно повышают от нуля до значения ЭДС аккумулятора. Ячейку 6 через ключ 5 и гальванометр 4 присоединяют одним полюсом к движку реостата, а другим к его началу. Повышая постепенно напряжение, перемещением движка реостата и замыкая периодически (лишь на короткое время для уменьшения поляризации) ключ 5, добиваются установки стрелки гальванометра на нуль. При этом ЭДС ячейки (Ех) будет скомпенсирована разностью потенциалов, установившейся на реостате (ЕR) и определяемой вольтметром 3, т.е. Ех = ЕR.
Компенсационное потенциометрическое титрование с биметаллическими электродами - способ основан на том, что разные инертные металлы с разной скоростью отзываются на изменение потенциала раствора. Например, платина быстро реагирует на изменение концентраций окисленной и восстановленной форм, а палладий, родий, графит и вольфрам – медленно. Поверхность последнего при погружении в раствор с редокс-системой быстро покрывается оксидной пленкой, невосприимчивой к такому изменению. Поэтому вольфрам и подобные ему в поведении материалы могут быть использованы как электроды сравнения в паре с Pt-индикаторным электродом. Если опустить, например, Pt-электроды в титруемый раствор, содержащий окислительно-восстановительную систему, то разность потенциалов между ними в ходе титрования до точки эквивалентности будет близка к нулю, а в точке эквивалентности резко возрастет, что определяется по резкому и устойчивому отклонению стрелки гальванометра.
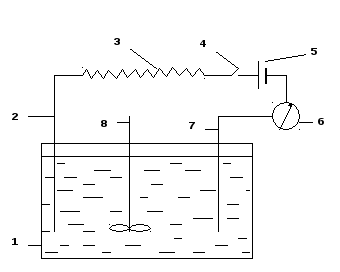
Рисунок 6– Схема установки для титрования с биметаллическими электродами
Высокочувствительный гальванометр 6 подключают через высокоомное сопротивление 3, ключ 4 и аккумулятор 5 к вольфрамовому 7 и платиновому 2 электродам ячейки 1. Так как необходимо энергичное перемешивание титруемого раствора, то ячейка снабжена мешалкой 8.
Компенсационное потенциометрическое титрование с биметаллическими электродами является удобным, быстрым и простым в аппаратурном оформлении, широко применяемым методом в практике заводских аналитических лабораторий для анализа продуктов металлургического производства. Этот способ пригоден для всех типов химических реакций, но особенно часто используется для реакций окисления-восстановления.
Некомпенсационный способ - определяют силу тока, протекающего в цепи ячейки потенциометрического титрования, которая пропорциональна ЭДС ячейки. При не компенсационном потенциометрическом анализе ЭДС гальванического элемента определяется непосредственно чувствительным измерительным прибором (гальванометром), который включается в электрическую сеть последовательно с большим и точным измеренным сопротивлением.
Некомпенсационный способ потенциометрического титрования в различных вариантах применяют для массовых и экспресс- анализов с целью ускорения и упрощения методики потенциометрического титрования, т.е. там, где абсолютные значения потенциала индикаторного электрода не определяют.
Измерения проводят на потенциометрах, иономерах, рН-метрах
По данным потенциометрических измерений строят кривые титрования
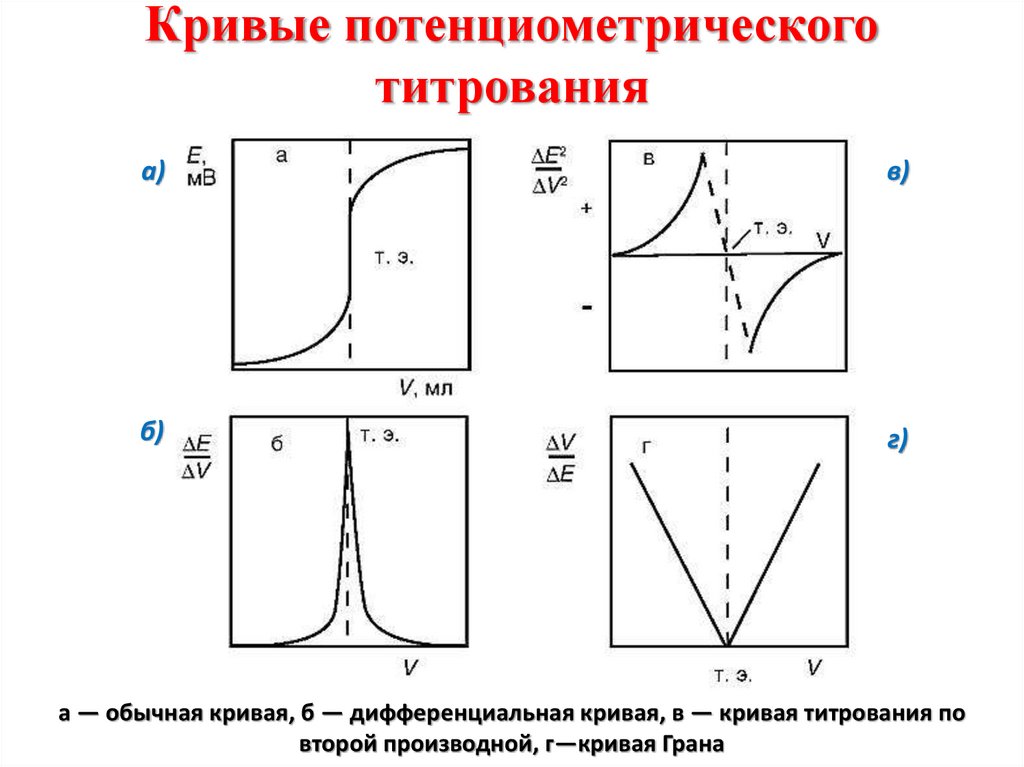
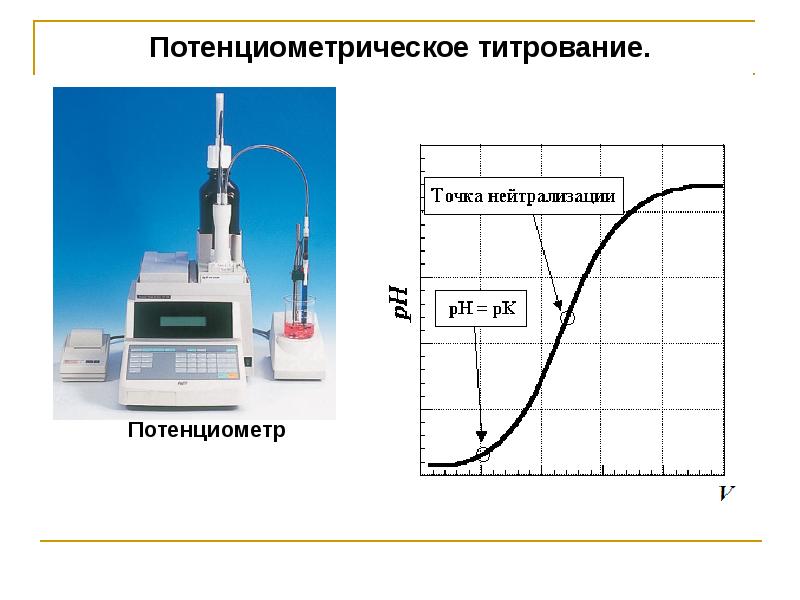

Рисунок 7-Потенциометрия