Для понимания фазовых диаграмм фундаментальное значение имеет правило фаз:
P+F=C+2
связывающее для любой точки фазовой диаграммы число сосуществующих фаз, число компонентов системы и число степеней свободы, к которым относятся переменные величины - температура, давление и состав. Для двухкомпонентной системы P + F = 4. При постоянном давлении число степеней свободы уменьшается на единицу. Тогда для одной фазы возможны не более двух степеней свободы. Таким образом, фазовая диаграмма может быть представлена в двух координатах. При наличии двух фаз F= 1, поэтому в двухфазной области варьировать можно только или температуру, или концентрацию.
В трехкомпонентной системе при постоянном давлении система имеет максимум 3 степени свободы, т.е. можно варьировать температуру и две концентрации. Чтобы представить фазовую диаграмму на плоскости, можно выбрать разную стратегию в зависимости от системы и задачи, а именно зафиксировать температуру или одну из концентраций, или отношение количеств двух компонентов. Обычно определяют фазовые равновесия при постоянной температуре, используя треугольники Гиббса. Здесь вершины представляют три чистых компонента, а боковые стороны треугольника - три двухкомпонентные системы. Внутри треугольника присутствуют все три компонента и их количества считываются, как указано на рисунке. Чтобы проиллюстрировать влияние температуры на фазовое поведение, представляют множество изотермических треугольников в виде треугольной призмы.
Две трехкомпонентные фазовые диаграммы показаны на рис. Первая из них - это фазовая диаграмма системы, состоящей из воды и смеси ионного ПАВ с одним гидрофобным радикалом и слабополярного дифильного спирта в воде. На фазовой диаграмме представлены шесть различных фаз: две фазы изотропных растворов, три жидкокристаллические фазы и твердое ПАВ. В бинарной смеси с водой данное ПАВ образует только мицеллярную и гексагональную фазы. Введение деканола вызывает фазовый переход с возникновением ламелярной фазы, а при более высоких концентрациях спирта формируются обращенные структуры: обращенные гексагональная и мицеллярная фазы. Кроме однофазных областей возникает большое число двухфазных и трехфазных областей, в которых сосуществуют различные фазы.

Фазовая диаграмма системы из трех компонентов А, В и С при постоянной температуре представлена треугольником Гиббса. Количество различных компонентов в точке P определяется расстоянием до противоположной стороны. Образец в точке P содержит 60% компонента А, 10% компонента В и 30% компонента С
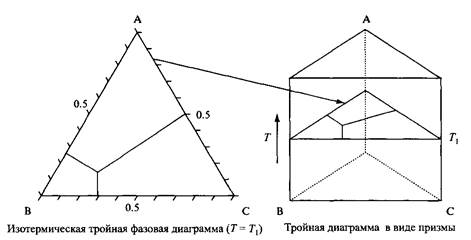
Трехмерное представление фазовой диаграммы тройной системы, отражающее влияние дополнительной степени свободы - температуры.

Фазовая диаграмма тройной системы, состоящей из октаноата натрия, деканола и воды при 25°С. Видно, что в системе образуются два изотропных раствора и три жидкокристаллических фазы.

Тройная фазовая диаграмма: система состоит из анионного ПАВ с двумя неполярными "хвостами", изооктана и воды. Фазовые равновесия определены при 25°С. Наблюдаются две фазы изотропных растворов: вода и обращенная мицеллярная фаза, а также три жидкокристаллические фазы
Тройная фазовая диаграмма выглядит совершенно по-другому. Здесь представлено ионное ПАВ с двумя гидрофобными радикалами, которое в смеси с водой дает протяженную ламелярную фазу, а также биконтинуальную кубическую фазу и обращенную гексагональную фазу. Растворимость этого ПАВ в воде очень мала. При добавлении масла происходит фазовый переход ламелярной фазы в обращенную гексагональную фазу и затем в обращенную мицеллярную фазу.
Последовательность образования фаз с изменением концентрации ПАВ или при добавлении менее полярного компонента обычно следует простому ряду, установленному Фонтеллем. В зависимости от системы, температуры и других факторов образуется меньшее или большее число фаз. Например, в случае ПАВ с одним "хвостом" обычно реализуются структуры от зеркальной плоскости влево, а в случае двухцепочечного ПАВ - вправо.
Фазовая диаграмма характерна для смеси катионного и анионного ПАВ. На этой диаграмме появляются новые особенности, а именно области стабильных дисперсий везикул. В таких системах для стехиометрических смесей наблюдается выпадение твердых кристаллов. Кроме того, имеются области ламелярных и везикулярных фаз, образующиеся при избытке одного из ПАВ.

Фазовая диаграмма в области малых концентраций смеси ПАВ: катионного и анионного в воде. С разрешения. Copyright American Association for the Advancement of Science
Влияние геометрии молекул ПАВ и их упаковки на структуру агрегата: концепции параметра упаковки и спонтанной кривизны пленки ПАВ
Общее правило: ПАВ с одной гидрофобной цепью образуют мицеллы и другие прямые структуры, в то время как ПАВ с двумя гидрофобными цепями преимущественно образуют ламелярные фазы и обращенные структуры. Это легко понять, если попытаться построить пространственные модели агрегатов ПАВ различной структуры. При этом обнаружится, что из-за большого объема гидрофобных "хвостов" молекулы с двумя цепями нельзя упаковать в сферические мицеллы. Величина v/ должна быть для сферической мицеллы не более 1/3. Если удвоить параметр н введением второй алкильной цепи, оставляя другие параметры постоянными, то предпочтительными оказываются другие геометрические формы. Критический параметр упаковки можно рассматривать по-другому, а именно как отношение площадей поперечного сечения углеводородной цепи и полярной группы.
Поскольку взаимосвязь химической структуры и структуры агрегатов намного сложнее, чем такой простой геометрический анализ, он приведен лишь в качестве иллюстрации и служит отправной точкой, в частности для анализа тенденций в фазовом поведении. Образующаяся структура - это результат баланса между полярными и неполярными частями молекулы ПАВ. Этим объясняется интерес к шкалам гидрофильно-липофильного баланса. Эти шкалы являются удобными классификациями
ПАВ, полезными, кроме прочего, при подборе ПАВ для различных практических применений, но они не позволяют провести более глубокий анализ или достичь прогресса в понимании фазового поведения. Более новые подходы к проблеме основаны на концепциях упаковки молекул ПАВ и спонтанной кривизны пленки ПАВ.
Определение критического параметра упаковки или числа ПАВ, поясняется на рис. Анализ многочисленных геометрических форм агрегатов, подобный проведенному выше для сфер, привел к нескольким простым правилам, которые иллюстрирует рис.
В простой геометрической модели не учитываются два важных фактора, оказывающих большое влияние на структуру агрегата. Прежде всего это взаимодействие полярных групп в агрегате. Ясно, что сильное отталкивание между полярными головками ПАВ будет приводить к сдвигу агрегатов влево в схеме Фонтелля, тогда как сдвиг в противоположную сторону требует действия сил притяжения. Проблему можно преодолеть, оценивая "эффективную" площадь полярной группы. Так, для ионного ПАВ на взаимодействие полярных групп сильное влияние оказывает концентрация электролита, так что величина а уменьшается при добавлении электролита. Расчет расстояния между полярными головками на основе электростатических взаимодействий позволяет оценить значение КПУ или числа ПАВ и для этого случая. На взаимодействие полярных групп неионных ПАВ сильнее влияет температура, а не электростатические взаимодействия. Изменение температуры оказывается главным фактором, определяющим структуру агрегата.
Отвечая на вопрос, какие именно ПАВ относятся к различным категориям, представленным на рис., что КПУ <1/3 и сферические мицеллы характерны для ПАВ с одной неполярной цепью и сильнополярной "головкой", например ионогенной группой в отсутствие электролита. Сюда же попадают неионогенные ПАВ с большими полярными группами. Значениям КПУ в интервале от 1/3 до 1/2 и стержнеобразным агрегатам соответствуют ионогенные одноцепочечные ПАВ в присутствии электролита или с прочно связанными противоионами, а также неионогенные ПАВ с полярными группами среднего размера. Более высокие значения КПУ характерны для ПАВ с двумя неполярными цепями или для неионогенных ПАВ с небольшими полярными группами. К этому же типу относится большинство мембранных липидов. В случае ионогенных ПАВ добавление электролита еще больше увеличивает значение КПУ, что может вызвать переход от бислойных структур к обращенным структурам.
Критический параметр упаковки или число ПАВ выражает соотношение площади полярной группы, длины вытянутой гидрофобной цепи и объема гидрофобной части молекулы безразмерным числом КПУ.

