Основные понятия физики полупроводников.
Волновая природа электрона. В настоящее время электроника имеет дело с двумя элементарными частицами-волнами – электроном и фотоном. Их волновые свойства проявляются в процессах интерференции и дифракции, наблюдаемых экспериментально. Свойства их как частиц проявляются в процессах взаимодействия с веществом (трек на фотоэмульсии, фотоэффект, эффект Комптона). Согласно гипотезе Де-Бройля электрону (и вообще любой частице) соответствует волна, для которой выполняются соотношения, установленные Эйнштейном для фотона:
 ,
,
где Е – полная (релятивистская) энергия электрона, р – его импульс, k и w - волновое число и частота волны.
Уравнение Шредингера. При волновом движении происходит периодическое ограниченное в пределах амплитуды волны перемещение вещества или периодическое изменение напряженности какого-нибудь поля. В случае электрона материальная природа волны не определена. Теоретически волновая природа электрона выражается в том, что его движение описывается волновым уравнением Шредингера. В стационарном случае оно записывается следующим образом:
 (1)
(1)
Здесь Е – полная энергия электрона, V – потенциальная энергия.
Квадрат модуля волновой функции при соответствующей нормировке равен вероятности нахождения электрона в рассматриваемой точке пространства (или вероятности реализации других динамических переменных, от которых может зависеть функция, например, момент импульса). На волновую функцию накладываются условия, следующие из ее физической природы. Она должна быть непрерывной, однозначной, непрерывной должна быть и ее первая производная. При этих условиях уравнение обычно имеет решение не при любых значениях энергии электрона Е, а только при ее определенных значениях. Точно также дискретными значениями могут обладать другие динамические переменные: импульс, момент импульса, проекции момента импульса.
Электрон помимо момента импульса, связанного с движением (аналогом вращения по орбите) обладает собственным моментом импульса – спином. Т.е. он проявляет свойство похожее на вращение твердого тела вокруг собственной оси.
Фундаментальные свойства электрона, связанные с его квантовой природой, проявляются в принципах запрета Паули и неопределенности Гейзенберга. Эти принципы не имеют классических аналогов.
Принцип Паули, или принцип запрета является фундаментальным законом природы, согласно которому две тождественные частицы с полуцелым спином (в единицах 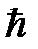 ) не могут одновременно находиться в одном состоянии.
) не могут одновременно находиться в одном состоянии.
Соотношение неопределённостей, или принцип неопределённости – фундаментальное положение квантовой теории, утверждающее, что у квантовой частицы некоторые ее динамические переменные, например, ее координаты и импульс, одновременно не могут принимать (быть измеренными) определённые, точные значения. Количественная формулировка принципа неопределенности может быть выражена следующим образом. Если D x — неопределённость значения координаты х, а Dp x — неопределённость проекции импульса на ось х, то произведение этих неопределённостей должно быть по порядку величины не меньше постоянной Планка, то есть
 (2)
(2)
Аналогичное соотношение выполняется для энергии частицы и временем жизни электрона в состоянии с данной энергией:

Строение атома. Во многих случаях возможно упрощенное описание поведения электронов на основе классических представлений. Одним из таких представлений является планетарная модель атома Резерфорда.
Планетарная модель схематически показана на рис.1. В центре расположено положительно заряженное ядро, отрицательно заряженные электроны вращаются вокруг ядра по круговым или эллипсоидальным орбитам. Заряды ядра и электронов по модулю одинаковы, поэтому атом электронейтрален. При поглощении электронами внешней энергии происходит перемещение электрона на более высокую орбиту (увеличивается число п), или, при энергии большей потенциала ионизации, разрываются валентные связи, и происходит ионизация атома. Этот процесс проиллюстрирован правым рисунком 1.
Как известно, планетарная модель противоречит законам электродинамики, согласно которым электрон, двигающийся с ускорением (в данном случае – центростремительным) должен излучать электромагнитные волны и терять энергию. Поэтому объяснение всех особенностей строения атома возможно только в рамках квантовой механики. Ниже будет дано объяснение числам п, т, s и l, представленным на рисунке.


Рис.1. Планетарная модель атома. На левом рисунке показаны квантовые числа, определяющие состояние электрона. На правом рисунке показан процесс ионизации.
Согласно выводам квантовой механики электрон, находящийся в потенциальной яме, создаваемой положительным зарядом ядра, может обладать только определенными дискретными значениями энергии. Это легко понять, вспомнив, что электрон обладает волновыми свойствами. При отражении электронной волны от потенциального барьера, создаваемого положительно заряженным ядром, она складывается с падающей волной, и образуется стоячая волна. Очевидно, стоячая волна может существовать, только если целое число полуволн укладывается на ширине потенциальной ямы. Поскольку энергия электрона однозначно связана с длиной его волны (1), отсюда следует ограничение, как на длину волны, так и на энергию.
Это явление проще всего описать в рамках модельной задачи поведения электрона в потенциальной яме с бесконечными стенками.
Рассмотрим движение частицы в потенциале, который определяется следующим образом:
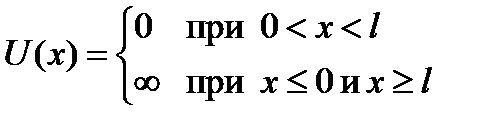 (1)
(1)
Такая конфигурация называется потенциальной ямой.
Для того чтобы определить поведение частицы в яме, необходимо записать уравнение Шредингера, подставив в него выражение для потенциальной энергии (1). Как видно, уравнение разбивается на три части: для двух областей вне ямы и внутри ее. Поскольку вне ямы частица находиться не может (потенциалы на границах бесконечные), ее волновая функция там равна 0. Из условия непрерывности она равна 0 и в точках x= 0, x=l.
Это требование служит граничным условием для решения уравнения Шредингера внутри ямы. В области 0 < x < l уравнение Шредингера для стационарных состояний (2.7) имеет вид (U (х) = 0):
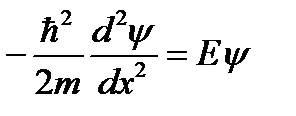 (3.2)
(3.2)
Его решением является функция:
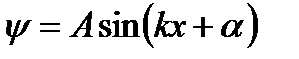 где
где  (3)
(3)
А и a - константы. А – амплитуда, которая может быть найдена из условия  , поскольку полная вероятность найти частицу где-нибудь в яме равна1.
, поскольку полная вероятность найти частицу где-нибудь в яме равна1.
Используем теперь граничные условия:  . Следствием первого условия будет a = 0. Второе условие дает
. Следствием первого условия будет a = 0. Второе условие дает
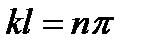 , (4)
, (4)
где n – любое целое число. Из этого, учитывая выражение для энергии (3) получаем возможные значения энергии:
 (5)
(5)
Таким образом, как было отмечено выше, условия, накладываемые на волновую функцию, приводят к появлению собственных значений параметра En (в данном случае - энергии) и собственных функций, соответствующих каждому собственному значению.
Обозначение электронной конфигурации атома. Дискретный набор энергий электронов, связанных с колебаниями в поле ядра в атоме нумеруют. Натуральное число n – номер, определяющий значение энергии, называется главным квантовым числом. Кроме этого, электрон вращается по орбите (в представлении классической модели). С этим движением связано определенное значение его момента импульса. Момент импульса электрона l также имеет дискретные значения.
 (3)
(3)
Дискретные значения принимает и проекция момента импульса mz на произвольную ось  . Число l называется азимутальным квантовым числом. Оно вместе с главным квантовым числом n определяет полную энергию электрона в атоме. Совокупность чисел п и l называют электронной оболочкой.
. Число l называется азимутальным квантовым числом. Оно вместе с главным квантовым числом n определяет полную энергию электрона в атоме. Совокупность чисел п и l называют электронной оболочкой.
Число m называется магнитным квантовым числом. Если внешнее магнитное поле отсутствует, энергия электрона с разными магнитными числами одна и та же. Независимость энергии от квантового числа называется вырождением.
Электрон обладает собственным моментом импульса (как волчок). Его значение определяется выражением  . В случае электрона спиновое число (или спин) принимает значения ± ½. Вращение электрона, т.е. существование у него спина, приводит к существованию у него магнитного момента.
. В случае электрона спиновое число (или спин) принимает значения ± ½. Вращение электрона, т.е. существование у него спина, приводит к существованию у него магнитного момента.
Согласно принципу запрета Паули в атоме нет электронов с одинаковым набором квантовых чисел.
Пример обозначения электронной конфигурации. Для обозначения электронной конфигурации атома записывают главное квантовое число, после него пишут значение орбитального квантового числа. Для того, чтобы не было путаницы значение орбитального числа записывают буквами, соответственно, начиная с нуля, s, p, d, f, g, h. Число электронов, находящихся на данной оболочке обозначают в виде степени.
Например, электронная конфигурация кремния записывается следующим образом:
1s22s22p63s23p2
Зонная энергетическая диаграмма твердого тела.
В твердом теле дискретные электронные уровни, характерные для изолированного атома расширяются и превращаются в энергетические зоны. В пределах такой зоны энергия электрона может изменяться непрерывно.
Для расчета зонной структуры твердого тела применяется два метода. Сущность метода сильной связи представлена на рис.2. При использовании этого метода предполагается известной энергетическая структура изолированного атома. Влияние соседних атомов рассматривается как возмущение и учитывается соответствующими методами квантовой механики. На рисунке в правой части диаграммы показана структура уровней изолированного атома натрия. Сближение атомов приводит к смещению положения уровня и его уширению, что. Учет влияния многих атомов приводит к показанной на рисунке картине. По мере уменьшения расстояния между атомами узкие уровни энергии начинают уширяться. В первую очередь это происходит с уровнем 3 р, наиболее удаленным от ядра, а затем с уровнем 3 s. При расстоянии равном постоянной решетки (расстоянию между атомами в кристалле) d уширение настолько велико, что зоны, в которые превратились атомные уровни, перекрываются. Уширение более близких к ядру уровней проявляется только при меньших расстояниях между атомами.
Важно отметить, что при сближении атомов волновые функции электронов для состояния 3 р соседних атомов перекрываются, т.е. электрон имеет возможность переходить от одного атома к другому. Таким образом, можно считать, что эти электроны обобществляются, т.е. становятся свободными. Этим обеспечивается высокая электрическая проводимость натрия (и металлов вообще).

рис. 2. Превращение уровней энергии атома натрия в энергетические зоны.
В случае неметалла происходит подобный процесс, но расстояние между атомами не обеспечивает перекрытия расширенных уровней (на рисунке условно показано это расстояние dд). Между ними остается энергетическая щель, которая называется запрещенной зоной. Поскольку в этом случае волновые функции электронов практически не перекрыты, электроны не имеют возможности перемещаться от атома к атому, и такое вещество является диэлектриком. Говорят, что в этом случае все электроны находятся в валентной зоне. Для того чтобы получить возможность перемещения, электрон должен преодолеть запрещенную зону и попасть в зону проводимости, в которой волновые функции электронов соседних атомов перекрываются.
Обычно энергию, необходимую для перехода из валентной зоны в зону проводимости, электрон получает за счет тепла. При этом если ширина запрещенной зоны большая, энергии теплового движения электронов будет недостаточно для перехода, и такое вещество (при комнатной температуре) является диэлектриком. Если же ширина запрещенной зоны такова, что заметная часть электронов имеет возможность перейти в зону проводимости, такое вещество называют полупроводником.
Второй метод расчета – метод слабой связи – менее нагляден, но более прост в осуществлении. Рассмотрим его на примере модели Кронига-Пенни. Реальный периодический потенциал сложной формы в этой модели заменяется набором прямоугольных потенциальных ям одинакового размера, расположенных на одинаковом расстоянии друг от друга. Вид потенциала показан на рис.3.
Уравнение Шредингера (1.3) для рассматриваемого здесь одномерного случая можно записать следующим образом:
 . (1.90).
. (1.90).
Волновая функция для свободного электрона представляет плоскую волну, пространственная часть которой в стационарном случае имеет вид  . При движении в периодическом потенциальном поле следует учесть два обстоятельства. Первое – связь модуля волнового вектора k с энергией Е не выражается здесь простой формулой(1.44), или (1.61), которую мы рассматривали выше (
. При движении в периодическом потенциальном поле следует учесть два обстоятельства. Первое – связь модуля волнового вектора k с энергией Е не выражается здесь простой формулой(1.44), или (1.61), которую мы рассматривали выше ( ), а должна быть определена из решения задачи, поскольку движение электрона не свободно. Второе – естественно предположить, что амплитуда плоской волны С периодически изменяется в пространстве с периодом равным периоду структуры,. Такой вид волновой функции электрона называется функцией Блоха.
), а должна быть определена из решения задачи, поскольку движение электрона не свободно. Второе – естественно предположить, что амплитуда плоской волны С периодически изменяется в пространстве с периодом равным периоду структуры,. Такой вид волновой функции электрона называется функцией Блоха.
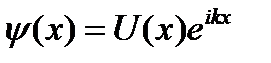 . (1.91)
. (1.91)
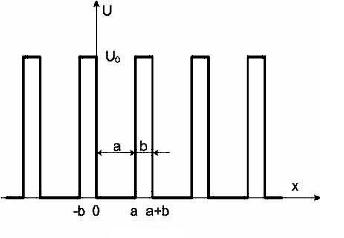
Рис.3. Вид потенциала Кронига-Пенни.
Подставляя волновую функцию (1.91) в уравнение Шредингера (1.90), получим два уравнения – для области ямы и для области барьера:
 (1.92)
(1.92)
Введем обозначения:
 (1.93)
(1.93)
и запишем решение уравнений (1.92) в общем виде:
 (1.94)
(1.94)
Теперь необходимо записать условия непрерывности для функции U 1,2 (х) и ее производной U’ 1,2(x) в точках разрыва потенциала, т.е. в точках x = a и x = a+b. В результате получится линейная система четырех уравнений, из которой можно определить коэффициенты A 1,2, и B 1,2. Условием существования нетривиального решения однородной системы (в которой все правые части уравнений равны нулю) является равенство нулю главного определителя системы, что приводит к уравнению
 . (1.95)
. (1.95)
Полученное уравнение связывает энергию электрона Е, которая входит в выражения для a и b, с его волновым вектором k. (Уравнение, связывающее энергию волны с ее волновым вектором называется дисперсионным).

Рис. 4. Зависимость функции правой части уравнения () от параметра Е. (Значения всех параметров произвольны и взяты из соображений наглядности)
 Слева в формуле (1.95) стоит косинус, который не может быть больше единицы. Вид функции, стоящей в правой части уравнения (), показан на рис.4. При некоторых значениях аргумента (энергии Е) значения функции y(E), стоящей в правой части уравнения (1.95) превышают единицу, и значит при этих значениях аргумента решение уравнения (1.95) отсутствует. Разрешенными оказываются только те значения аргумента Е, при которых функция меньше единицы. Этот пример наглядно демонстрирует образование разрешенных и запрещенных зон энергии при движении электрона в периодическом поле.
Слева в формуле (1.95) стоит косинус, который не может быть больше единицы. Вид функции, стоящей в правой части уравнения (), показан на рис.4. При некоторых значениях аргумента (энергии Е) значения функции y(E), стоящей в правой части уравнения (1.95) превышают единицу, и значит при этих значениях аргумента решение уравнения (1.95) отсутствует. Разрешенными оказываются только те значения аргумента Е, при которых функция меньше единицы. Этот пример наглядно демонстрирует образование разрешенных и запрещенных зон энергии при движении электрона в периодическом поле.