Механизм действия стабилизаторов сводится созданию определенного значения рН среды и предупреждению окислительно-восстановительных процессов. Определенное значение рН среды создается буферными растворами, кислотами и щелочами.
При рассмотрении вопросов стабилизации растворов для инъекций лекарственные вещества ориентировочно можно разделить на три группы:
1. Растворы солей, образованные слабыми основаниями и сильными кислотами.
2. Растворы солей, образованные сильными основаниями и слабыми кислотами.
3. Растворы легкоокисляющихся веществ
Стабилизация растворов солей, образованных слабыми основаниями и сильными кислотами. К этой группе относятся соли алкалоидов и синтетических азотистых оснований (атропина сульфат, скополаминагидробромид, гоматропина гидробромид, пилокарпина гидрохлорид, новокаин, стрихнина нитрат, дикаин, дибазол и др.).
Соль ВА полностью диссоциирует на ионы В+ и А- с образованием слабодиссоциирующего основания и сильно диссоциированной кислоты. Ионы гидроксила, образующиеся при диссоциации воды, связываются в малодиссоциируемое основание ВОН. В результате в растворе накапливаются свободные ионы Н+, что приводит к понижению рН.
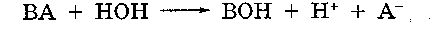
Прибавление к этим растворам свободной кислоты, то есть избытка водородных ионов, подавляет гидролиз, вызывая сдвиг равновесия влево. Для устойчивости солей алкалоидов и других выше указанных веществ растворы должны иметь определенный рН, т.к. нагревание растворов повышает интенсивность гидролиза солей и увеличивает степень диссоциации, что приводит к сдвигу равновесия вправо.
В качестве стабилизатора, подавляющего процесс гидролиза солей и омыления сложных эфиров, рекомендуется добавлять кислоту хлористоводородную. Количество кислоты хлористоводородной, необходимое для стабилизации раствора, зависит от свойств лекарственного средства. Норма расхода, если нет иных указаний - 10 мл 0,1М раствора кислоты хлористоводородной на 1л.
Для стабилизации растворов солей сильных оснований и слабых кислот рекомендуется добавлятьстабилизаторы основного характера - 0,1М раствор натрия гидроксида или натрия гидрокарбонат. В водном растворе соль КА почти полностью диссоциируетна ионы К и А. Диссоциируют на ионы и молекулы воды Н и ОН
КА + НОН = К + ОН + НА (слабодиссоциированная кислота, что влечет за собой уменьшение ионов водорода и накоплению избытка ионов ОН, в результате чего рН раствора увеличивается). Так как гидролитические процессы усиливаются в кислой среде, то для подавления гидролиза необходимо создавать слабощелочную среду.
Так, например, для стабилизации 1л 10 и 20 % -ных растворов кофеина-бензоата натрия рекомендуется добавлять 4 мл 0,1М раствора натрия гидроксида.
Стабилизация растворов легкоокисляющихся веществ. К данной группе относятся: кислота аскорбиновая, викасол, натрия салицилат, стрептоцид растворимый, сульфацил-натрий, тиамина хлорид, этилморфина гидрохлорид, адреналина гидротартрат, аминазин, новокаинамид и некоторые другие лекарственные вещества. Во время изготовления растворов и, особенно при стерилизации, в присутствии кислорода, содержащегося в воде и в воздушном пространстве флакона (над раствором), указанные вещества легко окисляются с образованием физиологически не активных продуктов окисления. Процесс окисления значительно усиливается под влиянием так называемых сенсибилизирующих факторов (от лат. Sensibilis - чувствительность), таких, как свет, тепло, значение рН и др.
В основе механизма окисления легкоокисляющихся веществ лежит перекисная теория Баха – Энглера и теория разветвленных цепных реакций Семенова. В фармацевтической практике существуют различные методы замедления процессов окисления. Например, добавлением антиоксидантов. Антиоксиданты - это вспомогательные вещества, препятствующие окислению. Их можно разделить на прямые и косвенные.
К прямым антиоксидантам относятся сильные восстановители, обладающие более высокой способностью к окислению, чем стабилизируемые ими лекарственные вещества: ронгалит, натрия сульфит, натрия метабисульфит, кислота аскорбиновая, тиомочевина, цистеин, метионин и др.
Механизм стабилизации заключается в том, что антиоксиданты легче окисляются, чем действующие вещества, и кислород, растворенный в инъекционном растворе, расходуется на окисление стабилизатора, тем самым защищая препарат от окисления.
К косвенным антиоксидантам относятся вещества, которые связывают в практически недиссоциируемые соединения катионы металлов (Cu2+, Fe3+, Mn2+ и др.), попадающие в растворы лекарственных веществ как примеси из лекарственных веществ и являющиеся катализаторами окислительных процессов.
Косвенные антиоксиданты являются комплексообразователями. К ним относятся: многоосновные карбоновые кислоты, оксикислоты (лимонная, салициловая, виннокаменная и др.), динатриевая соль этилендиаминтетрауксусной кислоты (трилон Б) и кальциевая соль трилона Б (тетацин), унитиол, а также аминокислоты, тиомочевина и др.
Окисление лекарственных веществ может быть уменьшено также за счет устранения сенсибилизирующего действия света, температуры. Некоторые растворы хранят в упаковке из светозащитного стекла.
Таким образом, для стабилизации окисляющихся соединений необходимо создать оптимальные значения рН растворов, исключить влияние: кислорода на лекарственные вещества, катализаторов в процессе изготовления, стерилизации и хранения лекарственного препарата.