Тема: Статистическая физика
Распределение Максвелла
Исходные данные:
1. Имеется большое, но конечное число молекул;
2. Скорости молекул различны 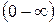 ;
;
3. Движения молекул независимы друг от друга и молекулы обладают случайными энергиями.
Движение молекул газа подчиняется законам статистической физики. В среднем скорости и энергии всех молекул одинаковы. Однако в каждый момент времени энергии и скорости отдельных молекул могут значительно отличаться от среднего значения.
Теория вероятностей позволяет определить долю молекул 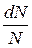 , скорости которых заключены в интервале
, скорости которых заключены в интервале 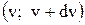
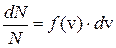 – функция распределения (1)
– функция распределения (1)
где 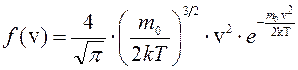 , (2)
, (2)
обозначения:
N – общее число молекул газа,
dN – число молекул, скорости которых заключены в определенном интервале,
v – нижняя граница интервала скоростей,
dv – величина интервала скоростей,
k = 1,38*10–23 Дж/К – постоянная Больцмана,
е=2,718…
m0 – масса молекулы.
Закон распределения Максвелла запишется в следующем виде:
 (3)
(3)
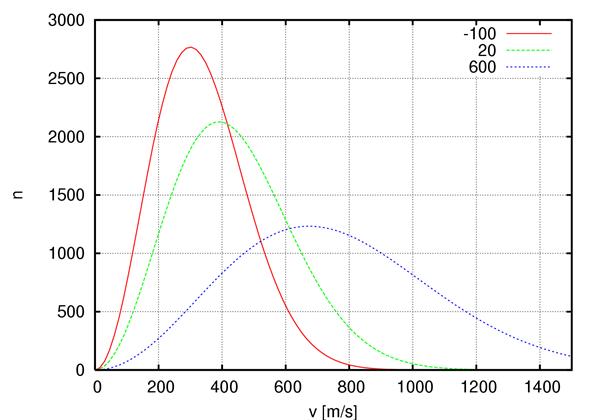
График функции распределения f(v)
f(v)
Площадь функции f(v) в интервале скоростей численно равна доле молекул, скорости которых заключены в интервале скоростей 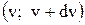 . Площадь функции f(v) по всему интервалу скоростей всегда равна 1.
. Площадь функции f(v) по всему интервалу скоростей всегда равна 1.
Из графика видно, что с ростом температуры газа пик функции смещается вправо и становится меньше.
Распределение Максвелла справедливо для частиц:
– не находящихся в силовом поле
– движения частиц- независимые
– подчиняются законам статистической механики.
Средняя (арифметическая) скорость движения молекул
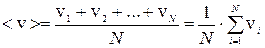 (4)
(4)
Из распределения Максвелла можно вычислить среднюю скорость молекул:
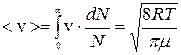 ; (5)
; (5)
где μ – молярная масса газа.
Из формулы видно, что средняя арифметическая скорость зависит:
– от температуры (растет с ростом температуры);
– от молярной массы газа. Для смеси газа средние скорости различных молекул газа могут различаться.
Средняя арифметическая скорость используется в формулах, где берется скорость в первой степени, например для вычисления среднего импульса молекулы.
Наиболее вероятная скорость молекул
Максимум функции f(v) означает, что наибольшее число молекул обладают скоростью vв – наиболее вероятная скорость. Наиболее вероятную скорость находят из условия, что для максимума функции в данной точке производная должна быть равна нулю:
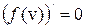
Расчеты дают следующее выражение:
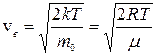 (6)
(6)
Вывод:
– с ростом температуры увеличивается и наиболее вероятная скорость,
– с увеличением молярной массы наиболее вероятная скорость уменьшается,
– с ростом температуры максимум кривой распределения смещается вправо, в сторону больших скоростей, т.е. уменьшается доля молекул, обладающих малыми скоростями и увеличивается доля молекул, обладающих большими скоростями.
Средняя квадратичная скорость движения молекул
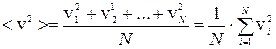 – квадрат среднеквадратичкой скорости
– квадрат среднеквадратичкой скорости
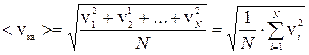
Из распределения Максвелла вычисляют среднюю квадратичную скорость молекул:
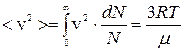
Тогда средняя квадратичная скорость будет равна:
 (7)
(7)
Из формулы (7) видно, что средняя квадратичная скорость также зависит от температуры и молярной массы газа.
Средняя квадратичная скорость молекул используется в расчетах, где берется скорость в квадрате (при определении давления газа, энергии движения молекул, вычисления абсолютной температуры).
Из формул (5, 6, 7) видно, что все три скорости близки по значениям, но несколько разнятся. Между ними выполняется неравенство:
