Вопрос 5. Метода получения пептидов
Аминокислоты – гетерофункциональные соединения, содержащие
карбоксильную и аминогруппы. По взаимному расположению функциональных групп
различают a -,b -, g — и т.д. аминокислоты.
Аминокислоты, содержащие аминогруппу на конце цепи, называют w-аминокислотами.

Методы получения
!) Аммонолиз галогензамещенных кислот.

Метод используется для синтеза a -аминокислот из доступных a -галогензамещенных кислот.
2) Метод Штеккера- Зелинского
Включает стадии образования аминонитрила при
взаимодействии альдегида с HCN и NH3 c последующим гидролизом его в аминокислоту. В качестве
реагента применяют смесь NaCN и NH4Cl.
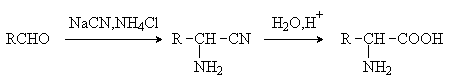
Метод применим для синтеза только a -аминокислот.
3) Восстановительное аминирование
оксокислот

4) Присоединение аммиака к a,b -непредельным карбоновым кислотам.
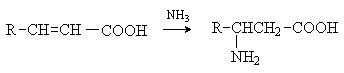
Метод применим для синтеза b -аминокислот.
5) Из оксимов циклических кетонов
перегруппировкой Бекмана.

Метод используется для синтеза w -аминокислот.
Вопрос 6. Чем определяется суммарный заряд молекул белков
Влияние аминокислотного состава белковой молекулы на ее заряд (при условии нейтральной среды, рН=7):
– если в белковой молекуле преобладают кислые аминокислоты (аспарагиновая и глутаминовая кислоты), то суммарный заряд белковой молекулы будет отрицательным (в нейтральной среде);
– если в белковой молекуле преобладают основные аминокислоты (лизин, аргинин, гистидин), то суммарный заряд белковой молекулы будет положительным (в нейтральной среде).
Слабая диссоциация SH-групп цистеина и фенольной (С6Н5–ОН) группы тирозина (это слабые кислоты) почти не влияет на амфотерность белков.
Чем больше в белке кислых аминокислот, тем больше величина отрицательного заряда (большинство природных белков кислого характера).
Чем больше в белке основных аминокислот, тем больше величина положительного заряда.
Например, молекула альбумина (анионогенный белок) содержит в полипептидной цепи много дикарбоновых аминокислот и, следовательно, имеет отрицательный заряд. В крови, которая имеет рН 7,4, отрицательный заряд альбумина равен 18. Другой пример – гистоны, входящие в состав хроматина ядра клетки, содержат много аргинина и лизина, следовательно, гистоны – это катионогенные белки.
Вопрос 7
Понятие об изоэлектрической точке
Белки состоят из аминокислот. Некоторые из этих соединений (аргинин, аспарагиновая кислота, гистидин, глутаминовая кислота, лизин) представлены в виде радикалов, содержащих ионогенные группы, то есть такие группы, которые способны к ионизации. Помимо них к ионизации способны альфа-карбоксильная и аминогруппы, расположенные на углеродном и азотном концах полипептидных цепей. Если рН раствора равен 7 или приближен к данной отметке, то в ионизированном состоянии находятся все ионогенные группы. По мере удаления от данного значения рН в ту или иную сторону, причем преимущественно в кислую, белок начинает переход в изоэлектрическое состояние, при котором молекула данного вещества становится электронейтральной, число ионизированных групп стремится к нулю. Величина рН, при которой белки переходят в изоэлектрическое состояние, называется изоэлектрической точкой белков (ИЭТ).
Для определения изоэлектрической точки (рI) белка используют метод изоэлектрического фокусирования. Градиент рН устанавливают с помощью смеси низкомолекулярных органических кислот и оснований.
| Белок | рI |
| Пепсин | 1,0 |
| Яичный альбумин | 4,6 |
| Сывороточный альбумин | 4,9 |
| Уреаза | 5,0 |
| b-Лактоглобулин | 5,2 |
| Гемоглобин | 6,8 |
| Миоглобин | 7,0 |
| Химотрипсиноген | 9,5 |
| Цитохром С | 10,7 |
| Лизоцин | 11,0 |
Вопрос 8
К свойствам пептидной связи относятся:
1. Копланарность - Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи.

2.Транс-положение заместителей - Радикалы аминокислот по отношению к оси пептидной C—N -связи находятся по "разные" стороны, в транс-положении.
