По способу организации процесса адсорбции аппараты могут быть разделены на 2 группы: адсорберы периодического и непрерывного действия. Если адсорбент находится в аппарате в неподвижном состоянии, то после достижения определенной (заданной) степени насыщения его необходимо заменить или регенерировать (десорбировать). На время замены или регенерации процесс адсорбции прерывается. В аппаратах с подвижным адсорбентом можно организовать постоянную замену его части в одном адсорбере, не прекращая подачу загрязненных газов.
Принципиальные схемы адсорбционных процессов показаны на рис. 23. При применении зернистого адсорбента используют схемы с неподвижным (рис. 23, а) и с движущимся адсорбентом (рис. 23, б). В первом случае процесс проводят периодически. Вначале через адсорбент L пропускают парогазовую смесь G и насыщают его поглощаемым веществом после этого пропускают вытесняющее вещества В или нагревают адсорбент, осуществляя таким образом десорбцию (регенерацию адсорбента). Во втором случае (рис. 23, б) адсорбент L циркулирует в замкнутой системе, насыщение его происходит в верхней - адсорбционной - зоне аппарата, а его регенерация в нижней - десорбционной. При применении пылевидного адсорбента, используют схему с циркулирующим псевдоожиженным адсорбентом (рис. 23, в).
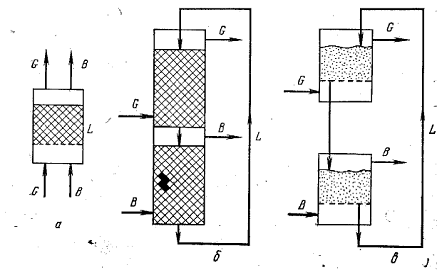
Рис. 23. Схемы адсорбционных установок.
Эффективность работы адсорбционной установки в первую очередь зависит от соответствия способа организации процесса, физико-химических характеристик обрабатываемых газов и адсорбента. По расходу, температуре, влажности, давлению отбросных газов, концентрации загрязнителя и его свойствам подбираются вид адсорбента, конструкция аппарата (с подвижным или неподвижным слоем и т.д.), вид адсорбции (физическая или химическая), режимы обработки (периодическая или непрерывная).
Адсорберы периодического действия используют в тех случаях, если обрабатывают достаточно большое количество газа или если газ содержит значительные концентрации сорбата, что делает выгодным регенерацию сорбента, а также, если стоимость свежего сорбента превышает стоимость регенерации.
Теория адсорбции
Способность поверхностных частиц (ионов, атомов или молекул) конденсированных тел притягивать и удерживать молекулы газа обусловлена избытком энергии на поверхности (по сравнению со средней энергией частиц
в объеме тела) и присуща всем твердым веществам и жидкостям. На практике в качестве адсорбентов выгодно использовать вещества с развитой удельной (на единицу объема) поверхностью.
Количество адсорбата, удерживаемое на единичной площади поверхности раздела фаз, в конечном счете определяется силой взаимодействия между молекулами адсорбируемого вещества и частицами, находящимися в приповерхностных слоях адсорбента.
Благодаря постоянным колебаниям центров зарядов (электронных оболочек и ядер) атомов около среднего положения непрерывно возникают и исчезают дипольные, квадрупольные, высшие мультипольные моменты. Они создают в пространстве вокруг атомов пульсирующие электрические поля, характеристики которых могут быть вычислены в простейших случаях по уравнениям квантовой механики. Силы, возникающие при взаимодействии квантовых электрических полей частиц, участвующих в процессе адсорбции, называют Ван-дер-ваальсовыми или дисперсионными силами. Дисперсионные силы действуют на границе раздела фаз и аналогичны силам взаимодействия между молекулами в объеме газа (силам межмолекулярного
взаимодействия), обуславливающим отклонение характеристик реальных газов от идеальных. Согласно квантовомеханическим расчетам, силы Ван-дер-Ваальса резко убывают с увеличением расстояния между центрами зарядов взаимодействующих частиц (обратно пропорциональны 6-й степени расстояния) и на несколько порядков слабее обменных сил, создающих химическую связь. Однако, в отличие от объемных сил, дисперсионные могут действовать на относительно больших расстояниях (превышающих размеры молекул) и характеризуются ненасыщаемостью. Поле, создаваемое мгновенными дипольными моментами одной молекулы, может взаимодействовать с полями многих других молекул.
Принимается, что при дисперсионных взаимодействиях обобществления электронов не происходит, и химическая связь не образуется. Одну из двух граничных моделей адсорбции, предполагающую, что при удержании молекул газа на поверхности адсорбента не происходит электронного обмена и образования химической связи, называют физической адсорбцией или зачастую просто адсорбцией.
В теоретических расчетах учитывают кроме дисперсионного притяжения силу отталкивания зарядов, принимая ее обратно пропорциональной 12-й степени расстояния между центрами зарядов. Если взаимодействующие частицы имеют постоянные дипольные моменты (например, молекулы воды или ионные поверхности) или свободные электроны (металлические поверхности), то между ними возникают и классические электростатические силы. Точный теоретический расчет их величины невозможен, хотя на практике они вносят существенный вклад в силу взаимодействия, а иногда и определяют характер процесса адсорбции. Так, например, гораздо более широкое применение в производственных условиях активированных углей по сравнению с синтетическими полярными адсорбентами - силикагелями, цеолитами, объясняется тем, что угли ввиду неполярности поверхностных частиц одинаково взаимодействуют как с полярными, так и с неполярными молекулами газовой фазы. Молекулы воды, обладая постоянным дипольным моментом, взаимно притягивают друг друга в паровой фазе, вследствие чего диффундируют к поверхности угля хуже неполярных молекул. Поэтому активированный уголь достаточно эффективно извлекает загрязнители из влажных газов, в то время как полярные адсорбенты способы извлекать из них лишь воду.
Результаты теоретических расчетов характеристик физической сорбции имеют низкую сходимость с опытными данными и пригодны только для качественной оценки процессов.
По другой модели адсорбции предполагается образование на поверхности химической связи между молекулой газа и частицей адсорбента. Такую модель называют химической сорбцией или хемосорбцией.
Энергия взаимодействия в процессе хемосорбции близка (но не равна) энергии химической связи молекулы, состоящей из соответствующих элементов. Для теоретических расчетов энергии процесса хемосорбции используют уравнение Шредингера. Его строгое и точное решение получено лишь для случая взаимодействия одного протона и одного электрона. Теоретические методы расчетов более сложных систем весьма громоздки, а их результаты плохо совпадают с опытными данными, вследствие чего непригодны для практического использования при проектировании адсорбционных устройств.
Адсорбенты
Технико-экономические показатели процесса адсорбционной обработки отбросных газов во многом зависят от свойств адсорбентов, требования к которым формировались стремлением всемерно снизить энергетические и материальные затраты на очистку.
Адсорбент - твердое тело, на поверхности и в порах которого происходит адсорбция. Адсорбенты отличаются высокой пористостью, имеют большую удельную поверхность. Так, у наиболее распространенных адсорбентов она может достигать 1000 м2/г.
Промышленные адсорбенты изготавливают из твердых пористых материалов и используют в дробленном, гранулированном или порошкообразном виде.
Адсорбент должен иметь высокую сорбционную емкость, т.е. возможность поглощать большое количество адсорбтива при его малой концентрации в газовой среде, что зависит от удельной площади поверхности и физико-химических свойств поверхностных частиц. Адсорбционная емкость адсорбента зависит от его природы. Она возрастает с увеличением поверхности, пористости, со снижением размеров пор адсорбента, а также с повышением концентрации адсорбтива в газе-носителе и давления в системе. С увеличением температуры и влажности адсорбционная емкость адсорбентов снижается. Хорошие адсорбенты выдерживают несколько сотен и тысяч циклов «адсорбция-десорбция» без существенной потери активности.
Адсорбент должен иметь высокую селективность (избирательность) в отношении адсорбируемого компонента. Он должен обладать достаточной механической прочностью. Чтобы аэродинамическое сопротивление слоя было невысоким, плотность адсорбента должна быть небольшой, а форма частиц обтекаемой и создавать высокую порозность насыпки. Адсорбент для процесса физической сорбции должен быть химически инертным по отношению к компонентам очищаемой газовой среды, а для химической сорбции (хемосорбции) - вступать с молекулами загрязнителей в химическую реакцию. Для снижения затрат на десорбцию уловленных компонентов удерживающая способность адсорбента не должна быть слишком высокой, т.е. он должен иметь способность к регенерации. Адсорбенты должны иметь невысокую стоимость и изготавливаться из доступных материалов.
Поры в твердых телах классифицируются на: макропоры с радиусом более 1000…2000°А; переходные (мезопоры) с радиусом от 15 до 1000°А; микропоры с радиусом до 15°А.
Макропоры с размерами пор более 1000…2000°А являются транспортными каналами для подвода адсорбируемых молекул к мезопорам и микропорам. В макропорах и мезопорах наблюдается послойный механизм адсорбции, в микропорах, размер которых соизмерим с размерами адсорбируемых молекул, адсорбция носит характер объемного заполнения. Поэтому для микропористых адсорбентов объем пор, а не поверхность адсорбента играет решающее значение в адсорбции.
Адсорбент с крупными порами лучше адсорбирует вещества с большими размерами молекул и при больших давлениях. Среднепористый адсорбент эффективнее адсорбирует при средних давлениях, а мелкопористый – при низких давлениях.
Удельный объем микропор в адсорбентах достигает 0,2…0,6 смЗ/г, а удельная поверхность - до 500 м2/г и более. Поэтому микропоры играют основную роль при разделении газовых смесей, особенно при очистке газов от малых концентраций примесей.
При прочих равных условиях количество адсорбируемого вещества (адсорбата) будет возрастать по мере увеличения адсорбирующей поверхности.Сильно развитую поверхность имеют вещества с очень высокой пористостью, губчатой структурой или в состоянии тончайшего измельчения. Изпрактически используемых адсорбирующих веществ (адсорбентов) ведущееместо принадлежит различным видам изготавливаемых активированных углей (древесный, костяной и др.), поверхность которых может превышать1000 м2/г. Хорошими адсорбентами являются также гель кремниевой кислоты (силикагель), глинозем, каолин, некоторые алюмосиликаты (алюмогели),цеолиты и другие вещества. Эти вещества отличаются друг от друга природой материала и, как следствие, своими адсорбционными свойствами, размерами гранул, плотностью и др.
Различают истинную, кажущуюся и насыпную плотность адсорбента. Истинная плотность - масса единицы объема плотного адсорбента (т. е. без
учета пор). Кажущаяся плотность — масса единицы объема пористого материала адсорбента. Под насыпной плотностью понимают массу единицы объема слоя адсорбента, включая объем пор в гранулах адсорбента и промежутков между гранулами адсорбента.
Активированный уголь - пористый углеродный адсорбент. Применяют несколько марок активированного угля, различающихся размером микропор. Активированный уголь соответствующей марки используют для адсорбции различных компонентов (газов, летучих растворителей и др.), обладающих различными свойствами. Размер гранул активированного угля 1,0…6,0 мм, насыпная плотность 380…600 кг/м3.
Силикагель - синтетический минеральный адсорбент. Силикагели представляют собой гидратированные аморфные кремнеземы (AliO 2∙ nH 2 O). Удельная поверхность силикагеля составляет 400…770 м2/кг. Силикагель применяется главным образом для поглощения влаги. Он способен удерживать до 50 % влаги к массе адсорбента. Его преимущество по сравнению с активированным углем — негорючесть, низкая температура регенерации (100…200°С), низкая себестоимость при массовом производстве, относительно высокая механическая прочность. Промышленность выпускает ряд марок силикагеля, отличающихся формой и размерами зерен (0,2…7,0 мм - кусковые и гранулированные), насыпная плотность 400…900 кг/м3. Силикагель обладает высокой адсорбционной емкостью. Его используют часто для осушения газа и поглощения паров, например, метилового спирта из газового потока. Требования, предъявляемые к адсорбентам, часто противоречивы и иногда трудновыполнимы. К последним относится и необходимость работы с влажными газами. Для большинства современных, адсорбентов требуется предварительная осушка подаваемых на очистку газовых выбросов.
Алюмогель - активная окись алюминия. Алюмогель (Al 2 O 3∙ nH 2 O) получают прокаливанием гидроксидов алюминия. Удельная поверхность алюмогелей составляет 170…220 м2/кг, суммарный объем пор 0,6…1,0 см3/г. Алюмогели стойки к воздействию капельной влаги. Гидрофильный адсорбент с развитой пористой структурой. Используется, как и силикагель, для осушки газов и поглощения из них ряда полярных органических веществ. Благодаря своим положительным свойствам (доступность, стойкость к воздействию жидкостей и др.) широко применяется. Выпускается в виде гранул цилиндрической формы диаметром 2,5…5 мм, высотой 3…7 мм, насыпная плотность 500…700 мм, и шаровой формы - радиус 3…4 мм, насыпная плотность 600…900 кг/м3.
Цеолиты - алюмосиликаты, содержащие оксиды щелочных и щелочноземельных металлов. Характеризуются регулярной структурой пор, размеры которых соизмеримы с размерами молекул. Этот адсорбент называют «молекулярные сита» за их способность разделять вещества на молекулярном уровне благодаря структуре и размерам своих пор. Цеолиты адсорбируют газы, молекулы которых соответствуют размерам "окон" в кристаллической решетке. Так, цеолит NaA сорбирует газы с размером молекул не более 4 нм - метан, этан, аммиак, сероводород, сероуглерод, оксид углерода и др. Цеолит СаА сорбирует углероводороды нормального строения и не сорбирует изомеры. Цеолиты СаХ и NaX могут сорбировать ароматические, сероорганические, нитроорганические, галогензамещенные углеводороды. Однако из влажных потоков цеолиты извлекают только пары воды. Цеолиты обладают также высокой селективностью. Цеолиты выпускаются в виде гранул цилиндрической и шаровой формы. Размер гранул шарообразных d = 4 мм, цилин-дрических 4 мм, насыпная плотность 600…900 кг/м3.
Иониты – высокомолекулярные соединения природного и искусственного происхождения. Не нашли пока широкого применения для очистки отходящих газов.
Единственным адсорбентом, удовлетворительно работающим во влажных средах, является активированный уголь. Он удовлетворяет и большинству других требований, в связи с чем широко применяется. Одним из основных недостатков активированного угля является химическая нестойкость к кислороду, особенно при повышенных температурах.
Остальные адсорбенты проявляют, как правило, селективность к улавливанию загрязнителей. Так, оксиды алюминия (алюмогели) используются для улавливания фтора и фтористого водорода, полярных органических веществ, силикат кальция - для улавливания паров жирных кислот, силикагель - для полярных органических веществ, сухих газовых смесей. Большинство полярных адсорбентов можно использовать для осушки газов.
Для процессов хемосорбции используется импрегнирование некоторых из приведенных сорбентов. Импрегнирующие (пропитывающие) вещества могут действовать двояко: вступать в реакции с определенными загрязнителями или катализировать реакции, ведущие к их обезвреживанию - распаду, окислению и т.д. Так, при взаимодействии активированного угля, обработанного тяжелыми галогенами (бромом, йодом), с метаном или этаном, образуются тяжелые галогензамещенные углеводороды, которые затем легко адсорбируются. Алюмосиликаты, пропитанные оксидами железа, при температуре разложения галогенорганических соединений способствуют реакции хлора с оксидом металла. Образовавшиеся парообразные хлориды металлов могут быть в дальнейшем легко сконденсированы, так как имеют низкую упругость насыщенных паров.