Процессы адсорбции проводят периодически или, если адсорбент движется через аппарат, непрерывно. Материальный баланс такого процесса выражается уравнением, общим для всех процессов массопередачи
G∙dY = L∙dX (3.66)
где G - расход парогазовой фазы или раствора, кг (инертной части)/с; L - расход адсорбента, кг (активной части)/с; Y - рабочие концентрации адсорбируемого вещества в парогазовой фазе или растворе, кг/кг (инертной части); X - рабочие концентрации адсорбируемого вещества в адсорбенте, кг/кг (адсорбента).
Адсорбция в слое неподвижного адсорбента является периодическим процессом, при котором концентрация поглощаемого вещества в адсорбенте и в парогазовой фазе меняется во времени и в пространстве.
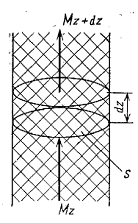
Рис. 3.12. Элемент неподвижного слоя адсорбента
Выделим в неподвижном адсорбенте элементарный слой с площадью поперечного сечения S и высотой d z (рис. 3.), через который движется газ со скоростью w. Газ входит в элемент при концентрации с, а выходит при концентрации 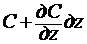 . Концентрация сорбируемого вещества в адсорбенте за время dτ изменится от a до
. Концентрация сорбируемого вещества в адсорбенте за время dτ изменится от a до 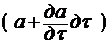 . Количество сорбируемого вещества, входящее в элемент за время dτ, составляет
. Количество сорбируемого вещества, входящее в элемент за время dτ, составляет
Mz = w∙C∙S∙dτ, (3.67)
а количество выходящего сорбируемого вещества

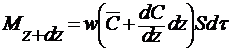 (3.68)
(3.68)
За время dτ в элементе сорбируется следующее количество вещества:
 (3.69)
(3.69)
Это же количество сорбируемого вещества в элементе может быть выражено через изменения его концентраций в адсорбенте и в газовой фазе элемента за время dτ:
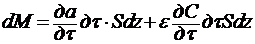 (3.70)
(3.70)
где ε – порозность адсорбента.
Общий материальный баланс по сорбируемому веществу в элементе за время dτ без учета продольного перемешивания газового потока выражается
уравнением
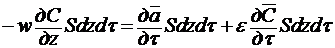 (3.71)
(3.71)
или окончательно
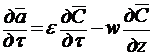 (3.72)
(3.72)
Равенство (3.72) называют дифференциальным уравнением материального баланса периодического процесса адсорбции в слое неподвижного адсорбента.
Кинетика адсорбции
Процесс адсорбции складывается из последовательно протекающих стадий диффузии молекул поглощаемого вещества из потока газа к внешней поверхности адсорбента (внешняя диффузия), проникновения молекул внутри пористого поглотителя (внутренняя диффузия) и сорбции (конденсации) молекул на внутренней поверхности пор.
Нестационарная одномерная диффузия может быть описана вторым законом Фика:
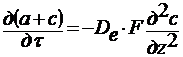 (3.73)
(3.73)
где а = X и с = Y – концентрации компонента соответственно в твердой и газовой фазах; De – эффективный коэффициент диффузии; F – поверхность, перпендикулярная направлению потока; ∂2 c / ∂ z 2 - частная производная по градиенту концентрации в направлении оси z.
Механизм конкретного процесса диффузии определяют на основе изучения зависимостей коэффициентов диффузии от давления, температуры, молекулярных масс поглощаемого вещества и газа-носителя.
Уравнение кинетики адсорбции:
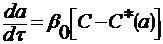 (3.74)
(3.74)
где β0 - коэффициент массопередачи, выражаемый через коэффициенты внешнего β1 и внутреннего β2 массообмена
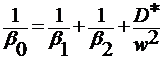 (3.75)
(3.75)
где D * - коэффициент продольной диффузии; w - скорость потока газа.
Различают стационарные и нестационарные процессы адсорбции. В стационарном процессе концентрация адсорбата в каждой точке слоя поглотителя постоянна и непрерывна. В практике санитарной очистки газа наиболее распространены нестационарные периодические процессы.
Для построения рабочей линии процесса необходимо располагать величинами динамической адсорбционной емкости адсорбента a д по извлекаемому компоненту для заданных концентраций адсорбента на входе в адсорбер и выходе из него:
aд = C0 ∙w0 ∙τ (3.76)
где C 0 - концентрация примеси в очищаемом газе на входе в адсорбер; w 0 - приведенная к сечению аппарата скорость газа; τ - время защитного действия
слоя адсорбента.
Необходимая высота (длина) H слоя поглотителя может быть рассчитана по общему уравнению массопередачи:
w0 ∙ dc = β 0 (c − c*) ∙ dH (3.77)
откуда высота слоя

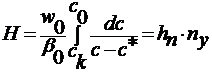 (3.78)
(3.78)
где hn = w 0 / β 0 - единица переноса; ny – число единиц переноса.
Число единиц переноса определяют по формуле
Yн Xк
ny = ∫dy/(Y – Y*) или nx = ∫dx/(X* - X) (3.79)
Y к X н
Здесь Y н, Y к - начальная и конечная концентрация адсорбтива в парогазовой смеси, кг/м3; Х н, Х к - начальная и конечная концентрация адсорбата в твердой фазе, кг/м3; X, Y - текущая (рабочая) концентрация адсорбата и адсорбтива, соответственно, в твердой и парогазовой фазе, кг/м3; X *, Y * - равновесные концентрации адсорбата в твердой. фазе и адсорбтива в парогазовой фазе при заданных значениях Х и Y (определяются по кривой равновесия).
Уравнение (3.79) обычно решают методом графического интегрирования. Задавшись рядом значений Y в интервале (Y н - Y к), строят график в координатах 1/(Y – Y *), затем измеряют площадь криволинейной трапеции f, ограниченную кривой ab, осью абсцисс и прямыми, проведенными из точек Y к и Y н (рис. 3.13).
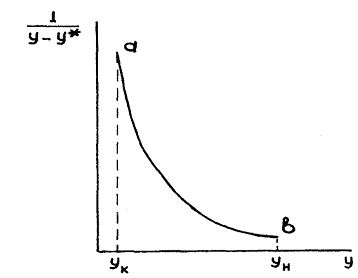
Рис. 3.13. Зависимость 1/(Y – Y*) = f (Y)
Число единиц переноса определяют из выражения
ny = f М1 ∙ М2 (3.80)
где M1 - масштаб по оси 1/(Y – Y*); М2 - масштаб по оси у.
Величину масштабов можно определить по формуле
М1 = l1/h1; М2 = l2/h2 (3.81)
где l 1 - значение ординаты 1/(Y – Y *)на графике, кг/м3; h 1 - значение той же ординаты, мм; l 2 - значение абсциссы Y на графике, кг/м3; h 2 - значение этой же абсциссы, мм.
Для определения Y * (или X *), необходимых для построения описанного выше графика, нужно построить рабочую линию процесса адсорбции и изотерму адсорбции (рис. 3.14).
Изотерму адсорбции строят на основании экспериментальных или справочных данных.
Если изотерма адсорбции неизвестна, ее можно построить по изотерме адсорбции стандартного вещества. В качестве стандартного вещества обычно
выступает бензол.
Величину адсорбции пересчитывают по формуле
X2* = X1*(V1/V2) = X1*(1/βа) (3.82)
где Х 1* - ордината изотермы стандартного вещества (обычно бензола), кг/кг; Х 2* - ордината определяемой изотермы, кг/кг; V 1, V 2 - мольные объемы стандартного и исследуемого вещества в жидком состоянии, м3/кмоль; βа = V 2/ V 1 - коэффициент аффинности.
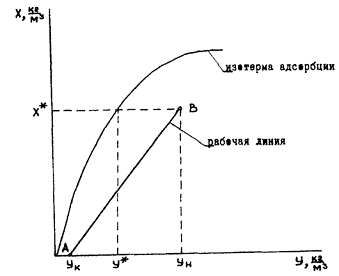
Рис. 3.14. Графическое изображение изотермы адсорбции и рабочей линии
Мольные объемы веществ можно определить по выражению:
V = M/ρж (3.83)
где М - мольная масса вещества в жидком состоянии, кг/кмоль; ρж - плотность вещества в жидком состоянии, кг/м3.
Высоту единицы переноса h определяют по формуле (3.84):
h = Gr/(Sсл ∙βy) = Vr ∙ρr/(Sсл ∙βy) (3.84)
где G г - массовый расход парогазовой смеси, кг/с; S сл - сечение слоя адсорбента, м2; β y - объемный коэффициент массоотдачи в газовой смеси, 1/с; ρг - плотность парогазовой смеси, кг/м3.
Объемный коэффициент массопередачи Ky определяется по уравнению
1/Ky = (1/βy) + (m/βx) (3.85)
где β x - объемный коэффициент массоотдачи в твердой фазе, 1/с; m = Y н /X к * -
коэффициент распределения (средний тангенс угла наклона линии равновесия к оси абсцисс);
Величина m = Y н/ X к* обычно мала, поэтому
1/ Ky ≈ 1/β y (3.86)
На этом основании в уравнении (3.84) вместо коэффициента массопередачи приведен коэффициент массоотдачи β y.
Коэффициент массоотдачи определяют из выражения критерия Нуссельта (Nu '):
Nu′ = βy∙.dэ2/D (3.87)
Критерий Нуссельта определяют в зависимости от численного значения модифицированного критерия Рейнольдса (Re) и диффузионного критерия Прандтля (Pr ′):
Re = wr dэ ρr/(εн ∙ μr); (3.88) Pr′ = μr/(ρr D) (3.89)
где w г – скорость парогазовой смеси, отнесенная к свободному сечению слоя
адсорбента, м/с; μг - динамическая вязкость газа, Па∙с; εн - порозность неподвижного слоя адсорбента; d э - эквивалентный диаметр зерна адсорбента, м; D - коэффициент молекулярной диффузии, м2/с.
Объем слоя адсорбента V ад определяют по формуле
Vад = H ∙Sсл. (3.90)
Продолжительность τ (с) процесса адсорбции определяют в зависимости oт вида изотермы адсорбции.
1) Если изотерма адсорбции выражена линейной зависимостью (точка Y н находится в первой области изотермы адсорбции), то изотерма адсорбции
приближенно отвечает закону Генри:
τ1/2 = (X*∙H/wr ∙Yн)1/2 – b(X*/βy∙ Yн)1/2 (3.91)
где Y н - начальная концентрация адсорбируемого вещества в парогазовом потоке, кг/м3; X* - равновесное количество адсорбированного веществa, кг/кг (принимается по изотерме адсорбции и умножается на насыпную плотность адсорбента); Н - высота слоя адсорбента, м; b - коэффициент, определяется по справочным данным.
2) Если зависимость между концентрацией газа и количеством поглощенного вещества является криволинейной (вторая область изотермы адсорбции):
τ = (X*/wr ∙Yн){H–wr/βy[(Y1*/Yн).ln([Yн/Yк]-1) + ln([Yн/Yк]-1)]} (3.92)
Здесь Y 1* - содержание вещества в газовом потоке, равновесное с количеством, равном половине вещества, максимально поглощаемого адсорбентом при данной температуре, т.е. при X max*/2, кг/м3.
3) Если количество вещества, поглощаемого адсорбентом, достигает предела и остается постоянным (третья область изотермы адсорбции):
τ = (X*/wr ∙Yн){H – wr/βy[ln(Yн/Yк) – 1]} (3.93)