Введение
Четыре свойства разбавленных растворов нелетучего вещества в летучем растворителе традиционно объединяются под названием коллигативных свойств:
1. Понижение давления пара растворителя.
2. Повышение температуры кипения растворителя.
3. Понижение температуры замерзания растворителя.
4. Явление осмотического давления.
Эти свойства называются коллигативными (что означает коллективными) потому, что они зависят от количества имеющихся молекул или ионов растворенного вещества, а не от природы растворенных частиц.
Уравнения, описывающие коллигативные свойства, выведены из. условия, что частицы в растворе не взаимодействуют между собой, го есть ведут себя аналогично идеальным газам. Строго говоря, свойствами идеального раствора не обладает ни один реальный раствор. Но большинство реальных растворов при малых значениях концентраций растворенного вещества практически ведут себя как идеальные, и уравнения, описывающие коллигативные свойства, достаточно точны для большинства разбавленных растворов.
Зависимость коллигативных свойств растворов от природы растворителя выражается в криоскопической и эбуллиоскопической константах, индивидуальных для каждого растворителя.
Коллигативные свойства играли важную роль для развития химии, поскольку они позволяли судить о числе частиц имеющегося в наличии растворенного вещества, а, следовательно, о его молекулярной массе и степени ионизации в растворе. Коллигативные свойства позволили Аррениусу показать, что в растворе содержится больше частиц, чем имелось в наличии молекул растворенного вещества, а, следовательно, что молекулы растворенного вещества в растворе распадаются на ионы. В настоящее время коллигативные свойства используются главным o6pазом для определения молекулярных масс неизвестных веществ.
Понижение давления пара растворителя
Пар над жидкостью в состоянии равновесия называется насыщенным паром. Давление насыщенного пара — характерная величина для данного вещества и зависит от температуры. Если в жидкости растворены нелетучие вещества, то давление ее пара понижается.
Свойства разбавленных растворов определяются только природой растворителя и числом частиц растворенного вещества, поскольку вследствие малых концентраций силами взаимодействия между молекулами компонентов раствора можно пренебречь.
Давление насыщенного пара растворителя над раствором (Р) всегда меньше, чем над чистым растворителем (Ро). Это связано с тем, что поверхность раствора частично занята сольватированными молекулами растворенного вещества, благодаря чему уменьшается поверхностная концентрация молекул самого растворителя, а, следовательно, и скорость его испарения.
Понижение давления пара раствора — разность между давлением пара растворителя (р0) и давлением пара раствора

Понижение давления пара раствора прямо пропорционально мольной доле растворенного вещества в растворе или пропорционально отношению числа молей растворенного вещества к общему числу молей, содержащихся в растворе:
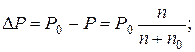
где n— число молей растворенного вещества; п0 — число молей растворителя.
Δ Р, отнесенная к P 0, называется относительным понижением давления пара растворителя 
Первый закон Рауля
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества  .
.
Пример 1.
Раствор масляной кислоты (С3Н7СООН) в хлороформе используется при экстракционном разделении лантаноидов и актиноидов. Давление пара хлороформа при 20° С равно 200 мм рт. ст. Вычислить давление пара 8 М раствора масляной кислоты в хлороформе (плотность раствора — 1,48 г/см3).
Решение.
По условию задачи  ; молярность раствора 8 моль/л, т.е. n = 8 моль.
; молярность раствора 8 моль/л, т.е. n = 8 моль.
Подсчитываем n0:
Масса 1 л раствора равна 1480 г;
масса растворителя CHCl3 в растворе равна
mр-ля = mр-ра – mр-го = 1480 – 8 М (С3Н7СООН) = 1480 – 8×88 = 776 г.
no= 
Отсюда 200 – р = 200 
р = 200 – 89,6 = 110,4 мм рт. ст.
Пример 2.
Раствор трибутилфосфата в бензоле применяют для экстракции из раствора соли плутония.
Давление пара бензола при 15° С равно 60 мм рт. ст. Понижение давления пара 5 %-го раствора трибутилфосфата (С4Н9)3РО4 в бензоле равно 0,91 мм рт. ст. Какова молекулярная масса бензола (давлением пара трибутилфосфата пренебречь)?
Решение.
В 100 г раствора масса трибутилфосфата (ТБФ) равна 5 г, масса бензола — 95 г. Итак, молекулярная масса бензола равняется 78 г/моль.

Поскольку понижение давления

получаем:
 .
.
М(бензола) = 78 г/моль.