Понижение давления пара над растворами приводит к тому, что они кипят и замерзают при температурах, отличающихся от соответствующих температур для чистых растворителей. Известно, что жидкость закипает, когда давление ее насыщенного пара становится равным внешнему давлению, а кристаллизация жидкости начинается в тот момент, когда давление ее насыщенных паров становится равным давлению над твердой фазой, в которую она переходит. Поэтому растворы кипят при более высоких температурах (tК р-ля), а замерзают при более низких температурах (tЗ р-ля), чем чистые растворители (tЗ р-ля).
Второй закон Рауля
Повышение температуры кипения раствора (tК) и понижение температуры замерзания раствора (tЗ) по сравнению с чистым растворителем пропорциональны моляльной концентрации растворенного вещества.
ΔtК = tК р-ра = tК р-ля = Е ∙ См;
ΔtЗ = tК р-ра = tЗ р-ля = Е ∙ См.
Коэффициент пропорциональности Е называется эбулиоскопической постоянной растворителя. Она равна ΔtК для одномоляльного раствора любого неэлектролита в данном растворителе, то есть зависит от природы растворителя и не зависит от природы растворенного вещества.
Коэффициент пропорциональности К называется криоскопической постоянной растворителя. Она равна ΔtЗ для одномоляльного раствора любого неэлектролита в данном растворителе, то есть связана с природой растворителя и не зависит от природы растворенного вещества.
Таблица 1.
Значения К и Е для различных растворителей
| Растворитель | К, оС | Е, оС |
| Вода | 1,85 | 0,52 |
| Бензол | 5,07 | 2,57 |
| Фенол | 7,27 | 3,60 |
| Уксусная кислота | 3,9 | 3,07 |
| Этиловый спирт | - | 1,04 |
| Хлороформ | 4,9 | 3,80 |
| Четыреххлористый углерод | 29,9 | 5,30 |
| Ацетон |
Законы Рауля можно использовать для определения молекулярных масс (Мр-го) растворенных веществ:
ΔtК = Е ∙ См = Е ∙ 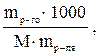
отсюда
Мр-го = 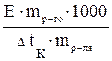
и аналогично по понижению температуры замерзания
М = 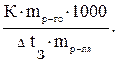
Осмос
Осмосом называют диффузию растворителя через полупроницаемую перегородку, разделяющую раствор и чистый растворитель или два раствора различной концентрации.
Осмотическое давление (Росм.) – это давление, которое нужно приложить к раствору, чтобы привести его в равновесие с чистым растворителем, отделенным о него полупроницаемой перегородкой.
Теоретическое выражение для осмотического давления получил Вант-Гофф, рассматривавший поведение частиц вещества в растворе аналогично поведению молекул газа, занимающего одинаковый с раствором объем.
Закон Вант-Гоффа
Осмотическое давление разбавленного раствора численно равно тому давлению, которое производило бы данное количество растворенного вещества, занимая в виде газа при данной температуре объем, равный объему раствора.
Росм = См ∙ R ∙ Т.
Осмотическое давление прямо пропорционально молярной концентрации раствора и температуре.
Закон Вант-Гоффа позволяет вычислить осмотическое давление раствора, если известны его концентрации и температура. Основанием для расчетов могут служить следующие рассуждения.
Если 1 моль газа заключить в сосуд емкостью 22,4 л, то при 0оС давление окажется равным 1 атм. То же количество газа, помещенное в сосуд емкостью 1 л, окажет при той же температуре давление в 22,4 раза больше, то есть 22,4 атм. Переходя к осмотическому давлению, рассуждаем таким же образом. Если 1 моль растворенного вещества находится в22,4 л раствора, то осмотическое давление такого раствора при 0оС равно 1 атм. То же количество растворенного вещества, находясь в 1 л раствора, создает осмотическое давление 1 л одномолярного раствора неэлектролита при 0оС составляет 22,4 атм.
| Состояние вещества | Количество вещества | Т | V | следова-тельно | давление |
| газ раствор | 1 моль 1 моль | 273 К 273 К | 22,4 л 1 л | => => | Р = 1 атм Росм= 22,4 атм |
Пример.
Вычислить осмотическое давление при 22оС раствора, в 1,2 л которого содержится 20,5 г сахара.
Решение: Воспользуемся формулой расчета осмотического давления
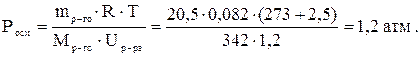
Пример.
Чему равно осмотическое давление раствора, содержащего 15,8 г пиридина С5Н5N (M = 79) в 100 мл раствора при 0оС?
Решение: концентрация данного раствора составляет  моль, следовательно, осмотическое давление при 0оС будет равно 22,4 ∙ 2 = 44,8 атм.
моль, следовательно, осмотическое давление при 0оС будет равно 22,4 ∙ 2 = 44,8 атм.
Пример.
Для понижения температуры замерзания воды, используемой для охлаждения двигателей автомашин (антифриз), в воду добавляют неэлектролит.
Сколько молей неэлектролита на 1000 г воды нужно взять, чтобы понизить температуру замерзания антифриза на 5оС? Какое количество для этого нужно взять глицерина С3Н3О8 (М = 92)? Этилового спирта С2Н6О (М = 46)?
Решение: Введение 1 моль неэлектролита понижает температуру замерзания водного раствора на 1,86оС. Для понижения температуры замерзания на 5оС нужно  моль неэлектролита, что составит 2,687 ∙ 92 = 247,2 г глицерина или 2,687 ∙ 46 = 123,6 г этилового спирта.
моль неэлектролита, что составит 2,687 ∙ 92 = 247,2 г глицерина или 2,687 ∙ 46 = 123,6 г этилового спирта.
Пример.
При какой температуре будет кипеть раствор, содержащий 18,6 г анилина С6Н6?
Решение: tК р-ра = tК р-ля + ΔtК
ΔtК = См ∙ Е См = 
Следовательно,
TК р-ра = tК р-ля + 
 оС.
оС.