 В случае гидролиза соли, образованной слабым основанием и слабой кислотой, в реакции одновременно участвуют и катион, и анион соли, связывающие ионы воды.
В случае гидролиза соли, образованной слабым основанием и слабой кислотой, в реакции одновременно участвуют и катион, и анион соли, связывающие ионы воды.
Уравнение диссоциации
CH3COONH4 = NH4+ + CH3COO-.
Уравнения гидролиза:
CH3COONH4 + H2O 
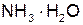 + CH3COOH;
+ CH3COOH;
NH4+ + CH3COO– + H2O 
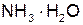 + CH3COOH.
+ CH3COOH.
Значение рН растворов таких солей зависит от относительной силы кислоты и основания, образующих соль. Константы диссоциации уксусной кислоты и гидрата аммиака равны:  и
и
 , поэтому среда в растворе данной соли нейтральная.
, поэтому среда в растворе данной соли нейтральная.
В общем случае, если
 – реакция раствора соли слабощелочная,
– реакция раствора соли слабощелочная,  – реакция раствора соли слабокислая,
– реакция раствора соли слабокислая,  – реакция раствора соли нейтральная, pH = 7.
– реакция раствора соли нейтральная, pH = 7.
Степень гидролиза и ее зависимость от различных факторов
Гидролиз обратим, равновесие в системе смещено в направлении образования более слабого электролита – воды, т. е. в направлении обратной реакции. Глубину прохождения гидролиза можно количественно охарактеризовать степенью гидролиза.
|
Значение h выражают в долях единицы или процентах. Степень гидролиза зависит от природы соли, концентрации раствора соли и температуры.
v Степень гидролиза соли тем больше, чем слабее основание или кислота, образующие соль.
v Повышение температуры приводит к увеличению степени гидролиза, так как гидролиз – эндотермический процесс.
v Степень гидролиза увеличивается. при разбавлении раствора (уменьшении концентрации).
Добавление кислоты приводит к смещению равновесия гидролиза соли АВ по катиону
А+ + HOH  АOH + H+
АOH + H+
влево, т. е. к уменьшению степени гидролиза, а добавление щелочи – к увеличению степени гидролиза, ослабить гидролиз можно добавлением кислоты.
Равновесие гидролиза соли по аниону,
В− + HOH  HВ + OH-,
HВ + OH-,
при добавлении кислоты смещается вправо, гидролиз усиливается, ослабить гидролиз можно добавлением щелочи.
Необратимый гидролиз
Гидролиз солей многоосновных слабых кислот (летучих или малорастворимых) и слабых оснований, образованных многозарядными катионами протекает необратимо с образованием слабой кислоты и слабого основания
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑.
Такие соли в водных растворах не существуют.
Если в растворе одновременно присутствуют две соли, одна из которых содержит катион слабого основания (Al3+, Fe3+, Cr3+, NH4+ и др.), а другая – анион слабой кислоты (СO32-, SiO32-, S2- и др.), проходит совместный гидролиз. В результате образуются кислота и основание.
Примеры.
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl;
2Al3+ + 3S2- + 6H2O = 2Al(OH)3 + 3H2S.
2NH4Cl + Na2SiO3 + (H2O) = 2NH3↑ + H2SiO3↓ + 2NaCl;
2NH4+ + SiO32- + (H2O) = 2NH3 + H2SiO3.
Знание закономерностей гидролиза необходимо при практическом использовании растворов солей. К примеру, при очистке природных и сточных вод от катионов металлов гидролиз стремятся усилить, сделать необратимым, чтобы продукты реакции можно было удалить в виде осадков. Напротив, гидролиз при синтезе неорганических веществ в водных растворах – осложнение, приводящее к загрязнению вещества примесями продуктов гидролиза, и его стремятся ослабить.