ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ.
Водородный показатель
Вода – слабый электролит. Уравнение диссоциации
H2O  H+ + OH-,
H+ + OH-,
константа диссоциации воды
 (при 298 К).
(при 298 К).
Произведение равновесных концентраций ионов водорода и гидроксид-ионов называют ионным произведением воды ( ).
).
|
При данной температуре ионное произведение воды является постояннойвеличиной для любых разбавленных водных растворов. Зная концентрацию ионов H+, можно рассчитать концентрацию OH-, и наоборот.
Поскольку степенные выражения неудобны в расчетах, их заменяют логарифмическими функциями, имеющими специальные обозначения и названия. Для характеристики среды, как правило, используют водородный показатель:
|
В нейтральной среде

 .
.
В кислой среде
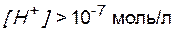 ,
,  ,
,  , т.е.
, т.е.  .
.
В щелочной среде
 ,
, 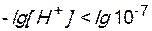 ,
,  , т.е.
, т.е.  .
.
Значения концентраций ионов H+ или OH-, а также показатель рН являются количественной характеристикой среды раствора (кислой, нейтральной, щелочной).
| Среда | [H+], моль/л | [OH-], моль/л | рН |
| нейтральная | 10-7 | 10-7 | |
| кислая | >10-7 | <10-7 | < 7 |
| щелочная | <10-7 | >10-7 | > 7 |
 Вычислите рН 0,01 М раствора соляной кислоты.
Вычислите рН 0,01 М раствора соляной кислоты.
Решение. Водородный показатель 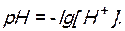 Соляная кислота является сильным электролитом, т.е. в водном растворе полностью распадается на ионы: HCl = H+ + Cl-. Молярная концентрация ионов водорода равна молярной концентрации кислоты:
Соляная кислота является сильным электролитом, т.е. в водном растворе полностью распадается на ионы: HCl = H+ + Cl-. Молярная концентрация ионов водорода равна молярной концентрации кислоты:
 ;
;
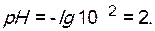
 Вычислите рН 0,001 М раствора NaOH.
Вычислите рН 0,001 М раствора NaOH.
Решение. NaOH - щелочь, сильный электролит, в водном растворе полностью распадается на ионы: NaOH = Na+ + OH-. Молярная концентрация гидроксид-ионов равна молярной концентрации NaOH:

Концентрацию ионов водорода определяем по ионному произведению воды:

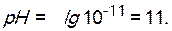
|
В результате гидролиза происходит
связывание ионов соли в малодиссоциирующие соединения;
смещение ионного равновесия воды.
Гидролиз возможен, если в составе соли присутствуют ионы, способные образовать с ионами воды слабые электролиты. Гидролизу подвергаются соли, образованные
v слабыми кислотами и сильными основаниями;
v слабыми основаниями и сильными кислотами;
v слабыми кислотами и слабыми основаниями.
Гидролиз невозможен, если в составе соли – только ионы сильных электролитов. Соли, образованные сильной кислотой и сильным основанием (например, NaВr, KNO3, CaCl2), гидролизу не подвергаются, их растворы нейтральны.
 Гидролиз солей слабых кислот и сильных оснований
Гидролиз солей слабых кислот и сильных оснований
Соль образована HNO2 – слабой одноосновной кислотой и NaOH – сильным основанием, уравнение диссоциации
NaNO2 = Na+ + NO2-.
Соль гидролизуется по аниону. При составлении уравнений гидролиза целесообразно первым записывать ионное уравнение:
NO2- + HOH  HNO2 + OH-,
HNO2 + OH-,
NaNO2 + H2O  HNO2 + NaOH.
HNO2 + NaOH.
В результате гидролиза соли в растворе повышается концентрация ионов ОН−, среда становится щелочной (pH >7).
 |
Гидролиз солей слабых многоосновных кислотпротекает ступенчато.
Уравнение диссоциации соли
K2CO3 = 2K+ + CO32-.
Гидролиз идет по аниону, возможны две ступени гидролиза.
Уравнения гидролиза по I ступени:
CO32- + HOH  HCO3- + OH-;
HCO3- + OH-;
K2CO3 + H2O  KHCO3 + KOH.
KHCO3 + KOH.
Уравнения гидролиза по II ступени:
HCO3- + HOH  H2CO3 + OH -;
H2CO3 + OH -;
KHCO3 + HOH  H2CO3 + KOH.
H2CO3 + KOH.
В результате гидролиза соли среда становится щелочной (pH >7), гидролиз протекает преимущественно по первой ступени.
|
Гидролиз солей слабых оснований и сильных кислот
Гидролиз солей большинства слабых основанийпротекает ступенчато(число возможных ступеней гидролиза равно заряду катиона).
 |
Mg(NO3)2 = Mg2+ + 2NO3-.
Гидролиз идет по катиону, возможны две ступени гидролиза.
Уравнения гидролиза по I ступени:
Mg2+ + HOH  MgOH+ + H+;
MgOH+ + H+;
Mg(NO3)2 + H2O  MgOHNO3 + HNO3.
MgOHNO3 + HNO3.
Уравнения гидролиза по II ступени:
MgOH+ + HOH  Mg(OH)2 + H+;
Mg(OH)2 + H+;
MgOHNO3 + H2O  Mg(OH)2 + HNO3.
Mg(OH)2 + HNO3.
В результате гидролиза соли среда становится кислой, рН < 7.
|
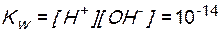 (при Т = 298 К).
(при Т = 298 К).