Экспериментально установлены зависимости между приростом массы окалины или убылью массы металла и временем протекания реакции. Эти зависимости носят название закономерностей или законов окисления металлов. Важнейшими законами окисления металлов являются линейный, параболический (степенной) и логарифмический.
Линейный закон позволяет выразить следующим уравнением рост слоя окалины на металле
| y=k1t, | (1.8) |
где y- прирост массы окисленного металла на единицу поверхности;
t- продолжительность реакции окисления;
k1-постоянная.
Линейный закон характерен, главным образом, для металлов, у которых отношение объемов окисла к объему прокорродировавшего металла, то есть коэффициент Пиллинга-Бредворта, меньше 1, и неполный слой окислов не защищает поверхность. В этом случае окислитель свободно поступает к поверхности металла через неплотный окисный слой.
Степенной закон роста слоя был открыт при исследовании взаимодействия металлического серебра с парами иона. Его можно выразить уравнением
| y2=k2t, | (1.9) |
где k2-постоянная.
В этом случае свободный доступ окислителя к поверхности металла прекращается, а скорость роста слоя зависит от диффузии реагентов. По мере увеличения толщины слоя эта скорость уменьшается. Такая закономерность характерна для окисления при высоких температурах таких металлов, как Cu, Ni, Fe, Cr, Co.
Закон логарифмического роста слоя выражается уравнением
| y=k3ln(at+b), | (1.10) |
где k3, а и b-постоянные.
При окислении по логарифмическому росту торможение росту слоя по мере увеличения его толщины проявляется гораздо сильнее по сравнению с предыдущим процессом. Эксперименты показали, что по логарифмическому закону протекает начальное окисление таких металлов, как Cu, Fe, Ni, Pb, Sn, Mn, Fl, Ti, Ta.
Химическая коррозия α-Fe
Железо и сплавы на его основе являются кристаллическими телами. Железо имеет две полиморфные модификаций: α-Fe – при температуре ниже 911 ˚С с ОЦК решеткой параметрами 2,86Ǻ и γ-Fe с ГЦК решеткой (а = 3,56 Ǻ) существующий в температурном интервале от 911 до 1392 ˚С. Выше 1392 ˚С – ОЦК, причем эта решетка сохраняется вплоть до температуры плавления (1536 ˚С).
Железо образует три окисла: вюстит FeO, магнетит Fe3O4 и гематит Fe2O3. Концентрация отдельных окислов в окалине, образующейся при окислении железа, зависит от состава и давления атмосферы, а также от температуры. При нагревании железа на воздухе образующаяся окалина не содержит вюстита, если температура нагрева не превысила 570 оС. Окалина, возникающая при более высоких температурах, содержит все три вида окислов. Основную часть окалины составляет слой FeO, который примыкает к неокисленному металлу; несколько более богат кислородом средний слой Fe3O4; наконец в наружном слое окалины содержится окисел с максимальным содержанием кислорода Fe2O3.
Процесс образования окалины объясняется теорией Вагнера. Ионы железа отдельно от электронов мигрируют через слой и на границе раздела фаз окисел – газ реагируют с ионами кислорода
Процесс окисления железа в кислороде, диффузию и реакции на границах раздела фаз можно представить следующей схемой
| I II III IV | |||||
| Железо Fe | Вюстит
FeO
Миграция ионов железа по междоузлиям вюстита или вакантным позициям
 Fe2+
−Fe2+→
Миграция электронов по катионым дыркам Fe2+
−Fe2+→
Миграция электронов по катионым дыркам 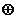 −e-→
−e-→
| Магнетит
Fe3O4
Миграция ионов железа по граням октаэдров или тетраэдров
−Fe2+→
−Fe3+→
Миграция электронов по катионным 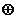 и анионным дыркам
−e-→ и анионным дыркам
−e-→
| Гематит
Fe2O3
Миграция ионов кислорода по междоузлиям; возникновение вакансий в гематите  Fe3+
←O2-−
Миграция электронов по анионным дыркам
−e-→ Fe3+
←O2-−
Миграция электронов по анионным дыркам
−e-→
| Кислород O2 | |
Вследствие уменьшения химического потенциала железа двухвалентные ионы железа мигрируют до границы фаз Fe3O4/ Fe2O3 (III). На границе фаз (II), ионы Fe2+ реагируют с магнетитом, образуя FeO, вследствие чего слой вюститной фазы делается толще. Часть двухвалентных ионов железа, поступающих на границу фаз II, вместе с высвободившимися на границе фаз II трёхвалентными ионами железа мигрируют через фазу магнетита к границе фаз III и, реагируя с Fe2O3, образуют магнетит. Полного исчезновения фазы Fe2O3 не происходит, потому что кислород снаружи постоянно мигрирует к границе фаз III, где с частью поступающих ионов железа образует Fe2O3. Вследствие конкуренции указанных диффузионных процессов во всех трёх фазах и соответствующих реакций на границах фаз образуется слой окалины, наибольшая часть которой приходится на FeO, меньшая на Fe3O4 и самая малая – на Fe2O3. Окалина трёхслойна и состоит из различных фаз окислов железа. Последовательность строения окалины следующая: железо (Fe) – вюстит (FeO) – магнетит (Fe3O4) – гематит (α-Fe2O3) – газ. На границах раздела фаз существуют равновесия.
Величиной, определяющей коррозию металла под действием кислорода при повышенных температурах, является давление диссоциации окисла данного металла. Если давление кислорода в атмосфере меньше, чем давление диссоциации окисла металла при данной температуре, то коррозия металла при этих условиях невозможна. При обратном соотношении между этими величинами коррозия возможна. Коррозия железа в атмосфере возможна вплоть до весьма высоких температур (давление диссоциации FeO остаётся очень малым до 2000 оС). Вопрос о том, какой из окислов железа будет устойчивым (Fe2O3, Fe3O4 или FeO), также определяется соотношением величин давлений диссоциаций этих окислов и давления кислорода в среде.
Различные окислы железа имеют разные области устойчивости, определяющиеся величинами их давлений диссоциации. При температуре ниже 570 оС устойчивой фазой является Fe3O4 и окисление железа определяется ростом плёнки Fe3O4. Выше 570 оС устойчива FeO; большая часть окалины состоит из неё. На границе с газовой фазой окалина покрывается тонким слоем Fe3O4 и ещё более тонким Fe2O3.
Изучение процесса коррозии железа показало, что в приповерхностной области материала образуются различные типы окислов железа. При этом порядок выделения фаз строго детерминирован и определяется увеличением концентрации кислорода вблизи поверхности окисляющей среды. В зависимости от парциального давления кислорода и температуры окисления возможно отсутствие одной или двух фаз. Разработан алгоритм расчета и проведены вычисления для образования окислов в железе в рамках диффузионной модели. Расчеты проводились для случая поглощения кислорода в зависимости от времени термического старения в системе для полного набора окислов железа, когда в приповерхностной области материала образуется вначале твердый раствор Fe(O), затем фазы FeO, Fe3O4 и Fe2O3.