Единый государственный экзамен по ХИМИИ
Демонстрационный вариант КИМ 2007 г.
Подготовлен Федеральным государственным научным учреждением «ФЕДЕРАЛЬНЫЙ ИНСТИТУТ ПЕДАГОГИЧЕСКИХ ИЗМЕРЕНИЙ»

Единый государственный экзамен по ХИМИИ
Пояснения к демонстрационному варианту
При ознакомлении с Демонстрационным вариантом 2007 года следует иметь в виду, что задания, включенные в демонстрационный вариант, не отражают всех вопросов содержания, которые будут проверяться с помощью вариантов КИМ в 2007 году. Полный перечень вопросов, которые могут контролироваться на едином государственном экзамене 2007 года, приведен в кодификаторе, помещенном на сайтах www.ege.edu.ru и www.fipi.ru.
Назначение демонстрационного варианта заключается в том, чтобы дать возможность любому участнику ЕГЭ и широкой общественности составить представление о структуре будущих КИМ, числе, форме, уровне сложности заданий: базовом, повышенном и высоком. Приведенные критерии оценки выполнения заданий с развернутым ответом (тип «С»), включенные в этот вариант, позволят составить представление о требованиях к полноте и правильности записи развернутого ответа.
Эти сведения позволят выпускникам выработать стратегию подготовки и сдачи ЕГЭ в соответствии с целями, которые они ставят перед собой.
Единый государственный экзамен по ХИМИИ
Демонстрационный вариант 2007 г.
Инструкция по выполнению работы
На выполнение экзаменационной работы по химии дается 3 часа (180 минут). Работа состоит из 3 частей и включает 45 заданий.
Часть 1 включает 30 заданий (А1 – А30). К каждому заданию дается 4 варианта ответа, из которых только один правильный.
Часть 2 состоит из 10 заданий (В1 – В10), на которые надо дать краткий ответ в виде числа или последовательности цифр. В этой части используются задания на установление соответствия, на выбор нескольких правильных ответов из числа предложенных, а также расчетные задачи.
Часть 3 содержит 5 самых сложных заданий по общей, неорганической и органической химии. Задания C1 – C5 требуют развернутого ответа.
Внимательно прочитайте каждое задание и проанализируйте все варианты предложенных ответов.
Выполняйте задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удается выполнить сразу, и переходите к следующему. К пропущенному заданию вы сможете вернуться после выполнения всей работы, если останется время.
При выполнении работы вы можете пользоваться периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов (они прилагаются к тексту работы), а также непрограммируемым калькулятором, который выдается на экзамене.
За выполнение различных по сложности заданий дается один или более баллов. Баллы, полученные вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Желаем успеха!
Часть 1
При выполнении заданий этой части в бланке ответов № 1 под номером выполняемого вами задания (А1 – А30) поставьте знак « ´ » в клеточку, номер которой соответствует номеру выбранного вами ответа.
| A1 |
B ряду химических элементов
Na ® Mg ® Al ® Si
| 1) | увеличивается число валентных электронов в атомах |
| 2) | уменьшается число электронных слоев в атомах |
| 3) | уменьшается число протонов в ядрах атомов |
| 4) | увеличиваются радиусы атомов |
| A2 |
В каком ряду простые вещества расположены в порядке усиления металлических свойств?
| 1) | Mg, Ca, Ba |
| 2) | Na, Mg, Al |
| 3) | K, Ca, Fe |
| 4) | Sc, Ca, Mg |
| A3 |
Вещество с ковалентной полярной связью имеет формулу
| 1) | KCl | 2) | HBr | 3) | Р4 | 4) | CaCl2 |
| A4 |
В соединениях:
PH3, P2O5, H3PO3
фосфор имеет степени окисления, соответственно равные
| 1) | + 3; + 5; – 3 |
| 2) | – 3; + 5; + 3 |
| 3) | – 3; + 3; + 5 |
| 4) | + 3; – 5; – 3 |
| A5 |
К веществам с атомной кристаллической решеткой относятся
| 1) | натрий, фтор, оксид серы (IV) |
| 2) | свинец, азотная кислота, оксид магния |
| 3) | бор, алмаз, карбид кремния |
| 4) | хлорид калия, белый фосфор, иод |
| A6 |
Только кислоты расположены в ряду
| 1) | HNO3, Ca(NO3)2, NO2 |
| 2) | KHCO3, Ba(HSO4)2, Zn(OH)Cl |
| 3) | HNO2, HNO3, CH3COOH |
| 4) | H2S, Na2SO3, SO2 |
| A7 |
Верны ли следующие суждения о свойствах оксида хрома (III)?
А. Оксид хрома (III) проявляет амфотерные свойства.
Б. Оксид хрома (III) проявляет только восстановительные свойства.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
| A8 |
Сера является окислителем в реакции с
| 1) | кислородом |
| 2) | металлами |
| 3) | хлором и фтором |
| 4) | азотной кислотой |
| A9 |
С образованием щелочи с водой взаимодействует
| 1) | алюминий | 2) | цинк | 3) | барий | 4) | ртуть |
| A10 |
Оксид серы (IV) взаимодействует с каждым из двух веществ:
| 1) | H2O и KCl |
| 2) | Ba(OH)2 и CaO |
| 3) | CaCO3 и ZnSO3 |
| 4) | Ca(OH)2 и N2 |
| A11 |
Гидроксид кальция не взаимодействует с
| 1) | HCl | 2) | CO2 | 3) | ZnS | 4) | HNO3 |
| A12 |
Раствор сульфата меди (II) реагирует с каждым из двух веществ:
| 1) | HCl и H2SiO3 |
| 2) | H2O и Cu(OH)2 |
| 3) | О2 и HNO3 |
| 4) | NaOH и BaCl2 |
| A13 |
В схеме превращений
NO 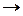 X
X 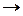 NaNO3
NaNO3
веществом «X » является
| 1) | N2 |
| 2) | NН3 |
| 3) | КNO3 |
| 4) | NO2 |
| A14 |
Органическое вещество, молекулярная формула которого С7Н8, относится к гомологическому ряду
| 1) | метана | 2) | этилена | 3) | бензола | 4) | ацетилена |
| A15 |
К фенолам относится вещество, формула которого
| 1) | C6H5 – O – CH3 |
| 2) | C6H13 – OH |
| 3) | C6H5 – OH |
| 4) | C6H5 – CH3 |
| A16 |
В молекулах какого вещества отсутствуют p-связи?
| 1) | этина | 2) | изобутана | 3) | этена | 4) | циклопентена |
| A17 |
Уксусная кислота может реагировать с
| 1) | карбонатом калия |
| 2) | муравьиной кислотой |
| 3) | серебром |
| 4) | оксидом серы (IV) |
| A18 |
В схеме превращений
этанол ® X ® бутан
веществом «Х » является
| 1) | бутанол-1 | 2) | бромэтан | 3) | этан | 4) | этилен |
| A19 |
К реакциям обмена и соединения относятся соответственно
| 1) | C6H5OH + NaOH 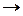 C6H5ONa + H2O и 2Cu + O2 = 2CuO C6H5ONa + H2O и 2Cu + O2 = 2CuO
|
| 2) | CH4 + Cl2 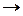 CH3Cl + HCl и 2H2 + O2 = 2H2O CH3Cl + HCl и 2H2 + O2 = 2H2O
|
| 3) | 2SO2 + O2  2SO3 и K2SO3 + 2HCl = 2KCl + SO2↑ + H2O 2SO3 и K2SO3 + 2HCl = 2KCl + SO2↑ + H2O
|
| 4) | NH4OH  NH3 + H2O и 2Al + 3CuSO4 = Al2(SO4)3 + 3Cu NH3 + H2O и 2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
|
| A20 |
При обычных условиях с наименьшей скоростью протекает реакция между
| 1) | Fe и O2 |
| 2) | CaCO3 и HCl(р-р) |
| 3) | Na и O2 |
| 4) | Na2SO4(р-р) и BaCl2(р-р) |
| A21 |
В какой системе увеличение давления и понижение температуры смещает химическое равновесие в сторону продуктов реакции?
| 1) | 2SO2(г) + O2(г)  2SО3(г) + Q 2SО3(г) + Q
|
| 2) | N2(г) + О2(г)  2NO(г) – Q 2NO(г) – Q
|
| 3) | CO2(г) + 2C(тв.)  2CO(г) – Q 2CO(г) – Q
|
| 4) | 2NH3(г)  N2(г) + 3H2(г) – Q N2(г) + 3H2(г) – Q
|
| A22 |
В качестве катионов только ионы Н+ образуются при диссоциации
| 1) | NaOH | 2) | NaH2PO4 | 3) | H2SO4 | 4) | NaHSO4 |
| A23 |
Сокращенное ионное уравнение
Ca2+ + CO32– ® CaCO3
соответствует взаимодействию
| 1) | хлорида кальция и карбоната натрия |
| 2) | сульфида кальция и углекислого газа |
| 3) | гидроксида кальция и углекислого газа |
| 4) | фосфата кальция и карбоната калия |
| A24 |
Восстановительные свойства железо проявляет в реакции:
| 1) | FeO + H2SO4 = FeSO4 + H2O |
| 2) | Fe(OH)2 + 2HCl = FeCl2 + 2H2O |
| 3) | 2FeCl2 + Cl2 = 2FeCl3 |
| 4) | FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl |
| A25 |
Кислую среду имеет водный раствор
| 1) | Na3PO4 |
| 2) | KCl |
| 3) | Na2CO3 |
| 4) | ZnSO4 |
| A26 |
Бензол вступает в реакцию замещения с
| 1) | бромом и азотной кислотой |
| 2) | кислородом и серной кислотой |
| 3) | хлором и водородом |
| 4) | азотной кислотой и водородом |
| A27 |
Основным продуктом реакции хлорэтана с избытком водного раствора гидроксида калия является
| 1) | этилен |
| 2) | этан |
| 3) | этиловый спирт |
| 4) | этилат калия |
| A28 |
Формула соединения углерода, проявляющего токсичные свойства,
| 1) | NaHCO3 | 2) | Na2CO3 | 3) | CaCO3 | 4) | CO |
| A29 |
Реакции полимеризации этилена соответствует схема
| 1) | nCH2 = CH2 ® (– CH2 – CH2 –)n |
| 2) | R× + CH2 = CHCl ® R – CH2 – CH× ÷ Cl |
| 3) | 2R× + CH2 = CH2 ® R – CH2 – CH2 – R |
| 4) | CH2 = CH2 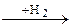 CH3 – CH3 CH3 – CH3
|
| A30 |
В соответствии с термохимическим уравнением
С6Н12О6 + 6О2 = 6СО2 + 6Н2О + 2816кДж
выделится 1408 кДж теплоты, если в реакции участвует кислород количеством вещества
| 1) | 1,5 моль | 2) | 3 моль | 3) | 4,5 моль | 4) | 6 моль |
Часть 2
Ответом к заданиям этой части (В1 – В10) является набор цифр или число, которые следует записать в бланк ответов № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждую цифру и запятую в записи десятичной дроби пишите в отдельной клеточке в соответствии с приведенными в бланке образцами.
В заданиях В1 – В4 на установление соответствия к каждой позиции первого столбца подберите соответствующую позицию второго и запишите в таблицу выбранные цифры под соответствующими буквами. Затем получившуюся последовательность цифр перенесите в бланк ответов № 1 без пробелов и других символов. (Цифры в ответе могут повторяться.)
| B1 |
Установите соответствие между формулой вещества и его названием.
| ФОРМУЛА ВЕЩЕСТВА | НАЗВАНИЕ | ||
| А) | 
| 1) | глицин |
| Б) | CH3CH2Cl | 2) | аланин |
| В) | 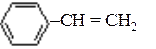
| 3) | стирол |
| Г) | 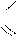 OH
H2NCH2 – C
O OH
H2NCH2 – C
O
| 4) | метилбензоат |
| 5) | хлорэтан |
| А | Б | В | Г |
| B2 |
Установите соответствие между схемой химической реакции и изменением степени окисления окислителя.
| СХЕМА РЕАКЦИИ | ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ | ||
| А) | 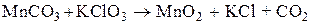
| 1) | 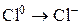
|
| Б) | 
| 2) | 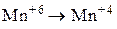
|
| В) | 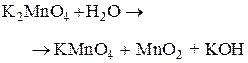
| 3) | 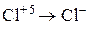
|
| Г) | 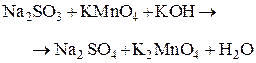
| 4) | 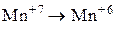
|
| 5) | 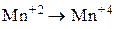
| ||
| 6) | 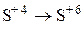
|
| А | Б | В | Г |
| B3 |
Установите соответствие между формулой вещества и продуктом, который образуется на катоде в результате электролиза его водного раствора.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТ ЭЛЕКТРОЛИЗА | ||
| А) | AlCl3 | 1) | алюминий |
| Б) | RbOH | 2) | рубидий |
| В) | Hg(NO3)2 | 3) | ртуть |
| Г) | AuCl3 | 4) | водород |
| 5) | кислород | ||
| 6) | золото |
| А | Б | В | Г |
| B4 |
Установите соответствие между формулой соли и средой ее водного раствора.
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА | ||
| А) | K2SO4 | 1) | нейтральная |
| Б) | CrCl3 | 2) | кислая |
| В) | Li2CO3 | 3) | щелочная |
| Г) | NH4Br |
| А | Б | В | Г |
В заданиях В5 – В8 на выбор правильных ответов из предложенного списка обведите цифры, под которыми обозначены правильные ответы. Запишите обведенные цифры сначала в текст работы, а затем в бланк ответов № 1 в порядке возрастания (без пробелов и других символов).
| B5 |
Разбавленная серная кислота может реагировать с:
| 1) | Ba(NO3)2 |
| 2) | Fe2O3 |
| 3) | Ag |
| 4) | Zn(OH)2 |
| 5) | SiO2 |
| 6) | СН4 |
Ответ: ________________.
| B6 |
Для метана характерны:
| 1) | реакция гидрирования |
| 2) | тетраэдрическая форма молекулы |
| 3) | наличие π- связи в молекуле |
| 4) | sp 3-гибридизация орбиталей атома углерода в молекуле |
| 5) | реакции с галогеноводородами |
| 6) | горение на воздухе |
Ответ: ________________.
| B7 |
Метаналь может реагировать с
| 1) | HBr |
| 2) | Ag[(NH3)2]OH |
| 3) | С6Н5ОН |
| 4) | С6Н5СН3 |
| 5) | Na |
| 6) | Н2 |
Ответ: _____________.
| B8 |
Метиламин
| 1) | газообразное вещество |
| 2) | имеет окраску |
| 3) | проявляет основные свойства |
| 4) | является менее сильным основанием, чем аммиак |
| 5) | реагирует с серной кислотой |
| 6) | реагирует с водородом |
Ответ: _________________.
Ответом к заданиям В9, В10 является число. Запишите это число в текст работы, а затем перенесите его в бланк ответов № 1 без указания единиц измерения.
| B9 |
Масса фенолята натрия, который образуется при взаимодействии 9,4 г фенола с 50 г 12%-ного раствора гидроксида натрия, равна ___________ г.
(Запишите число с точностью до десятых.)
| B10 |
При взаимодействии 56 л оксида серы (IV) и 48 л кислорода остается избыток кислорода объемом (н.у.) _________ л. (Запишите число с точностью до целых.)
Не забудьте перенести все ответы в бланк ответов № 1.
Часть 3
| Для записи ответов к заданиям этой части (С1 – С5) используйте бланк ответов № 2. Запишите сначала номер задания (С1 и т.д.), а затем полное решение. Ответы записывайте четко и разборчиво. |
| C1 |
Используя метод электронного баланса, составьте уравнение реакции:
K2Cr2O7 + … + H2SO4 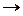 I2 + Cr2(SO4)3 + … + H2O
I2 + Cr2(SO4)3 + … + H2O
Определите окислитель и восстановитель.
| C2 |
Даны вещества: сера, сероводород, азотная кислота (конц.), серная кислота (конц.).
Напишите уравнения четырех возможных реакций между этими веществами.
| C3 |
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
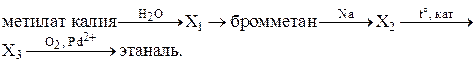
| C4 |
Для получения раствора сульфата калия рассчитанное количество карбоната калия растворили в 5%-ной серной кислоте. Определите массовую долю сульфата калия в полученном растворе.
| C5 |
Установите молекулярную формулу алкена, если известно, что одно и то же количество его, взаимодействуя с галогенами, образует, соответственно, или 56,5 г дихлорпроизводного, или 101 г дибромпроизводного.
~EndLATTest
| C4 |
Для получения раствора сульфата калия рассчитанное количество карбоната калия растворили в 5%-ной серной кислоте. Определите массовую долю сульфата калия в полученном растворе.
Ответ:
| Баллы | |
| C5 |
Установите молекулярную формулу алкена, если известно, что одно и то же количество его, взаимодействуя с галогенами, образует, соответственно, или 56,5 г дихлорпроизводного, или 101 г дибромпроизводного.
Ответ: