ЛЕКЦИЯ № 1
Тема: Методы очистки ВМС
П Л А Н
1. Основные методы очистки ВМС, используемые в медицине:
- диализ;
- электродиализ;
- компенсационный диализ.
2. Электрофорез и электроосмос – как методы разделения ВМС и их идентификация.
3. Строение мицеллы коллоидной частицы.
Методы очистки коллоидных растворов
Для получения коллоидных растворов с наибольшей устойчивостью и для изучения их свойства необходимо удаление из золей всевозможных примесей и, в первую очередь, избытка электролитов, который используется при получении коллоидов.
1) Диализ – освобождение коллоидных растворов от примесей, способных проникать через растительные, животные и искусственные мембраны.
А приборы ® диализаторы
Биотехнология – при фракционировании белков – используют (NH4)2SO4 ® освобождаются об.
2) Электродиализ – для ускорения диализа – использование постоянного электрического тока.
Компенсационный диализ КД
Сущность КД состоит в замене обычного растворителя специально приготовленным раствором, содержащим известные концентрации веществ, близкие к концентрации исследуемой биологической жидкости. После диализа, когда между указанными концентрациями установится динамическое равновесие, анализируют состав и определяют количество во внешней среде веществ, вновь продиализировавших. Этот метод позволяет судить об истинных концентрациях веществ в исследуемых коллоидных растворах.
На принципе компенсационного диализа используется аппарат «искусственная почка», с помощью которого можно очищать кровь от продуктов обмена веществ (шлаков) и, следовательно, временно замещать функцию естественной «больной почки» при острой почечной недостаточности, при отравлении сулемой, сульфаниламидами, при уремии, при тяжелых ожогах, токсикозах беременности.
Ультрафильтрация – отделение дисперсной фазы от дисперсионной среды через специальные мембраны.
В основе метода лежит продавливание разделяемой смеси через фильтры с порами, пропускающими только молекулы и ионы низкомолекулярных веществ. Это диализ под давлением. Для очистки Н2О, белков, НК, витаминов, ферментов.
Электрофорез – перемещение частиц дисперсной фазы относительно неподвижной дисперсинной среды под воздействием внешнего электрического поля.
Скорость движения частиц определяется по уравнению Гельмгольца-Смолуховского:

uэф. – скорость электрофореза
e - относительная диэлектрическая
проницаемость среды
e0 – электрическая постоянная
D y - разность потенциалов
z - электрокинетический потенциал
Кф – коэффициент, зависящий от формы коллоидной
частицы
h - вязкость дисперсионной среды
l - расстояние между электродами
 Электроосмос – это перемещение дисперсионной среды относительно неподвижной дисперсной фазы под воздействием внешнего электрического поля.
Электроосмос – это перемещение дисперсионной среды относительно неподвижной дисперсной фазы под воздействием внешнего электрического поля.
uэo. – скорость электроосмоса
Электрофорез и электроосмос находят широкое применение в медико-биологических исследованиях:
§ для диагностики многих заболеваний;
§ для разделения аминокислот, нуклеиновых кислот,
антибиотиков, ферментов, антител, бактериальных
клеток;
§ для определения чистоты белковых препаратов.
Оптические свойства дисперсных систем
В зависимости от соотношения между диаметром 2 r частиц дисперсной фазы и длиной волны l, оптические свойства меняются.
Если 2 r @ l, в этом случае преобладает дифракционное рассеивание света. Визуально наблюдаем опалесценцию.
Опалесценцию впервые наблюдали в 1857 г. М. Фарадей и в 1868 г. Дж. Тиндаль. Это явление получило название эффекта Фарадея-Тиндаля (конус Тиндаля).
Уравнение Рэлея:
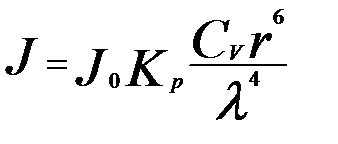
J, J0 – интенсивность рассеянного и падающего
света;
Kp – константа Рэлея;
Cv – частичная концентрация золя;
l - длина волны;
r - радиус частицы.
Строение мицеллы
По современным представлениям, коллоидные частицы представляют собой образования со сложной структурой – мицеллы. Мицелла состоит из электроней трального аппарата ® (ядра) и ионогенной части. Масса коллоидной частицы находится в основном в агрегате, которые состоит из сотен атомов, молекул. Агрегат в результате избирательной адсорбции ионов приобретает заряд. Эти ионы, концентрирующие вокруг агрегата, - потенциал определяющие ионы.
Агрегат + потенц. ионы ® ядро.
Далее – слой противоионов.
Потенциал опред. ионы + противоионы ® адсорбционный слой.
Рассмотрим на примере частицы AgJ.
AgNO3 + KJ ® AgJ + KNO3
Если AgNO3 и KJ взяты в эквивалентных количествах, то образуется осадок AgJ.
Если одно вещество взято в избытке, то оно будет играть роль стабилизатора.
Агрегат будут формировать ионы Ag+ и J-. Ионы Ag+ будут продолжать достраивать кристаллическую решетку ядра, прочно входя в его структуру и сообщая электрический заряд, определяющий электродинамический потенциал. Е – потенц./ионы – потенциалопределяющие ионы.
Величина потенциала может достигать 1 в, совершенно очевидно, что частицы с таким зарядом будут притягивать противоионы – NO3-. Образуется двойной электрический слой. Адсорбционный слой (потенц. ионы и противоионы).
Агрегат + адсорбционный слой ® гранула.
Гранула имеет электрический потенциал того же знака, что и электродинамический Е-потенциал, но меньший по величине, так как есть там противоионы (90 %).
Потенциал гранулы называется õ-потенциалом (электрокинетический) дзета. Далее удерживается остаток.