Перед началом опыта бюретка 2 должна находиться на таком расстоянии от поверхности лабораторного стола, чтобы ее можно было опустить вниз на 20-30 см.
бюретки закреплены штативом, скреплены между собой они шлангом.

На рисунке мы видим прикрепленный реакционный сосуд, внутри сосуда находится соляная кислота (HCl). В бюретках есть вода (деарированная). Выравниваем нижние хвостики бюреток 2 и 3, закрепляем.
Определяем цену деления бюретки: сравниваем 2 ближних деления – 48 и 50 мл.
2 мл/20 – 0,1 мл.
Хвостики бюреток привели в одинаковое положение. Уровни воды разные. Когда мы вынимаем пробку из положения 6, уровень воды стал одинаковым. Отводную трубку 6 пробирки 5 и пробку, закрывающую трубку, досуха протираем фильтровальной бумагой.
Полученный образец металла помещаем в отводную трубку и располагаем примерно на ее середине. Плотно закрываем отводную трубку пробкой, но металл не бросаем в пробирку. Видим, что уровень воды в бюретках опять изменился.
впервые выравниваем уровни.
Показания бюреток у нас стали такими:
правая бюретка – 20,9 мл;
Левая бюретка – 19 мл.
2. Проведение опыта. Приподнимаем пробирку 5 и переводим ее в положение 7. Постучим пальцем по отводной трубке пробирки, чтобы образец металла переместился из отводной трубки в кислоту.
Наблюдение:
Пробирка нагревается (реакция - экзотермическая),
выделяются пузырьки газа – водород – и
уровень жидкости изменился.
После начала реакции между металлом и кислотой переводим пробирку в первоначальное положение
По окончании реакции повторно выравниваем уровни жидкости в бюретках.
Запишем в лабораторный журнал положение уровня воды в бюретках:
правая бюретка – 32,6 мл;
Левая бюретка – 7,3 мл.
Уравнение реакции:
HCl+Me =H2+MeCl(x)
3. Проведение расчетов. Определяем экспериментальный коэффициент К - коэффициент, который зависит только от условий опыта и не зависит от массы металла.
K= 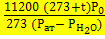
Где:
11200- эквивалентный объем молекулы водорода при Н.у.
t = 20 (температура)
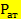 = 739 (атмосферное давление)
= 739 (атмосферное давление)
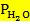 = 17,53 (парциальное давление паров воды)
= 17,53 (парциальное давление паров воды)
Таблица 1. Зависимость давления насыщенного водяного пара от to.
| t o C | РН2О | t o C | РН2О | ||
| Па | мм рт.ст | Па | мм рт.ст | ||
| 1497,2 | 11,23 | 2643,7 | 19,83 | ||
| 1598,5 | 11,99 | 2809,0 | 21,07 | ||
| 1705,1 | 12,79 | 2983,7 | 22,38 | ||
| 1817,1 | 13,63 | 3167,2 | 23,76 | ||
| 1947,1 | 14,53 | 3351,0 | 25,21 | ||
| 2063,8 | 15,48 | 3564,9 | |||
| 2197,1 | 16,48 | 3779,6 | |||
| 2337,8 | 17,53 | 4004,9 | 30,04 | ||
| 2486,5 | 18,63 | 4242,2 |
K= 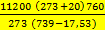 = 12662
= 12662
Рассчитаем молярную массу эквивалента при данной температуре и атмосферном давлении:
Mэкв(экспер)= 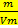 * K;
* K;
После расчета молярной массы эквивалента металла по результатам проведенного опыта идентифицируем металл по его молярной массе.
Для этого по формуле
M(Me) = nMэ(Me) рассчитываем молярную массу металла для трех значений валентности (степени окисления) n, равных 1,2 и 3.
По таблице Менделеева выбирается металл, проявляющий соответствующую валентность, для которого расхождение с табличными данными не велико.
Затем используя значения атомных весов таблицы Менделеева определяем теоретическое значение Mэ (теор)
Mэ (теор) = M(Me)/n
и ошибка экспериментального определения молярной массы эквивалента металла n по формуле:
ή=  * 100%;
* 100%;
если ошибка > 5%, опыт до получения меньшей или равной этому значению ошибки.
Контрольные вопросы и задачи:
1. Что такое эквивалент и молярная масса эквивалента вещества?
2. Как рассчитывается молярная масса эквивалента вещества для химических элементов и соединений различных классов (соли, оксиды, кислоты, основания), а также для соединений, проявляющих свойства окислителей или восстановителей?
3. Рассчитать молярную массу эквивалента перманганата калия KMnO4, рассматривая данное соединение как
а)соль;
б)окислитель, превращающийся в MnO(OH)2;
в) окислитель, превращающийся в MnSO4
4. Рассчитать молярную массу эквивалента азотной кислоты HNO3 рассматривая данное соединение как
а)кислоту;
б) окислитель, превращающийся в NO;
в) окислитель, превращающийся в NH3;
5. Какой объем окиси углерода CO, взятый при нормальных условиях, требуется для получения железа из 1 кг его оксида Fe2O3? (для решения задачи использовать молярные массы эквивалентов веществ).
6. Какок количество серной кислоты H2SO4 необходимо для реакции с 300 г. Оксида алюминия Al2O3 при условии образования средней соли Al2(SO4)3? (для решения задачи использовать молярные массы эквивалентов веществ).
[1] А.А.Гуров, Ф.З. Бадаев, Л.П. Овчаренко, В.Н. Шаповал «Химия», учебник для вузов, М.: МГТУ им. Н.Э. Баумана, 2007, с.34-52