Мы рассмотрим применение рефрактометрического метода анализа для определения поляризационных характеристик этилового спирта. Приведем результаты зависимости показателя преломления от концентрации водно-спиртового раствора. Сравним расчеты молярной рефракции этилового спирта методом аддитивности по атомам и по связям со значениями, полученными по экспериментальным данным.
Введение
Если компоненты органических смесей близки по своим свойствам, то количественный анализ органических смесей является непростой задачей. Для определения количественного соотношения компонентов в таких случаях приходится прибегать к хроматографическим, спектрометрическим и подобным методам. Это в свою очередь сопровождается использованием сложных современных приборов, доступных только в хорошо оснащенных научных лабораториях.
Достаточно простой и надежный метод, который позволяет решить эту задачу оперативно и с приемлемой степенью точности, основан на определении удельной рефракции смеси и ее компонентов. Для этого необходимы приборы, которые обычно есть в любой учебной лаборатории – аналитические весы, рефрактометр.
Оптический метод анализа – рефрактометрия – был предложен еще И. Ньютоном, но и в наше время широко используется для исследования свойств и строения веществ. Методы рефрактометрического анализа представляют собой достаточно простые операции, они не требуют большого количества вещества при проведении измерений, а также проводятся достаточно быстро. Современные приборы для рефрактометрического анализа достигают точности 10-3%. Этим методом можно определять строение органических и неорганических соединений, проводить идентификацию веществ, изучать растворы и смеси.
Для начала разберемся с теоретической частью:
Сама по себе рефракция представляет собой один из видов поляризации молекул, а именно электронную поляризацию под действием световых волн видимой части спектра. Остальные виды поляризации – ориентационная и атомная при прохождении видимого света через вещество не успевают реагировать на частоту колебаний этой области спектра (более 1014 герц), поскольку как молекулы, так и атомы слишком массивны и инерционны для этого. На столь короткие электромагнитные волны реагируют лишь электроны, масса которых в десятки и сотни тысяч раз меньше, чем у атомов и молекул.
В результате взаимодействия происходит деформация электронных оболочек и свет, проходящий через вещество, замедляется в той или иной степени, что количественно выражается через показатель преломления при переходе луча из одной фазы (воздуха) в другую.
В основе метода лежит свойство аддитивности, присущая как мольной, так и удельной рефракции. Оно заключается в том, что рефракция сложного вещества представляет собой сумму рефракций атомов, ионов, группировок, из которых состоит молекула, а также составляющих (инкрементов) кратных связей, двойных и тройных. Это позволяет при известной брутто-формуле рассчитать теоретическое значение рефракции, найти количество кратных связей и тем самым решить вопрос о строении молекул исследуемого вещества.
На величину молярной и удельной рефракции влияют, как и на поляризацию молекул вещества, такие физико-химические свойства вещества как плотность 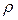 , диэлектрическая проницаемость среды
, диэлектрическая проницаемость среды 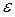 и поляризуемость
и поляризуемость 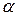 , которая зависит от строения молекулы.
, которая зависит от строения молекулы.
Поляризация Р молекулы связана с индивидуальными характеристиками молекулы формулой Дебая
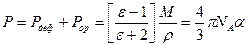 ,
,
где Рдеф – деформационная поляризация, Рор – ориентационная поляризация, NA – число Авогадро, М – молярная масса вещества.
Поскольку определение диэлектрической проницаемости вещества технически трудоемкая задача, используют связь диэлектрической проницаемости среды с показателем преломления вещества n (формула Максвелла)
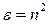 .
.
Тогда электронная поляризация и равная ей мольная рефракция RМ рассчитывается по формуле Лорентца-Лоренца
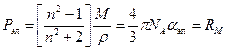 . (1)
. (1)
Мольная рефракция имеет размерность объема, отнесенного к 1 молю вещества, то есть она равна сумме объемов молекул одного моля вещества.
Объем обладает свойством аддитивности, то есть объем целого равен сумме объемов всех его составных частей, поэтому молярная рефракция обладает свойством аддитивности, которое можно записать выражением
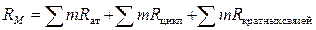 ,
,
где R ат – атомная рефракция, R цикл – рефракция циклов, R кратных связей – рефракция кратных связей, m- число атомов, циклов, кратных связей.
В физико-химических исследованиях пользуются также понятием удельная рефракция
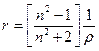 . (2)
. (2)
Экспериментальная часть
Измерения показателя преломления проводились на рефрактометре Аббе ИРФ 454, на котором можно определять значение показателя преломления с точностью до четвертого знака после запятой. Исследовались водно-спиртовые растворы этилового спирта (этанола С2Н5ОН). Плотность исследуемых растворов определялась методом взвешивания на аналитических весах 10 мл раствора.При измерениях показателя преломления учитывалась температура вещества, поскольку показатель преломления в зависимости от температуры изменяется в соответствии уравнением степенного ряда
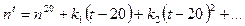 ,
,
где 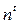 - показатель преломления при температуре t,
- показатель преломления при температуре t, 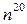 - показатель преломления при 20 0С,
- показатель преломления при 20 0С, 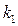 и
и 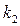 - температурные коэффициенты.
- температурные коэффициенты.
На призму рефрактометра наносились по 5-7 капель, измерения показателя преломления проводились быстро, чтобы избежать погрешности, связанной с летучестью спирта. Значения показателей преломления, пересчитанные на температуру 200 С, приведены в Таблице 1. Плотность исследуемых растворов определялась методом взвешивания на аналитических весах 10 мл раствора. Молярную массу этанола принимаем равной 46, 069 *10-3 кг/моль.
Таблица 1. Экспериментальные результаты измерений
| Показатель преломления n при t=20 0C | 1,3329 | 1,3396 | 1,3465 | 1,3525 | 1,3560 | 1,3621 | 1,3624 | 1,3645 | 1,3650 | 1,3642 | 1,3613 |
| Содержание спирта в растворе, об.% | |||||||||||
Плотность раствора 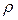 ,кг/м3 ,кг/м3
|
Уравнение градуировочного графика определим методом избранных точек. Из экспериментальных данных видно, что линейная зависимость между показателем преломления и содержанием спирта в растворе носит линейный характер не во всем диапазоне, а примерно до 50-60 об.%. Поэтому для расчета уравнения градуировочного графика выберем две точки на прямолинейном участке:
- для концентрации 10% - n= 1,3396;
- для концентрации 50% - n= 1,3621.
Составляем два уравнения прямой: 1,3621=А+50В и 1,3396=А+10В.
Решив эти уравнения, получим: А=1,3337; В=0,0005325=5,325*10-4.
Таким образом, искомое уравнение имеет вид:
n= 1,3337+5,325*10-4 С, (3)