РАЗЛОЖЕНИЕ АПАТИТА.
ПОЛУЧЕНИЕ И АНАЛИЗ
АЗОТНОКИСЛОТНОЙ ВЫТЯЖКИ
Учебно-методическое пособие
Киров 2014
УДК 661.5 (07)
М 69
Допущено к изданию методическим советом химического факультета ФГБОУ ВПО «ВятГУ» в качестве учебно-методического пособия для студентов, обучающихся по направлению 240100.62 «Химическая технология», профиля подготовки 240100.62.06 «Технология неорганических веществ» всех форм обучения.
Рецензент:
зав.кафедрой НиФХ ФГБОУ ВПО «ВятГУ»,
кандидат химических наук
Ю.Н.Ушакова
Михайлова, И.Ю.
М 69 Разложение апатита. Получение и анализ азотнокислотной вытяжки. Учебно-методическое пособие / И.Ю.Михайлова, В.А. Лихачев. – Киров: ФГБОУ ВПО «ВятГУ», 2014. – 18 с.
УДК 661.5 (07)
Учебно-методическое пособие предназначено для студентов, обучающихся по направлению 240100.62 «Химическая технология», профиля подготовки 240100.62.06 «Технология неорганических веществ», всех форм обучения для выполнения лабораторных работ по дисциплине «Химическая технология неорганических веществ».
Тех. редактор Е. В. Кайгородцева
© ФГБОУ ВПО «ВятГУ», 2014
СОДЕРЖАНИЕ
СОДЕРЖАНИЕ. 3
1. РАЗЛОЖЕНИЕ АПАТИТА.. 4
2. ПРИБОРЫИ РЕАКТИВЫ.. 8
3. ВЫПОЛНЕНИЕ РАБОТЫ.. 8
3.1. Получение азотнокислотной вытяжки. 9
3.2. Определение общего содержания азотной и фосфорной кислот. 12
3.3. Определение содержания фосфорной кислоты.. 12
3.4. Определение содержания кальция. 13
3.5. Обработка результатов. 13
4. ТЕХНИКА БЕЗОПАСНОСТИ.. 15
5. КОНТРОЛЬНЫЕ ВОПРОСЫ.. 16
6. СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ.. 17
РАЗЛОЖЕНИЕ АПАТИТА
Разложение фосфатов минеральными кислотами является одной из стадий получения комплексных минеральных удобрений.
Основным фосфатным сырьем в производстве таких удобрений на Кирово-Чепецком заводе минеральных удобрений является высококачественный Кольский апатитовый концентрат.
Минеральный состав апатитовых руд характеризуется содержанием: Р2О5 – 39 %, Са – 37 %, F – 3 %, Al2O3 – 0,5–0,9 %, Fe2O3 – 0,1–0,3 %, Sr – 2,5 %, MgO – 0,1–0,2 %, нерастворимый остаток – 0,2–1,5 %. Основу апатитов можно представить общей формулой Са5F(РО4)3.
Существуют несколько основных групп методов переработки фосфатов в комплексные фосфорсодержащие удобрения.
1) Методы, заключающиеся в разложении фосфатов серной кислотой с образованием простого суперфосфата или фосфорной кислоты и сульфата кальция.
2) Методы, основанные на разложении фосфатов фосфорной кислотой с получением монокальцийфосфата – двойного суперфосфата.
3) Методы азотнокислотной переработки фосфатного сырья с получением комплексных NP-, NPK-удобрений.
На заводе минеральных удобрений используется метод азотнокислотной переработки апатита. Преимущества этого метода:
ü комплексное использование сырья, с организацией практически безотходного производства;
ü применение азотной кислоты для разложения апатита позволяет использовать химическую энергию кислоты, а также ее ион, с которым в удобрение вводится дополнительный питательный компонент – азот;
ü не происходит кристаллизация образующихся продуктов реакции, что имеет место при использовании серной кислоты;
ü использование для разложения азотной кислоты собственного производства, что приводит к снижению себестоимости готовой продукции.
Технологическая схема на основе азотнокислотного вскрытия апатита и кристаллизации нитрата кальция включает следующие стадии:
1) разложение апатита азотной кислотой с получением азотнокислотной вытяжки (АКВ);
2) осветление АКВ; частичное удаление из нее твердой фазы, содержащей, в том числе, нитраты кальция и стронция;
3) выделение тетрагидратнитрата кальция (ТГНК) методом кристаллизации; удаление из АКВ нитрата кальция обусловлено тем, что кальций вреден в комплексных удобрениях из-за снижения доли растворимых усвояемых растениями фосфатов;
4) уравновешивание азотно-фосфорнокислого раствора (АФР) с помощью аммиачной селитры;
5) аммонизация уравновешенного АФР с помощью аммиака;
6) жидкостная конверсия нитрата кальция;
7) узел получения карбоната стронция.
Готовой продукцией цеха вскрытия апатитов является пульпа серого цвета аммонизированных азотно-фосфорных растворов (ААФР), являющаяся полуфабрикатом для различных марок сложных минеральных удобрений. ААФР представляет собой пульпу фосфатов аммония и кальция в водном растворе нитрата аммония.
Цель процесса азотнокислотного вскрытия апатита – перевод компонентов, содержащихся в апатитовом концентрате, в растворимую форму:
Ca5(PO4)3F + 11 HNO3 = 5 Ca(NO3)2 + HNO3 + 3 H3PO4 + HF. 1
Выделяющийся фтористый водород частично взаимодействует с SiO2, находящимся в апатите, с получением фторкремнистой кислоты.
6 HF + SiO2 = H2SiF6 + 2 H2O 2
Содержащиеся в апатите соединения стронция, магния, железа, алюминия, редкоземельных элементов взаимодействуют с азотной кислотой с образованием нитратов.
Sr3(PO4)2 + 6 HNO3 = 3 Sr(NO3)2 + 2 H3PO4 3
Для протекания реакции 1 оптимальной является норма азотной кислоты в количестве 110–120 % от стехиометрического количества, рассчитанного по содержанию СаО в фосфате. Она обеспечивает высокую скорость реакции, полноту вскрытия апатита и утилизацию ценных элементов при дальнейшей переработке. При уменьшении нормы кислоты снижаются скорость реакции и степень извлечения элементов. Увеличение нормы кислоты экономически не целесообразно и ухудшает кристаллизацию нитрата кальция и аммонизацию АФР.
Скорость разложения апатита азотной кислотой возрастает с повышением температуры вследствие снижения вязкости раствора и улучшения условий диффузии реагентов. Оптимальная температура процесса составляет 45–60 оС. При температуре ниже 45 оС не обеспечивается полнота вскрытия за время пребывания реакционной смеси в реакторе. При температуре выше 60 оС увеличивается коррозия аппаратуры и возрастает переход в газовую фазу оксидов азота и фтористых соединений.
Оптимальная температура поддерживается за счет теплового эффекта реакции. В ходе реакции выделяется тепло, за счет которого температура АКВ возрастает на 20–25 оС по сравнению с температурой входных реагентов, поэтому азотнокислый раствор поступает в реактор с температурой 25–35 оС.
Интенсивность перемешивания обеспечивается пропеллерными мешалками. При недостаточном перемешивании падает скорость реакции и снижается степень вскрытия апатита.
Для вскрытия апатита используют технологические азотнокислые оборотные растворы (АКО), получающиеся на различных стадиях производства: фосфорной кислоты, нитратных солей, карбоната стронция и представляют собой водные растворы азотной и фосфорной кислот, нитратов кальция, стронция и других элементов.
Для обеспечения оптимальной для вскрытия апатита концентрации азотной кислоты в АКО 36–44 % в реакторы подается 58 % охлажденная азотная кислота и вода из водооборотного цикла.
Разложение апатита проводят в многосекционном реакторе. Апатит, азотную кислоту и все технологические растворы подают в первую секцию реактора. Туда же вводят карбамид для предотвращения образования оксидов азота на стадии разложения. Подача апатита из бункера в реакторы осуществляется через последовательно расположенные весовые дозаторы. Азотнокислые оборотные растворы подаются с узла подготовки АКО. Время пребывания реакционной массы в реакторах составляет 2 часа.
В результате обработки апатита азотной кислотой получается жидкая и твердая фаза.
Жидкая фаза – раствор, содержащий фосфорную кислоту, нитрат кальция и некоторые другие нитраты, которые образуются при растворении оксидов металлов, содержащихся в фосфатном сырье в качестве примесей (Fe2O3 и Al2O3 и др.).
Твердая фаза – шлам, состоящий из неразложившегося апатита и нерастворимых примесей.
Отношение Т:Ж равно от (1:40) до (1:50). Это обусловлено переменным содержанием стронция в апатите и особенно нерастворимых в кислотах минералов – ильменита, нефелина, эгирина.
Таким образом, раствор – азотнокислотная вытяжка – представляет собой сложную многокомпонентную систему, полный анализ которой является громоздким и затруднительным. Практически для контроля процесса разложения апатита достаточно знать содержание в вытяжке свободной азотной и фосфорной кислот, общего количества азота и кальция.
Для установления степени разложения сырья необходимо определить содержание Р2О5 в растворе (водорастворимый Р2О5) и в твердой фазе (нерастворимый Р2О5).
Азотнокислотную вытяжку перерабатывают в конечный твердый продукт (сложные азотно-фосфорно-калийные удобрения), состоящий из фосфатов, нитратов и других соединений кальция, аммония, калия и магния. Этот состав зависит от способов ее дальнейшей переработки.
ПРИБОРЫИ РЕАКТИВЫ
Приборы, оборудование, материалы, посуда:
· установка для разложения природного апатита: магнитная мешалка с нагревом и поддержанием температуры, водяная баня, термометр, фторопластовый стакан емкостью 0,5 л, обратный холодильник;
· электронные весы;
· ступка с пестиком для растирания апатита;
· воронка Бюхнера и колба Бунзена для фильтрования под давлением;
· пипетки на 1 и 50 мл, мерная колба на 250 мл, мерные цилиндры на 25, 50 и 250 мл, бюретки на 25 мл, колбы на 250 мл для титрования.
Реактивы: природный апатитовый концентрат, растворы: HNO3 (45-60%-й), К2C2O4 (4%-й), NaOH (0,1н), трилона Б (0,1н), аммиачно-буферный раствор.
Индикаторы: метиловый оранжевый, фенолфталеин, хром темно-синий, универсальная индикаторная бумага.
ВЫПОЛНЕНИЕ РАБОТЫ
Цель работы: познакомиться с разложением апатита азотной кислотой. Опытным путем получить азотнокислотную вытяжку. Определить в полученной вытяжке содержание фосфорной и азотной кислот, а также кальция. Вычислить степень разложения апатита.
Получение азотнокислотной вытяжки
В работе моделируются две стадии вскрытия апатита:
1) разложение апатита азотной кислотой с получением АКВ;
2) осветление АКВ удалением из нее твердой фазы.
Разложение апатита азотной кислотой осуществляется на установке, схема которой представлена на рис. 1.
Работа заключается в разложении апатита азотной кислотой с последующим определением содержания свободной азотной и фосфорной кислот, кальция (в виде СаО), степени разложения апатита.
На электронных весах взвешивают примерно 25 г тонко измельченного в ступке апатита. По реакции 1 рассчитывают количество азотной кислоты, необходимое для разложения апатита, содержащегося в навеске. При этом учитываются следующие факторы:
ü содержание основного вещества в апатите 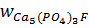 , %;
, %;
ü содержание азотной кислоты 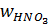 , %,;
, %,;
ü плотность азотной кислоты 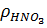 , г/см3;
, г/см3;
ü норма азотной кислоты, 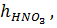 %.
%.

Рис. 1. Установка для разложения апатита, получения АКВ:
1 – реактор; 2 – водяная баня; 3 – магнитная мешалка с нагревом и поддержанием температуры; 4 – регулятор скорости вращения мешалки; 5 – спиртовый термометр; 6 – обратный холодильник
Количество азотной кислоты (мл) рассчитывают по формуле:
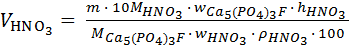 (1)
(1)
где m – масса апатита, г; 25 г.
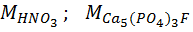 – молекулярные массы, г/моль.
– молекулярные массы, г/моль.
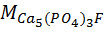 = 5 · 40 + 3 · 31 + 16 · 12 + 19 = 504.
= 5 · 40 + 3 · 31 + 16 · 12 + 19 = 504.
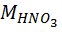 = 1 + 14 + 48 = 63.
= 1 + 14 + 48 = 63.
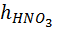 – норма кислоты, равная 110–120 % от стехиометрического количества.
– норма кислоты, равная 110–120 % от стехиометрического количества.
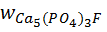 – содержание основного вещества в апатите, %; 96–98 %.
– содержание основного вещества в апатите, %; 96–98 %.
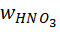 – содержание азотной кислоты, %; 50 %-я кислота.
– содержание азотной кислоты, %; 50 %-я кислота.
 – плотность кислоты, измеренная ареометром (1,24 г/см3) или найденная по справочнику для 50 %-й концентрации.
– плотность кислоты, измеренная ареометром (1,24 г/см3) или найденная по справочнику для 50 %-й концентрации.
Мерным цилиндром отмеряют рассчитанное количество азотной кислоты и помещают ее в реактор 1. Включают мешалку 3, пускают холодную воду в рубашку обратного холодильника 6 и нагревают содержимое стакана на водяной бане 2 до температуры 50–60 °С. Для нагрева водяной бани устанавливают интенсивность нагрева 250–350 °С и заданное значение температуры (55 °С) на табло термометра.
По достижении температуры 40 °С в реактор вносят навеску апатита и продолжают перемешивание. По достижении заданной температуры процесс ведут в течение 1–1,5 часов.
Затем содержимое реактора разбавляют 50 мл воды и фильтруют полученную пульпу с помощью вакуумного насоса через воронку Бюхнера. При фильтрации используют предварительно взвешенный двойной бумажный фильтр. Неразложившийся осадок на фильтре несколько раз промывают дистиллированной водой до рН 7–8, далее вместе с фильтром осадок переносят в сушильный шкаф и сушат 25–30 минут при температуре 50–60 °С. После охлаждения осадок с фильтром взвешивают и рассчитывают количество неразложившегося апатита.
Полученный фильтрат переносят в колбу на 250 мл и доводят водой до метки. Далее азотнокислотную вытяжку используют для определения содержания свободной азотной и фосфорной кислот, кальция, степени разложения апатита.
3.2. Определение общего содержания азотной и фосфорной кислот [4]
Пипеткой отбирают аликвоту 1 мл раствора вытяжки и переносят ее в коническую колбу на 250 мл, прибавляют 50 мл воды, три капли метилового оранжевого и титруют 0,1 н раствором NaOH до перехода окраски из красной в желтую.
Взаимодействие азотной и фосфорной кислот с гидроксидом натрия происходит по уравнениям реакций:
HNO3 + NaOH = NaNO3 + H2O, 4
H3РO4 + NaOH = NaН2РO4 + H2O. 5
Объем 0,1 н раствора NaOH (а, мл) используют для расчета содержания суммы кислот HNO3 и H3РO4.
3.3. Определение содержания фосфорной кислоты [4]
Пипеткой отбирают аликвоту 1 мл раствора вытяжки и переносят ее в коническую колбу на 250 мл, прибавляют 50 мл воды, 10 мл 4%-ного раствора оксалата калия К2C2O4, три капли фенолфталеина и титруют 0,1 н раствором NaOH до появления розового окрашивания.
Оксалат калия связывает ионы кальция, тем самым, исключая возможность выпадения двухзамещенного фосфата кальция при титровании:
Са(NO3)2 + К2С2O4 = СаС2O4 ↓+ 2КNO3. 6
В процессе титрования оттитровывается второй ион водорода фосфорной кислоты:
NaН2РO4 + NaOH = Na2НРO4 + H2O. 7
Объем 0,1 н раствора NaOH (b, мл) используют для расчета содержания H3РO4.
3.4. Определение содержания кальция [4]
Определение содержания кальция (в виде СаО) в вытяжке проводят методом комплексонометрического титрования 0,1 н раствора трилона Б (Na2R-(COOH)2) раствором вытяжки в присутствие индикатора хрома темно-синего:
Na2R-(COOH)2 + Са(NO3)2 = СаR-(COOH)2 + 2NaNO3. 8
Для этого в коническую колбу на 250 мл отбирают аликвоту 50 мл 0,1 н раствора трилона Б, добавляют 50 мл воды, 10 мл аммиачно-буферного раствора и три капли индикатора хрома темно-синего. Бюретку заполняют раствором вытяжки и титруют содержимое колбы до перехода окраски из фиолетовой в малиновую. Объем раствора вытяжки Vв, мл используют для расчета содержания кальция в вытяжке.
3.5. Обработка результатов [5]
Содержание азотной и фосфорной кислот (г/л) рассчитывают по формулам:
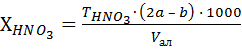 , (2)
, (2)
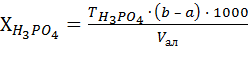 , (3)
, (3)
где 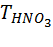 – титр 0,0063 г/см3. М(HNO3) = 63 г/моль.
– титр 0,0063 г/см3. М(HNO3) = 63 г/моль.
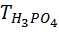 – титр 0,0098 г/см3. М(H3PO4) = 98 г/моль.
– титр 0,0098 г/см3. М(H3PO4) = 98 г/моль.
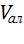 – объем аликвоты, см3;
– объем аликвоты, см3; 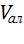 = 1 см3.
= 1 см3.
а и b – количество 0,1 н раствора NaOH, пошедшее на титрование первой (в присутствие метилового оранжевого) и второй (в присутствие фенолфталеина) проб, мл;
Содержание кальция в виде СаО (г/л) определяют по формуле:
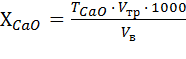 , (4)
, (4)
где 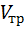 – объем трилона Б, см3; 50 см3
– объем трилона Б, см3; 50 см3
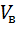 – объем вытяжки, пошедшей на титрование, см3;
– объем вытяжки, пошедшей на титрование, см3;
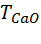 – титр CaO по 0,1 н раствору трилона Б, г/см3;
– титр CaO по 0,1 н раствору трилона Б, г/см3;
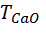 = 56 / (2 · 1000) = 0,0028 г/см3; М(СаО) = 56 г/моль.
= 56 / (2 · 1000) = 0,0028 г/см3; М(СаО) = 56 г/моль.
Степень разложения апатита К определяют по отношению водорастворимого или усвояемого Р2О5 к общему содержанию оксида фосфора (V). Этот метод трудоемок и требует значительного времени. Поэтому в работе степень разложения апатита вычисляют по отношению содержания кальция (в пересчете на Р2О5) в вытяжке к содержанию СаО и Р2О5 в исходном сырье.
Степень разложения апатита (%) по СаО и Р2О5 вычисляют по формулам:
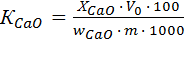 , (5)
, (5)
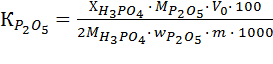 , (6)
, (6)
где 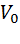 – объем вытяжки (фильтрата и промывных вод), см3; 250 см3.
– объем вытяжки (фильтрата и промывных вод), см3; 250 см3.
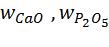 – содержание СаО и Р2О5 в апатите Ca5(PO4)3F, доли единицы;
– содержание СаО и Р2О5 в апатите Ca5(PO4)3F, доли единицы; 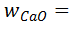 56 · 5 / 504 = 0,555;
56 · 5 / 504 = 0,555; 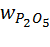 = 3 · 142 / (2 · 504) = 0,423.
= 3 · 142 / (2 · 504) = 0,423.
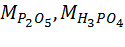 – молярные массы Р2О5 и H3PO4, г/моль; М(P2O5) = 142 г/моль, М(H3PO4) = 98 г/моль.
– молярные массы Р2О5 и H3PO4, г/моль; М(P2O5) = 142 г/моль, М(H3PO4) = 98 г/моль.
m – масса апатита, г;
Полученные результаты опытов заносят в табл. 1.
Таблица 1
Экспериментальные результаты
| Навеска апатита, г | Объем вытяжки, см3 | Результаты титрования, см3 | Содержание компонентов, г/л | Степень разложения, % | |||||
| m | Vo | VNaOH | Vв | 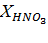
| 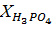
| 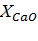
| 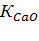
| 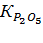
| |
| a | b | ||||||||
Результаты эксперимента сравнивают с теоретическими, рассчитанными по уравнению реакции 1, и делают выводы о степени разложения апатита. Полученную азотнокислотную вытяжку сохраняют до следующей лабораторной работы «Нитрофоска. Получение и анализ готового продукта».
ТЕХНИКА БЕЗОПАСНОСТИ
Студенты допускаются к работе только после прохождения инструктажа по технике безопасности, изучения инструкций и росписи в журнале.
В целях безопасности ведения лабораторной работы следует выполнять следующие правила:
ü Выполнять работу строго по методическим указаниям.
ü Работать в халате, в случае необходимости использовать индивидуальные средства защиты.
ü Не разрешается оставлять включённую установку без наблюдения.
ü Строго соблюдать правила работы со стеклянной посудой, реактивами и электроприборами, изложенные в общей инструкции по технике безопасности в химической лаборатории.
ü Работать с концентрированной азотной кислотой в вытяжном шкафу.
ü Сливать отработанные растворы в специально предназначенные для этих целей ёмкости.
ü Знать правила оказания первой помощи при работе со стеклом, с термическими и химическими ожогами.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какими кислотами разлагают природные фосфаты?
2. Какой минерал служит сырьем для производства сложных удобрений на Кирово-Чепецком ЗМУ?
3. Какие преимущества дает использование азотной кислоты для разложения апатита?
4. Для получения каких видов удобрений применяется азотнокислотное разложение фосфатов?
5. Как получают сложные удобрения?
6. В чем сущность разложения апатита?
7. Каков температурный режим разложения апатита?
8. Что используют на производстве для вскрытия апатита?
9. Какой концентрации используют азотную кислоту для разложения апатита? Почему берут избыток сверх стехиометрии?
10. Какие факторы учитывают при расчете азотной кислоты?
11. Какой состав жидкой или твердой фаз при азотнокислотном разложении?
12. Что представляет собой азотнокислотная вытяжка?
13. Как определяют содержание азотной и фосфорной кислот?
14. Для чего добавляют оксалат калия при определении содержания фосфорной кислоты?
15. В чем состоит сущность определения кальция в вытяжке?
16. В чем сущность комплексонометрического титрования?
17. Как определяют степень разложения апатита?
18. Для производства каких удобрений применяется азотнокислотная вытяжка?
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1. Технология фосфорных и комплексных удобрений [Текст] / Под ред. С. Д. Эвенчика, А. А. Бродского. – М.: Химия, 1987. – 464 с.
2. Кувшинников, И. М. Минеральные удобрения и соли [Текст] / И. М. Кувшинников. – М.: Химия, 1987. – 256 с.
3. Позин, М.Е. Технология минеральных удобрений [Текст] / М. Е. Позин. – М.: Химия, 1989. – 352 с.
4. Основы аналитической химии [Текст] / Под ред. Ю.А.Золотова. – М.: Высш. шк., 2004. – 412 с.
5. Руководство к практическим занятиям по технологии неорганических веществ [Текст] / Под ред. М. Е. Позина. – Л.: Химия, 1980. – 380 с.
Учебное издание
Михайлова Инна Юрьевна
Лихачев Владислав Александрович
РАЗЛОЖЕНИЕ АПАТИТА.
ПОЛУЧЕНИЕ И АНАЛИЗ
АЗОТНОКИСЛОТНОЙ ВЫТЯЖКИ
Учебно-методическое пособие
Подписано в печать _______2014 года. Печать цифровая. Бумага для офисной техники.
Усл. печ. л._____. Тираж 15. Заказ № _____
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования«Вятский государственный университет»
610000, г. Киров, ул. Московская, 36.