1. Налить из бюретки в стакан 10 мл исследуемого раствора кислоты и погрузить в него электроды. Если электроды не полностью погружены в раствор, нужно добавить дистиллированной воды до уровня их погружения. 2. Измерить сопротивление раствора с помощью реохордного моста.
3. Из другой бюретки порциями по 1 мл прилить 15 мл раствора щелочи. После добавления каждой порции раствор механически перемешивать и измерять сопротивление. Результаты записывать в тетрадь.
На основании полученных данных
1. Построить график, откладывая на оси ординат сопротивление (или электропроводность) раствора, а на оси абсцисс - количество
щелочи, мл.
2. Используя уравнение (2.49), рассчитать нормальность кислоты.
3. Написать в молекулярном и ионном видах уравнение исследованной реакции.
КОНТРОЛЬНЫЕ ВОПРОСЫИ ЗАДАЧИ
1. Приведите пример любой окислительно-восстановительной реакции, протекающей в жидкой фазе, опишите изменение состава изучаемой системы и соответственно изменение электропроводности раствора в процессе реакции по мере прибавления реагента к исходному веществу, определите точку эквивалентности.
2. Сколько г-экв кислоты присутствовало в растворе, если при титровании ее 0,1 н раствором щелочи точка эквивалентности соответствует 20 мл щелочи?
3. Определите по значениям подвижностей ионов ход кривой кондуктометрического титрования раствора AgN03 раствором HС1.
Работа № 5. Потенциометрическое титрование
Цель работы – физико-химическое исследование свойств растворов электролитов методом потенциометрии − кислотности среды, концентрации раствора, определение степени и константы диссоциации веществ.
Оборудование
1. рН-метр (рН-340 или ЛПУ-01) с датчиком.
2. Две бюретки с воронками.
Последовательность выполнения работы
1. Включить рН-метр в электросеть и дать ему прогреться 10−15 мин. Изучить инструкцию к прибору.
2. В чистый стаканчик из бюретки точно отмерить 20 мл испытуемого раствора (по указанию преподавателя).
3. Освободив столик со стаканчиком от креплений, извлечь электроды из дистиллированной воды и осторожно осушить их фильтровальной бумагой.
4. Погрузить электроды в испытуемый раствор и измерить значение рН раствора.
5. Из другой бюретки при непрерывном перемешивании добавлять в стаканчик с испытуемым раствором по 1 мл раствора щелочи известной концентрации. После каждой порции измерять и записывать значения рН раствора. Общее количество добавленной щелочи не должно превышать 15 мл.
6. Для более точного измерения повторить опыт, уменьшая порции щелочи до 0,5 мл в интервале резкого изменения рН. Результаты измерений занести в таблицу.
Испытуемый раствор_________________
Концентрация щелочи________________
| Объем приливаемой щелочи | рН | ∆рН/∆V |
7. По окончании работы промыть электроды дистиллированной водой и оставить их погруженными в стаканчик с дистиллированной
водой.
8. По результатам опыта:
а). Построить интегральную потенциометрическую кривую в координатах: рН − объем щелочи (мл) и дифференциальную кривую в координатах: ∆рН/∆V − объем щелочи.
б). По интегральной кривой определить рН в точке эквивалентности и рассчитать концентрацию ионов гидроксила ОН-.
в). По дифференциальной кривой определить объем раствора щелочи в точке эквивалентности и рассчитать концентрацию испытуемого раствора, используя уравнение (2.49).
КОНТРОЛЬНЫЕ ВОПРОСЫИ ЗАДАЧИ
1. Как определяется точка эквивалентности на кривой потенциометрического титрования и какой состав раствора ей соответствует?
2. Как выглядит кривая потенциометрического титрования раствора NaОН раствором H2SO4? Каково значение рН в точке эквивалентности в данном случае?
3. По кривой титрования, полученной в работе, определите концентрацию ионов Н+ и ОН- в точке эквивалентности.
4. Определите рН 0,1 н раствора NaОН (α = 100%).
Работа № 6. Определение константы диссоциации слабой кислоты и константы гидролиза соли
Цель работы – определение физико-химических констант электролитов: константы диссоциации уксусной кислоты и константы гидролиза уксуснокислого натрия.
Оборудование
1. рН-метр (рН-340) с датчиком.
2. Четыре стеклянные колбочки.
3. Мерные цилиндры.
Последовательность выполнения работы
Опыт 1.
1. Приготовить в четырех колбах по 30 мл раствора уксусной кислоты СН3СООН разной концентрации (см. табл.), разбавляя дистиллированной водой исходный раствор – О,1 н СН3СООН.
2. Измерить рH растворов на рН-метре (описание прилагается к прибору).
3. Полученные результаты оформить в таблицу.
| Концентрация СН3СООН С, г-экв/л) | 0,1 н | 0,05 н | 0,025 н | 0,0125 н |
| pH | ||||
| lgC | ||||
| pK |
5. Построить график зависимости рН от логарифма концентрации, отложив по оси абсцисс логарифм концентрации кислоты, а по оси ординат − значения рН. Провести экстраполяцию (продление) полученной прямой на ось ординат. Отрезок, отсекаемый прямой на оси ординат,
соответствует значению 1/2 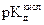 .
.
6. Рассчитать 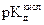 по уравнению
по уравнению
рН = 1/2 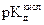 - 1/2 lgС
- 1/2 lgС
для всех концентраций, найти ее среднее значение и сравнить со значением 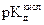 , полученным графически. Определить
, полученным графически. Определить  .
.
Опыт 2
1. Для определения константы гидролиза ацетата натрия СН3СООNa приготовить по 30 мл растворов соли разной концентрации (согласно табл. 6.2), разбавляя дистиллированной водой исходный раствор 0,1 н СН3СООNa.
2. Измерить рН растворов на рН-метре.
3. Полученные результаты записать в таблицу
| Концентрация CH3COONa С, г-экв/л | 0,1 н | 0,05 н | 0,025 н | 0,0125 н |
| pH | ||||
| lgC |
4. По данным таблицы построить график, отложив по оси ординат рН, а по оси абсцисс lgC. проведя экстраполяцию полученной прямой на ось ординат. Отрезок, отсекаемый прямой на оси ординат, соответствует значению 14 – 1/2 lgКГ.
5. Определить Кг и сравнить значение Кг с рассчитанной по формуле
Кг = К Н2О/ 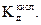 Величину
Величину  взять из предыдущего опыта,
взять из предыдущего опыта,
а К Н2О = 10-14.
КОНТРОЛЬНЫЕ ВОПРОСЫИ ЗАДАЧИ
1. Дайте определение константы диссоциации электролита. В чем заключается ее физический смысл? Обоснуйте влияние различных факторов на величину константы диссоциации.
2. Пользуясь законом разведения, рассчитайте степень диссоциации 0,01 М раствора HF, если константа диссоциации 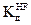 = 10-2.
= 10-2.
3. Дайте определение рН раствора и рассчитайте, чему равен рН 0,001 н раствора КОН (α = 1).
4. Какие химические процессы подразумевают, применяя термин «гидролиз солей»? Какие соли дают при гидролизе кислую, а какие щелочную среду?
5. Напишите в ионной и молекулярной форме уравнения реакций гидролиза раствора соли Na2CO3.