Инфаркт миокарда
Инфаркт миокарда - одна из клинических форм ишемической болезни сердца, протекающая с развитием ишемического некроза участка миокарда, обусловленного абсолютной или относительной недостаточностью его кровоснабжения.
Классификация инфаркта миокарда:
По периодам развития:
-продромальный период (от 30 минут до 30суток);
-острейший период (до 2 часов от начала ИМ);
-острый период (5-7 дней от начала ИМ);
-подострый период (с 7 до 28 дня);
-период рубцевания (с 28 дня).
По анатомии поражения:
1. Трансмуральный.
2. Интрамуральный.
3. Субэндокардиальный.
4. Субэпикардиальный.
По объёму поражения:
1. Крупноочаговый (трансмуральный), Q-инфаркт
2. Мелкоочаговый, не Q-инфаркт
По локализации очага некроза:
1. Инфаркт миокарда левого желудочка (передний, боковой, нижний, задний).
2. Изолированный инфаркт миокарда верхушки сердца.
3. Инфаркт миокарда межжелудочковой перегородки (септальный).
4. Инфаркт миокарда правого желудочка.
5. Сочетанные локализации: задне-нижний, передне-боковой и др.
Факторы риска развития инфаркта миокарда:
1. Атеросклероз (образование атеросклеротических бляшек на стенках сосудов – основной фактор риска в развитии инфаркта миокарда).
2. Возраст (риск развития заболевания повышается после 45-50 лет).
3. Пол (женщины страдают в 1,5-2 раза чаще, чем мужчины).
4. Гипертоническая болезнь.
5. Курение.
6. Ожирение
7. Гиподинамия
8. Сахарный диабет
Этиология:
Инфаркт миокарда развивается в результате обтурации просвета сосуда кровоснабжающего миокард (коронарная артерия).
Причинами могут стать:
1. Атеросклероз коронарных артерий (тромбоз, обтурация бляшкой).
2. Хирургическая обтурация (перевязка артерии или диссекция при ангиопластике).
3. Эмболизация коронарной артерии (тромбоз при коагулопатии, жировая эмболия т. д.).
4. Спазм коронарных артерий.
5. Инфаркт при пороках сердца (аномальное отхождение коронарных артерий от аорты).
Ремоделирование миокарда:
Морфологические и нейрогормональные изменения, происходящие при инфаркте миокарда, приводят к так называемому ремоделированию левого желудочка. Термином «ремоделирование» обозначают комплекс структурных компенсаторных изменений сердца, возникающих в результате различных патологических процессов. В процессе ремоделирования происходит «перераспределение» кардиомиоцитов с усилением сократительной способности одних отделов и ослаблением других. Например, при инфаркте миокарда ремоделирование заключается в неравномерном изменении толщины стенки левого желудочка – в зоне инфаркта возникает истончение (за счет «растягивания» некротизированного миокарда сокращающимися прилегающими кардиомиоцитами), вокруг зоны инфаркта за счет тех же механизмов стенка сердца несколько утолщается. Итогом выступает растяжение полости левого желудочка. В последующем, после организации соединительнотканного рубца, ремоделирование сохраняется, хотя и претерпевает некоторое обратное развитие.
На выраженность процессов ремоделирования сердца при инфаркте миокарда влияют несколько факторов:
-размер некроза;
-локализация некроза;
-степень стенозирования коронарной артерии, снабжающей кровью область инфаркта миокарда;
-факторы, влияющие на напряжение стенки миокарда.
Постинфарктное ремоделирование сердца сопровождается его расширением, которое характеризуется непропорциональным растяжением и истончением пораженного сегмента миокарда с дилатацией левого желудочка.
-Дилатация непораженных участков миокарда вначале носит компенсаторный характер и направлена на восстановление ударного объема для поддержания системной гемодинамики.
-Ранняя дилатация пораженного участка миокарда приводит к напряжению стенки последнего, вызывая гипертрофию стенки левого желудочка вследствие перегрузки «объемом».
Перечисленные адаптационные изменения влияют на течение инфаркта миокарда. С ними связаны левожелудочковая недостаточность. Аневризмы сердца, а также разрывы сердца.
Патогенез:
Основной патофизиологический механизм развития инфаркта миокарда – несоответствие между потребностью миокарда в кислороде и возможностями коронарного кровотока. В очаге нарушения кровообращения в миокарде снижается концентрация АТФ и креатинфосфата при одновременном увеличении содержания АДФ, что приводит к активации и распаду митохондрий, контрактуре и некробиозу миофибрилл, т.е. возникает некроз миокарда. Наличие зоны ишемии, окруженной некротизированными тканями, приводит к электрофизиологической недостаточности миокарда, что способствует возникновению аритмий, опасных для жизни.
Течение инфаркта миокарда:
В течение инфаркта миокарда выделяют следующие периоды:
-продромальный;
- острейший;
- острый;
-подострый;
-период рубцевания.
Длительность каждого из них напрямую зависит от:
- площади очага поражения;
-функциональности сосудов питающих сердечную мышцу;
-сопутствующих осложнений;
-правильности лечебных мероприятий;
-соблюдения пациентом рекомендованных режимов.
Продромальный период: характеризуется появлением или учащением привычных приступов стенокардии; длительность – от 30 мин до 30 дней.
Острейший период: от начала приступа стенокардии до появления признаков некроза сердечной мышцы на ЭКГ; длительность - несколько часов. По основным клиническим проявлениям в острейшем периоде различают варианты:
-ангинозный;
- астматический;
- абдоминальный;
- аритмический;
-церебральный;
-безболевой.
Самый частый вариант – ангинозный. Боль тяжелая, сжимающая, разрывающая, иррадиирует в верхние конечности, реже в область живота, спины, захватывая нижнюю челюсть и шею. Больной беспокоен, бледен, дыхание учащено, он мечется. Отмечаются выраженные вегетативные реакции: слабость, потливость, тошнота, рвота, головокружение, возбуждение. Отмечено, что при сердечных и дыхательных проблемах люди испытывают сильный страх смерти. Важным диагностическим признаком является то, что болевой синдром не реагирует на нитроглицерин, и практически не уменьшается от приёма традиционных обезболивающих препаратов. Эти первые симптомы инфаркта миокарда настолько распространены и типичны, что другие виды боли считаются нетипичными.
Острый период в среднем при инфаркте с крупным очагом без осложнений длиться около 10 суток. Это самый сложный период болезни, во время него ограничивается очаг поражения, начинается замена некротической ткани грануляционной. В это время могут возникать наиболее грозные осложнения, наиболее высока летальность. К окончанию периода начинают возвращаться к норме анализы крови, улучшаются показатели электрокардиограммы. Пациента переводят из реанимационной палаты в кардиологическое отделение.
Подострый период продолжается приблизительно до 30 дня с момента развития инфаркта. Идёт замещение поражённой зоны соединительной тканью, улучшаются: общее состояние больного, цифры артериального давления, частота пульса, данные кардиограммы. Нормализуются реологические свойства крови. Пациенту расширяют режим, в комплекс терапии вводят лечебную гимнастику. Оканчивается этот период переводом пациента на санаторно-курортное лечение для долечивания. И на этой стадии у больного могут возникать осложнения, которые могут удлинить её продолжительность.
Период рубцевания в лучшем случае длится до 8 недель, но в некоторых случаях может удлиняться до 4 месяцев. Как видно из названия в этот период происходит окончательное заживление зоны поражения способом рубцевания. Рубец от излеченного инфаркта, определяется на кардиограмме всю оставшуюся жизнь.
Большую медицинскую проблему создают малосимптомные или «немые» инфаркты. Они обычно бывают случайной находкой на кардиограммах в виде рубцовых изменений и протекают с очень скудной симптоматикой: характеризуются состоянием общей слабости, повышенной утомляемостью, гипотонией, с умеренно увеличенной частотой сердечных сокращений.
Астматический вариант наблюдается чаще у пожилых людей, длительно страдающих гипертонической и ишемической болезнями. Классические симптомы инфаркта сопровождаются у них отёком легких.
Аритмический вариант - начинается с приступа аритмии, где она же и выступает ведущим симптомом. Подтверждение диагноза находят на кардиограмме.
Церебральный вариант: характерны головная боль, чувствительные и двигательные расстройства, тошнота, рвота, нарушения зрения. Сердечная симптоматика может быть стертой. Сложность диагностики заключается в том, что инсульт это по своей сути инфаркт мозга, то есть эти две патологии могут сочетаться у одного больного.
Абдоминальный (гастралгический) вариант: как правило начинается с резкой боли в области желудка, тошноты, рвоты, вздутия живота. При пальпации: живот болезненный, мышцы напряжены. Часто принимают абдоминальную форму инфаркта за прободную язву или острый панкреатит.
Диагностика инфаркта миокарда:
Физикальные исследования варьируют от полной нормы до выраженных отклонений (расширение верхушечного толчка, появление 3 и 4 тона, ослабление тонов, появление влажных хрипов в легких и др.). Ни один из этих признаков не подтверждает, но и не исключает наличие ИМ. Диагностика ИМ основана на выявлении маркеров повреждения сердечной мышцы.
ЭКГ-признаки инфаркта миокарда:
-отсутствие зубца R в отведениях, расположенных над областью инфаркта;
-появление патологического зубца Q в отведениях, расположенных над областью инфаркта;
-подъем сегмента S-T выше изолинии в отведениях, расположенных над областью инфаркта;
-дискордантное смещение сегмента S-T ниже изолинии в отведениях, противоположных области инфаркта;
-отрицательный зубец Т в отведениях, расположенных над областью инфаркта.

| № п/п | ЭКГ признаки | Крупноочаговые инфаркты | Мелкоочаговые инфаркты | ||
| Транс-муральный | Субэпи-кардиаль-ный | Интраму-ральный | Субэндо-кардиаль-ный | ||
| 1. | Зубец R | Отсутствует в отведениях над областью инфаркта | Уменьшен в амплитуде над областью инфаркта | Не изменен | Не изменен |
| 2. | Патологический зубец Q | Имеется в отведениях над областью инфаркта | Имеется в отведениях над областью инфаркта | нет | Нет |
| 3. | Подъем сегмента S-T выше изолинии | В отведениях, расположенных над областью инфаркта | В отведениях, расположенных над областью инфаркта | нет | Нет |
| 4. | Депрессия сегмента S-T | В отведениях, противоположных области инфаркта | В отведениях, противоположных области инфаркта | нет | Более 0,2мВ в отведениях, расположенных над областью инфаркта |
| 5. | Отрицательный зубец Т | Появляется в подострой стадии в отведениях над областью инфаркта | Появляется в подострой стадии в отведениях над областью инфаркта | Сохраняется 12-14 дней в отведениях, расположенных над областью инфаркта | Не имеет диагностического значения |
| Отведения | Отделы сердца, отображаемые отведением |
| I | Передняя стенка сердца |
| II | Суммационное отображение I и III |
| III | Задняя стенка сердца |
| aVR | Правая боковая стенка сердца |
| aVL | Левая передне-боковая стенка сердца |
| aVF | Задне-нижняя стенка сердца |
| V1 иV2 | Правый желудочек |
| V3 | Межжелудочковая перегородка |
| V4 | Верхушка сердца |
| V5 | Передне-боковая стенка левого желудочка |
| V6 | Боковая стенка левого желудочка |
Биохимическая диагностика инфаркта миокарда:
Среди кардиоспецифических ферментов следует отметить креатенинфосфокиназу МВ-фракцию (КФК-МВ), лактатдегидрогеназу 1 и 2 изоферменты. Попадание этих ферментов в кровь происходит в результате гибели миокардиоцитов.
Экспресс –диагностика инфаркта миокарда:
Применяется качественный иммунологический тест определения в венозной крови специфического миокардиального белка – тропонина-Т. При инфаркте миокарда он начинает определяться через 2-3 часа с момента развития некроза, достигая двух пиков повышения концентрации в крови: к 8-10-ти часам и к 3-м суткам заболевания. Нормализация концентрации тропонина-Т происходит через 10-14 суток. Специфичность теста – 100%. Тест очень прост в исполнении: на специальную полоску наносят 150мкл крови и через 20 минут считают результат. При наличии инфаркта миокарда (концентрация тропонина-Т больше 0,2нг/мл) на полоске появляются две линии. При отсутствии такового – на полоске определяется одна линия.
Лечение инфаркта миокарда:
Основные принципы лечения инфаркта миокарда:
1) устранение болевого синдрома;
2) устранение несоответствия между энергетическими запросами миокарда и возможностями его кровоснабжения;
3) борьба с тромбообразованием в системе коронарных и других сосудистых бассейнов;
4) коррекция электролитного и кислотно-основного состояния;
5) предупреждение и ликвидация нарушений ритма и проводимости;
6) предотвращение распространения зоны инфаркта миокарда.
При возникновении осложнений проводится их лечение.
Основные принципы помощи до приезда в стационар – адекватное обезболивание и профилактика тромбоза.
При этом применяют:
-Нитроглицерин под язык;
-Введение анальгетиков (промедол, морфин);
-Аспирин или гепарин;
-Антиаритмические препараты при необходимости.

Осложнения инфаркта миокарда:
По времени появления осложнения инфаркта миокарда классифицируют на:
1). ранние осложнения — возникают в первые часы (нередко на этапе транспортировки больного в стационар) или в острейший период (3-4 дня): -нарушения ритма и проводимости, вплоть до ФЖ и полной АВ-блокады (самые частые осложнения и причина летальности на догоспитальном этапе). У большей части больных аритмии возникают во время пребывания в отделении интенсивной терапии и реанимации (ОИТР);
- внезапная остановка сердца;
- острая недостаточность насосной функции сердца — ОЛЖН и КШ;
-разрывы сердца — наружные, внутренние; медленнотекущие, одномоментные;
-острая дисфункция сосочковых мышц (митральная регургитация);
2). поздние осложнения (возникают на 2—3-й неделе, в период активного расширения режима):
- постинфарктный синдром Дресслера;
- пристеночный тромбоэндокардит;
-ХСН;
-нейротрофические расстройства (плечевой синдром, синдром передней грудной стенки).
Профилактика инфаркта миокарда разделяется на первичную и вторичную:
Первичная профилактика направлена на предупреждение болезни. В нее входят стандартные предосторожности, основные из которых: повышение физической активности, контроль массы тела и отказ от вредных привычек. Кроме того, нормализация артериального давления и липидного спектра крови. Для первичной профилактики инфаркта у пациентов со стенокардией и повышенным артериальным давлением обязательно необходимо использовать ацетилсалициловую кислоту (АСК) – «золотой стандарт» лекарственной профилактики инфаркта миокарда.
Все эти мероприятия справедливы и для вторичной профилактики (предупреждения повторного инфаркта).
Кардиогенный шок
Кардиогенный шок - одно из тяжелейших осложнений ИМ. Его частота составляет 10-15 %. Наиболее часто он развивается в течение первых часов после проявления клинических признаков инфаркта миокарда и значительно реже - в более поздний период.
Кардиогенный шок – это крайняя степень нарушения кровообращения, сопровождающаяся уменьшением сердечного выброса, то есть неспособностью сердца выталкивать кровь в сосуды, падением артериального давления.
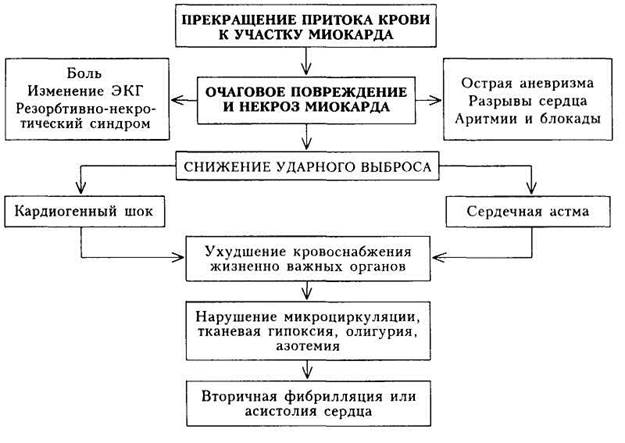
Кардиогенный шок является острой левожелудочковой недостаточностью крайней степени тяжести. Уменьшение ударного и минутного объема крови при шоке настолько выражено, что не компенсируется повышением сосудистого сопротивления, вследствие чего резко снижаются артериальное давление и системный кровоток, нарушается кровоснабжение всех жизненно важных органов.
Кардиогенный шок приводит к глубоким нарушениям кровоснабжения всех органов и тканей, вызывая расстройства микроциркуляции и образование микротромбов (ДВС-синдром). В итоге нарушаются функции головного мозга, развиваются явления острой почечной и печеночной недостаточности, в пищеварительном канале могут образоваться острые трофические язвы. Нарушение кровообращения усугубляется плохой оксигенизаций крови в легких вследствие резкого снижения легочного кровотока и шунтирования крови в малом круге кровообращения, развивается метаболический ацидоз.
Характерной особенностью кардиогенного шока является формирование так называемого порочного круга. Известно, что при систолическом давлении в аорте ниже 80 мм.рт.ст. коронарная перфузия становится неэффективной. Снижение артериального давления резко ухудшает коронарный кровоток, приводит к увеличению зоны некроза миокарда, дальнейшему ухудшению насосной функции левого желудочка и усугублению шока.
Причины кардиогенного шока:
Кардиогенный шок может развиться при:
-обширном инфаркте миокарда, когда повреждено более 40 % сердечной мышцы;
-остром миокардите;
-разрыве межжелудочковой перегородки сердца;
-аритмиях;
-острой недостаточности клапанов сердца;
-остром стенозе клапанов сердца;
-массивной эмболии легочной артерии (полной закупорке легочной артерии, в результате которой кровообращение становится невозможным).
Степени кардиогенного шока:
Существует три степени кардиогенного шока:
-I степень, при которой артериальное давление в пределах 90/50-60/40 мм. рт. ст., пациент находится в сознании, симптомы сердечной недостаточности выражены слабо;
-II степень, при которой артериальное давление в пределах 80/50-40/20, коллапс выражен слабо, явно выражены симптомы острой сердечной недостаточности;
-III степень, при которой болевой приступ длится несколько часов, сопровождаясь тяжелым коллапсом, артериальное давление резко снижено, симптомы острой сердечной недостаточности нарастают, развивается отек легких.
Группы риска:
Кардиогенного шока нужно опасаться:
-пациентам с обширным инфарктом миокарда;
-страдающим сахарным диабетом;
-пожилым;
-работающим с кардиотоксическими веществами.
Виды кардиогенного шока:
Специалисты выделяют несколько видов кардиогенного шока:
-истинный кардиогенный шок, который развивается из-за резкого снижения сократительной способности миокарда;
-рефлекторный кардиогенный шок, который развивается из-за тяжелейшего болевого приступа;
-аритмический кардиогенный шок, который развивается из-за нарушения ритма сердца, чаще всего, из-за желудочковой тахикардии;
-некоторые врачи в отдельную группу выделяют ареактивный шок – наиболее тяжелый вариант истинного кардиогенного шока, который также развивается из-за снижения сократительной способности миокарда, но устойчив к лечебным мероприятиям.
Симптомы кардиогенного шока:
-резкое падение артериального давления;
-характерный внешний вид больного: заостренные черты лица, очень бледные кожные покровы, возможен цианоз, пятнисто-мраморный рисунок на коже;
-холодный липкий пот;
-дыхание учащенное, влажные мелкопузырчатые хрипы;
-пульс частый, слабо прощупывается;
-тоны сердца глухие;
-олиго- или анурия;
-возможны потеря сознания или отек легких.
Высокая смертность при кардиогенном шоке (до 85%) обусловлена нарушением кровоснабжения головного мозга, почек, печени, ухудшением коронарного кровотока. Поэтому кардиогенный шок требует принятия неотложных мер.
Диагностика кардиогенного шока:
Учитывая тяжесть состояния больного, времени на детальное обследование у врача особенно нет, поэтому первичная (в большинстве случаев догоспитальная) диагностика опирается целиком на объективные данные:
1. Цвет кожных покровов (бледная, мраморная, цианоз);
2. Температура тела (понижена, липкий холодный пот);
3. Дыхание (частое, поверхностное, затрудненное – диспноэ, на фоне падения АД нарастают застойные явления с развитием отека легких);
4. Пульс (частый, малого наполнения, тахикардия, при снижении АД становится нитевидным, а потом перестает прощупываться, может развиваться тахи- или брадиаритмия);
5. Артериальное давление (систолическое – резко снижено, часто не превышает 60 мм рт. ст., а иногда и вовсе не определяется, пульсовое, если получается измерить диастолическое, оказывается ниже 20 мм рт. ст.);
6. Тоны сердца (глухие, иной раз улавливается III тон или мелодия протодиастолического ритма галопа);
7. ЭКГ (чаще картина ИМ);
8. Функция почек (диурез снижен или возникает анурия);
9. Болезненные ощущения в области сердца (могут быть достаточно интенсивными, больные громко стонут, беспокойны).
Естественно, для каждого вида кардиогенного шока присущи свои признаки, здесь приведены лишь общие и самые распространенные.
Первая помощь
При первых же признаках кардиогенного шока нужно вызвать «Скорую помощь». До ее прибытия необходимо обеспечить страдающему покой, уложить его так, чтобы ноги были приподняты относительно тела. При необходимости дать обезболивающее.
При кардиогенном шоке человек страдает от недостатка кислорода, поэтому необходимо обеспечить доступ кислорода в помещение, в котором находится страдающий. Если дома есть кислородная подушка, нужно воспользоваться ею.
Транспортировка пациента возможна только в специализированной машине кардиологической бригадой «Скорой помощи».
Лечение кардиогенного шока представляет сложную задачу и включает комплекс мероприятий, направленных на защиту ишемизированного миокарда и восстановление его функций, устранение микроциркуляторных нарушений, компенсацию нарушенных функций паренхиматозных органов. Эффективность лечебных мероприятий при этом во многом зависит от времени их начала. Раннее начало лечения кардиогенного шока является залогом успеха. Главная задача, которую необходимо решить как можно скорее, - это стабилизация артериального давления на уровне, обеспечивающем адекватную перфузию жизненно важных органов (90-100 мм рт.ст.).
Пациента с кардиогенным шоком госпитализируют в отделение интенсивной терапии. Лечение проводится под постоянным контролем жизненно важных функций организма.
Последовательность лечебных мероприятий при кардиогенном шоке:
1. Купирование болевого синдрома. Так как интенсивный болевой синдром, возникающий при инфаркте миокарда, является одной из причин снижения артериального давления, нужно принять все меры для его быстрого и полного купирования. Наиболее эффективно использование нейролептаналгезии.
2. Нормализация ритма сердца. Стабилизация гемодинамики невозможна без устранения нарушений ритма сердца, так как остро возникший приступ тахикардии или брадикардии в условиях ишемии миокарда приводит к резкому снижению ударного и минутного выброса. Наиболее эффективным и безопасным способом купирования тахикардии при низком артериальном давлении является электроимпульсная терапия. Если ситуация позволяет проводить медикаментозное лечение, выбор антиаритмического препарата зависит от вида аритмии. При брадикардии, которая, как правило, обусловлена остро возникшей атриовентрикулярной блокадой, практически единственным эффективным средством является эндокардиальная кардиостимуляция. Инъекции атропина сульфата чаще всего не дают существенного и стойкого эффекта.
3. Усиление инотропной функции миокарда. Если после устранения болевого синдрома и нормализации частоты сокращения желудочков артериальное давление не стабилизируется, то это свидетельствует о развитии истинного кардиогенного шока. В этой ситуации нужно повысить сократительную активность левого желудочка, стимулируя оставшийся жизнеспособным миокард. Для этого используют симпатомиметические амины: допамин (дофамин) и добутамин, избирательно действующие на бета-1-адренорецепторы сердца. Дофамин вводят внутривенно капельно. Для этого 200 мг (1 ампулу) препарата разводят в 250-500 мл 5 % раствора глюкозы. Дозу в каждом конкретном случае подбирают опытным путем в зависимости от динамики артериального давления. Обычно начинают с 2-5 мкг/кг в 1 мин (5-10 капель в 1 мин), постепенно увеличивая скорость введения до стабилизации систолического артериального давления на уровне 100-110 мм.рт.ст. Добутамин выпускается во флаконах по 25 мл, содержащих 250 мг добутамина гидрохлорида в лиофилизированной форме. Перед употреблением сухое вещество во флаконе растворяют, добавляя 10 мл растворителя, а затем разводят в 250-500 мл 5% раствора глюкозы. Внутривенную инфузию начинают с дозы 5 мкг/кг в 1 мин, увеличивая ее до появления клинического эффекта. Оптимальную скорость введения подбирают индивидуально. Она редко превышает 40 мкг/кг в 1 мин, действие препарата начинается через 1-2 мин после введения и очень быстро прекращается после его окончания в связи с коротким (2 мин) периодом полураспада.
4. Неспецифические противошоковые мероприятия.
Препараты:
Одновременно с введением симпатомиметических аминов с целью воздействия на различные звенья патогенеза шока применяют следующие препараты:
1. глюкокортикоиды: преднизолон - по 100-120 мг внутривенно струйно;
2. гепарин - по 10 000 ЕД внутривенно струйно;
3. натрия гидрокарбонат - по 100-120 мл 7,5% раствора;
4. реополиглюкин - 200-400 мл, если введение больших количеств жидкости не противопоказано (например, при сочетании шока с отеком легких); кроме того, проводят ингаляции кислорода.
Несмотря на разработку новых подходов к терапии кардиогенного шока, лучшим его «лечением» является профилактика, которая заключается в быстром и полном купировании болевого синдрома, нарушений ритма сердца и ограничении зоны инфаркта.
Профилактика кардиогенного шока
Лучшая профилактика кардиогенного шока – это правильное питание, умеренные занятия спортом, отказ от вредных привычек, соблюдение здорового образа жизни, ограничение стрессов.
Страдающим заболеваниями сердца нужно вовремя принимать назначенные врачом лекарства, своевременно купировать болевой синдром, нарушения ритма сердца.
Гипертонический криз 
Гипертонический криз - внезапное выраженное повышение артериального давления (выше 200/110 мм.рт.ст. и выше), сопровождающееся не только преходящими нейровегетативными расстройствами, но серьезными, порой органическими изменениями в организме и, прежде всего, в ЦНС, сердце и крупных сосудах.
Криз развивается приблизительно у 1 % больных артериальной гипертензией. Продолжительность гипертонического криза бывает от нескольких часов до нескольких суток.
Гипертоническая болезнь – это заболевание, при котором гипертонический криз развивается чаще всего. Особенно подвержены ему женщины в постменопаузальном периоде. Гипертонический криз может развиться при заболеваниях, сопровождающихся симптоматической артериальной гипертензией (феохромоцитома, сахарный диабет, заболевания почек и др.).
Историческая справка:
Термин «гипертонический криз» предложил еще в 1903 году. Еще в 1939 году известный русский терапевт В.Ф. Зеленин характеризовал гипертонические кризы как «вегетативную бурю». Позже великий отечественный кардиолог А.Л. Мясников писал, что гипертонические кризы - это «квинтэссенция гипертонической болезни, ее сгусток».
Г.Г. Арабидзе дал следующее определение: гипертонические кризы - это внезапное повышение АД у больных АГ, сопровождающееся нарушениями вегетативной нервной системы и усилением расстройств мозгового, коронарного и почечного кровообращения.
Причины развития криза разнообразны:
-психо-эмоциональный стресс;
-значительные физические нагрузки;
-употребление алкоголя;
-употребление чрезмерного количества соли;
-обильный прием пищи;
-перепады атмосферного давления, резкая смена метеоусловий;
-нерегулярное лечение АГ;
-самостоятельная коррекция лечения и отмена лекарственных средств;
-разобщенность между поликлиникой, стационаром и СМП. Эта ситуация требует активного внедрения современных программ лечения АГ.
Классификация гипертонических кризов:
В зависимости от клинических проявлений выделяют ГК первого типа и ГК второго типа:
| Основные характеристики криза | Криз первого типа (адреналовый) | Криз второго типа (норадреналиновый) |
| Начало | Внезапное | постепенное |
| Продолжительность | от нескольких минут до 2-3 часов | от нескольких часов до 4-5 дней |
| Клинические проявления | резкая пульсирующая головная боль, состояние беспокойства, возбуждения, похолодание конечностей, тахикардия, выраженная потливость, боль в области сердца, сердцебиение, частое учащенное мочеиспускание с отделением большого количества светлой мочи | тяжесть в голове, головная боль, головокружение, отмечается ухудшение зрения, звон в ушах, возможно появление тошноты, рвоты и очаговой неврологической симптоматики (сильной головной боли, вялости, сонливости, бреда, мелькания «мушек» перед глазами, ухудшения слуха и зрения, афазии, амнезии, парестезий) |
| Характеристика АД | преимущественное повышение систолического АД | характерно повышение диастолического АД, пульс чаще не изменен или замедлен. |
| Тип гемодинамики | гиперкинетический (увеличение сердечного выброса) | гипокинетический (повышением общего периферического сосудистого сопротивления) |
Гипертонические кризы I и II типов значительно разнятся по продолжительности, клинической картине и лабораторным данным. Гипертонические кризы встречаются и при симптоматических АГ. В частности при заболеваниях почек (гломерулонефрит, пиелонефрит) развитие гипертонических кризов обусловлено с одной стороны ишемией почек с активацией ренин-ангиотензинной системы, а с другой стороны нарушением водно-электролитного баланса с задержкой натрия в организме. Развитие гипертонических кризов у больных мочекаменной болезнью может провоцироваться приступом почечной колики. Иногда гипертонические кризы могут отмечаться у больных нефроптозом, особенно при резкой перемене положения тела. При некоторых заболеваниях эндокринной системы характерно развитие гипертонических кризов. Так, у больных феохромоцитомой выделяют кризовый вариант течения заболевания, для которого характерны параксизмальные гипертонические кризы с четкой периодичностью. Кризы при феохромоцитоме часто имеют характерные клинические проявления: внезапная головная боль, учащенное сердцебиение, парестезии, внутренняя дрожь в теле, беспричинное беспокойство, потливость. Иногда приступ сопровождается неясной, не локализованной болью в животе. Объективно отмечается бледность кожных покровов и похолодание конечностей при значительном повышении АД, лейкоцитоз, гипергликемия, гликозурия и очень выраженное повышение концентрации катехоламинов в моче (в 15-20 раз). Продолжительность криза может быть от нескольких минут до 2-3 часов. В 20% случаев феохромоцитомные кризы сопровождаются нарушениями сердечного ритма, преимущественно по типу экстрасистолии. Кризы могут купироваться самостоятельно, однако в ряде случаев требуют медикаментозной коррекции. Гипертонические кризы наблюдаются и у больных тиреотоксикозом. При этом характерно преимущественное повышение систолического АД, увеличение пульсового АД и учащенное сердцебиение. Нередко в этих случаях антигипертензивные препараты малоэффективны.
В зависимости от наличия осложнений выделяют:
-Осложнённый гипертонический криз — экстренное состояние, сопровождающееся поражением органов-мишеней прежде всего (головного мозга, сердца, почек); может привести к летальному исходу, требуется немедленная медицинская помощь и срочная госпитализация в стационар;
-Неосложненный гипертонический криз — состояние, при котором происходит значительное повышение артериального давления при относительно сохранных органах-мишенях. Требует медицинской помощи в течение 24 часов после начала; госпитализация, как правило, не требуется.
Патогенез:

В формировании гипертонического криза важную роль играет соотношение общего периферического сопротивления сосудов (ОПСС) и величины сердечного выброса (СВ). Повышение ОПСС является следствием увеличения тонуса артериол за счет вегетативных влияний и задержки натрия, а прирост сердечного выброса обеспечивается учащением частоты сердечных сокращений и увеличением объема циркулирующей крови, происходящих в результате воздействия нейрогуморальных факторов.
При гипертоническом кризе происходит гиперстимуляция ренин-ангиотензиновой системы, что приводит запуску порочной цепной реакции, включающей повреждение сосудов, ишемию тканей и дальнейшее перепроизводство ренина. Из-за избытка катехоламинов, ангиотензина II, альдостерона, вазопрессина, тромбоксана, эндотелина I и недостатка эндогенных вазодилататоров, таких как NO и простагландин I2, нарушается местная реакция периферического сопротивления. В результате вслед за повреждением эндотелия развивается гипоперфузия и фибриноидный некроз артериол с повышением проницаемости сосудов. Важным аспектом клинических проявлений и прогноза ГК является сопутствующая активация системы коагуляции.
Гипертонический криз вызывает увеличение систолического сопротивления для левого желудочка («посленагрузка»), что приводит к усилению работы сердца и к возрастанию миокардиального потребления кислорода (МПО). Увеличение внутрисосудистого давления иногда осложняется нарушением целости сосудов с развитием расслаивающей аневризмы аорты, кровотечений (особенно носовых и послеоперационных). Изменения со стороны почек обычно развиваются при повторных кризах. При повышении давления в сосудах головного мозга, вследствие местного ауторегуляторного механизма происходит сужение артериол, направленное на поддержание постоянного кровотока. Этот ангиоспазм может быть причиной нарушений микроциркуляции и ишемии мозговой ткани, а повышенное внутрисосудистое давление приводить к разрыву сосудов и кровоизлиянию в мозг. Вследствие неспособности артериол постоянно поддерживать высокий тонус их спазм переходит в дилатацию, при которой повышается проницаемость стенок сосудов для жидкой части крови и создаются условия для развития отека мозга с развитием энцефалопатии.
Факторы развития ГК
Можно выделить основные факторы, способствующие развитию гипертонического криза. К ним относятся:
-Генетическая предрасположенность к вазоспазмам;
-Повышение чувствительности А и В – адренорецепторов;
-Повышение концентрации циркулирующих катехоламинов;
-Повышение активности ренина в крови;
-Снижение активности вазодилатирующих систем:
1. калликреин-кининовой простагландиновой
2. эндотелиальной функции сосудов
|
| Поделиться: |
Поиск по сайту
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.
Дата создания страницы: 2019-04-28 Нарушение авторских прав и Нарушение персональных данных