Пиролиз различных групп углеводородов
Процесс термического разложения углеводородов, состоящий из многих элементарных реакций, которые протекают одновременно и последовательно, условно можно расчленить на две последовательные стадии. На первой стадии протекают первичные реакции термического расщепления алканов и циклоалканов с образованием олефинов, диолефинов и алканов с меньшим, чем у исходных углеводородов или равным числом атомов углерода, а также водорода. На второй стадии образовавшиеся олефины и диолефины подвергаются реакциям дегидрирования, дальнейшего расщепления и конденсации с образованием циклических ненасыщенных (циклополиенов) и ароматических углеводородов. В дальнейшем ходе реакции получаются всё более сложные многоядерные ароматические углеводороды. В итоге эти соединения, выделяя водород и частично адсорбируясь на поверхности реакторов, образуют твёрдую плёнку углерода, так называемый, пиролизный кокс. Последний может получаться и при прямом разложении углеводородов на углерод и водород.
Пиролиз в промышленных условиях осуществляется при давлениях, близким к атмосферному или несколько превышающих атмосферное, и при температурах порядка 1000-1150 К. В таких условиях реакции разложения углеводородов протекают в газовой фазе в форме свободных радикалов.
Реакции свободных углеводородных радикалов
Образование свободных радикалов. Свободные радикалы могут образовываться в процессах термического разложения из молекул исходного углеводорода, чаще всего при разрыве связи С-С, например, при пиролизе этана:
 (8)
(8)
Практически разрывом связи С-Н в качестве первичного акта пиролиза можно пренебречь. Энергия разрыва связей С-С и С-Н в молекулах алканов не одинакова для всех однородных связей и несколько изменяется в зависимости от строения молекулы и положения в ней связи. В молекулах алканов, а такие же связи в положении через одну от двойной (сопряжение связи, или связи в β-положении) сильно ослаблены по сравнению с такими же связями в молекуле алканов.
Радикалы могут образовываться не только при мономолекулярных, но и при бимолекулярных реакциях диспропорционирования либо из молекул алканов и олефинов в реакциях, обратных диспропорционированию, например:
 (9)
(9)
 (10)
(10)
Чем ниже температура и выше давление в реакционной системе, тем выше соотношение скоростей би- и мономолекулярного маршрутов образования радикалов. При некоторых условиях (низкая температура) образование радикалов по бимолекулярной реакции проходит с большей скоростью, чем по мономолекулярному процессу.
Соотношение энергий разрыва различных связей С-С и С-Н в молекулах реагирующих углеводородов определяет скорость реакций радикалов по тем или иным направлениям, количество образующихся различных радикалов и в итоге состав продуктов реакции.
Реакции замещения (отрыв атома водорода), например:
 (11)
(11)
В зависимости от соотношения величин энергии активации отрыва атомов водорода, занимающих в молекуле разное положение, скорость отрыва этих атомов различна, что определяет структуру образующихся радикалов и в дальнейшем – состав продуктов распада молекул. Так, в результате взаимодействия радикала с пропаном могут образовываться радикалы  , отличающиеся положением свободной валентности:
, отличающиеся положением свободной валентности:
 (12)
(12)
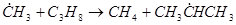 (13)
(13)
Реакции присоединения. Радикалы могут присоединиться к молекулам ненасыщенных углеводородов по кратной связи, например:
 (14)
(14)
Реакция распада. Практически исключительное направление распада радикалов наблюдается по связи, находящейся в β-положении относительно атома углерода, обладающего свободной валентностью. В результате распада образуется молекула ненасыщенного углеводорода и радикал меньшей молекулярной массы, чем исходный, в частности,  . Например:
. Например:
 (15)
(15)
 (16)
(16)
Реакции изомеризации. Изомеризация радикала представляет собой внутримолекулярный отрыв атома водорода активным атомом углерода, обладающим свободной валентностью:
 (17)
(17)
Реакции изомеризации протекают через промежуточное состояние – циклические активированные комплексы.
Реакции рекомбинации. Это реакции присоединения двух радикалов, например: 
 . Энергия активации реакции близка к нулю, но в случае рекомбинации двух атомов водорода и, возможно, атома водорода и радикала . СН3 рекомбинация происходит только в результате тройного столкновения, причём роль третьей сталкивающейся частицы заключается в отводе части энергии, выделяющейся при образовании связи.
. Энергия активации реакции близка к нулю, но в случае рекомбинации двух атомов водорода и, возможно, атома водорода и радикала . СН3 рекомбинация происходит только в результате тройного столкновения, причём роль третьей сталкивающейся частицы заключается в отводе части энергии, выделяющейся при образовании связи.
Реакции диспропорционирования. Диспропорционирование (перераспределение водорода) происходит в результате взаимодействия двух молекул олефинов или двух радикалов, например:
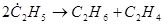 (18)
(18)
Энергия активация этих реакций также близка к нулю. Но так как концентрации радикалов при термическом пиролизе обычно значительно меньше, чем углеводородных молекул, скорости реакций рекомбинации и диспропорционирования и роль их в образовании конечных продуктов обычно невелика.
Алканы. Термическое разложение алканов является чисто радикально-цепным процессом и протекает согласно механизму Райса – Герфельда – Косякова. Пиролиз одного из простейших представителей алканов – пропана включает следующие основные реакции:
 , инициирование цепи, (19)
, инициирование цепи, (19)
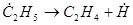 , развитие цепи (20)
, развитие цепи (20)
 , (21)
, (21)
 , (22)
, (22)
 , (23)
, (23)

 (24)
(24)
 , обрыв цепи (25)
, обрыв цепи (25)
 , (26)
, (26)
 , (27)
, (27)
 (28)
(28)
При пиролизе любых насыщенных нециклических углеводородов нормального или изомерного строения стадией зарождения цепи является распад на два радикала с разрывом связи С-С:
 (29)
(29)
При пиролизе алканов изо-строения наиболее вероятен разрыв связи С-С между двумя третичными атомами, затем между вторичным и третичным атомами, ещё менее вероятен разрыв связи между первичным и третичным атомами и, наконец, наименее вероятен разрыв связи между двумя вторичными атомами углерода. Образовавшиеся радикалы, большие чем CH3 и С2Н5 распадаются с разрывом ослабленной связи С-С, находящейся в β-положении к атому С, обладающему свободной валентностью.
В схеме реакции пиролиза алканов учитывают изомеризацию первичных радикалов во вторичные через промежуточные, преимущественно шестичленные циклы. Реакции изомеризации эндотермичны (20-30 кДж/моль), следовательно с повышением температуры равновесная концентрация вторичных радикалов снижается, что способствует увеличению скорости образования этилена.
Циклоалканы. Из циклоалканов в состав сырья для промышленного пиролиза входят только циклопентан, циклогексан и их алкилзамещённые. Основные продукты разложения циклопентана – этилен и пропилен, а при значительной степени разложения циклопентана образуется циклопентадиен. Реакция протекает преимущественно по радикально-цепному механизму. При разложении метилциклогексана и метилциклопентана предпочтительной первичной реакцией является отрыв радикала . СН3.
Цикланы с боковой цепочкой, имеющей два или более атома углерода, распадаются в начальной стадии реакции по связи С-С между первым и вторым от нафтенового кольца атомом углерода. В меньшей степени происходит разрыв связи С-С между нафтеновым кольцом и боковой цепью с дальнейшим разложением образовавшихся радикалов.
Олефины и бутадиен 1,3. Олефины, как правило, в качестве сырья пиролиза не применяют. Однако низшие олефины и бутадиен-1,3 образуются на ранней стадии реакции пиролиза в значительных количествах, при этом также в небольших количествах получаются высшие олефины – С5 и выше. Например, основными продуктами разложения этилена являются водород, метан, ацетилен, бутадиен-1,3, бензол и кокс. В меньших количествах образуется этан, пропилен, углеводороды C3H4 и др.
Наиболее вероятной реакцией зарождения цепи разложения этилена является диспропорционирование:
 (30)
(30)
В присутствии активных радикалов . Н и . СН3 в зоне пиролиза зарождение цепи происходит в основном в результате взаимодействия их с этиленом:
 (31)
(31)
Основные продукты образуются по следующей схеме:
 (32)
(32)
 (33)
(33)
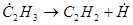 (34)
(34)
 (35)
(35)
 (36)
(36)
К числу первичных ненасыщенных продуктов пиролиза, получающихся в заметных количествах, относится бутадиен-1,3. Как показывают экспериментальные данные, бутадиен-1,3 на дальнейших стадиях подвергается разложению с преимущественным получением водорода, метана и этилена.
Инициирование цепи в случае пиролиза бутадиена-1,3 как исходного вещества осуществляется при разложении бутадиена-1,3 на радикалы . С2Н3 с последующим разложением их на ацетилен и атомарный водород. В дальнейшем реакция идёт путём либо отрыва атома водорода от бутадиена-1,3 с последующим образованием бутенина.
Образование жидких продуктов. Основным компонентом жидких продуктов пиролиза являются ароматические и алкилароматические углеводороды. В составе жидких продуктов пиролиза имеются также алкены, в том числе значительное количество диенов и циклодиенов. Присутствуют в некотором количестве и алканы, представляющие собой в основном непрореагировавшие компоненты сырья пиролиза.
Ароматические углеводороды образуются на поздней стадии термического разложения, когда в зоне реакции имеются в достаточной концентрации низшие олефины – этилен и пропилен.
Толуол может образовываться из пропилена по следующей схеме:
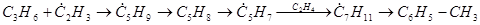 (37)
(37)
Бензол – термически стойкое вещество, но в промышленных условиях он частично вступает в реакцию, причём основным продуктом взаимодействия является бифенил:
 (38)
(38)
 (39)
(39)
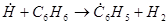 (40)
(40)
Далее бифенил может взаимодействовать с . Н и бензолом с образованием терфенила  и т.д.
и т.д.
Пиролиз алкилароматических углеводородов с числом атомов углерода в алкильной группе два и более протекает значительно легче, чем толуола, поскольку эти углеводороды имеют ослабленную С-С-связь в β-положении по бензольному кольцу.
В продуктах пиролиза наряду с бутадиеном-1,3 присутствуют в заметных количествах высшие диены, особенно диены С5, в том числе изопрен, пентадиен-1,3, при жёстких условиях пиролиза – циклопентадиен. Возможно также образование его из этилена и пропилена с промежуточным образованием этенил- и пропенил – радикалов.
Образование и отложение кокса. Кокс может образовываться путём конденсации и дегидроконденсации алкенов и ароматических углеводородов, получившихся на первых стадиях реакции, либо в результате разложения исходных углеводородов непосредственно или через промежуточные радикалы на углерод и водород.
В первом варианте имеющиеся в реакционном объёме алкены и ароматические углеводороды подвергаются реакциям конденсации, поликонденсации и дегидрополиконденсации с образованием поликонденсированных ароматических углеводородов. В результате реакций конденсации образуются плоские структуры из углеродных атомов. Молекулы могут конденсироваться на поверхности реакционной системы постепенно, образуя за счёт дегидрогенизации пироуглерод (кокс), или могут образовывать в газовой фазе стабильные жидкие капли (зародыши кокса), которые оседают на поверхности либо формируют частицы кокса в объёме, уносимые далее из зоны реакции потоком пирогаза.
Химизм пути коксообразования наиболее рационально могут быть объяснены на основе представлений о различных коксообразующих системах и даже в разных точках одной системы.
Так на основе эксперимента сделан вывод, что кокс, отлагающийся в реакторе пиролиза, может образовываться двумя путями:
1. гетерогенным разложением молекул углеводородов на стенке реактора или на частицах металла, извлечённых из металлической поверхности и остающихся на поверхности растущего слоя кокса;
2. при реакциях присоединения в объёме реактора, которым особенно благоприятствуют полициклические ароматические углеводороды, содержащиеся в сырье.
В пользу представления о двух различных путях образования кокса при пиролизе углеводородов свидетельствует, в частности, разнообразие типов и структур кокса, формирующегося при термическом разложении жидких и газообразных углеводородов. При температурах промышленного пиролиза – от 650 до 900 °C – может формироваться кокс трёх типов, отличающихся строением (макроструктурой): волокнистый нитевидный ленточный (дендрит) или игольчатый, слоистый анизотропный, образующий относительно непрочную плёнку чёрного цвета.
Количественное соотношение двух путей образования кокса зависит от условий ведения процесса образования кокса зависит от условий ведения процесса. Кокс, образованный каталитическими реакциями (нитевидный), очевидно, преобладает при относительно низких температурах и на ранних стадиях процесса. При более высоких температурах и значительных степенях превращениях исходного сырья возрастает значение конденсационного механизма, причём тип кокса зависит от парциального давления углеводородов, от свойств поверхности, на который кокс отлагается, строения исходных углеводородов, температуры и ряда других факторов. С увеличением парциального давления углеводородов повышается доля образующего аморфного кокса.