Солеобразующие оксиды. Свойства и способы получения.
Оксиды – это бинарные соединения, содержащие кислород в степени окисления –2 (для сравнения: пероксиды – бинарные соединения, содержащие кислород в степени окисления –1). Например:
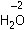 – оксид водорода,
– оксид водорода,  – пероксид водорода.
– пероксид водорода.
При составлении графических формул оксидов нужно учесть, что атомы кислорода соединяются только через атомы элемента (в пероксидах атомы кислорода соединены напрямую, образуя пероксидную группу –О–О–). Приведем графические формулы оксидов и пероксида:
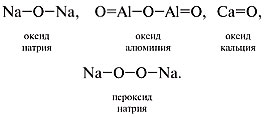
К л а с с и ф и к а ц и и о к с и д о в
По агрегатному состоянию оксиды делятся на твердые (CaO), жидкие (SO3) и газообразные (СО2).
По валентности различают высшие (Р2О5) и низшие (Р2О3) оксиды.
По химическим свойствам оксиды подразделяют на солеобразующие (например, К2О, SO3) и несолеобразующие (безразличные, или индифферентные, например CO, SO, NO, N2O).
Солеобразующие оксиды в свою очередь подразделяют на кислотные, основные и амфотерные.
Кислотные оксиды – это оксиды, которым соответствуют кислоты. Они являются продуктами полной дегидратации кислот – сохраняют химические свойства кислот, в связи с чем получили название – ангидриды. Примеры кислотных оксидов и соответствующих им кислот:

Кислотные оксиды это такие оксиды, которые образуют соли в реакциях с основаниями и основными оксидами:
SO3 + Ca(OH)2 →CaSO4 +H2O SO3 + CaO →CaSO4
CO2 +2 NaOH→ Na2CO3 + H2O CO2 + Na2O→ Na2CO3
P2O5 + 3Ba(OH)2→Ba3(PO4)3 +3H2O P2O5 + 3BaO→Ba3(PO4)3
Основные оксиды – это оксиды, которым соответствуют основания. Они являются продуктами полной дегидратации оснований – сохраняют химические свойства оснований. Примеры осн о вных оксидов и соответствующих им оснований:
Na2O  NaOH, CaO
NaOH, CaO  Ca(OH)2, FeO
Ca(OH)2, FeO 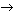 Fe(OH)2.
Fe(OH)2.
Основные оксиды это такие оксиды, которые образуют соли в реакциях с кислотами и кислотными оксидами:
CaO + H2SO4 →CaSO4 +H2O SO3 + CaO →CaSO4
3Na2O + 2H3PO4→ 2Na3PO4 + 3H2O 3Na2O + P2O5→ 2Na3PO4
BaO + 2HNO3 →Ba(NO3)2 +H2O BaO + N2O5 → Ba(NO3)2
Амфотерные оксиды – это оксиды, которые образуют соли в реакциях и с кислотами и с основаниями. Они являются продуктами полной дегидратации амфотерных гидроксидов – сохраняют химические свойства амфотерных гидроксидов. В зависимости от условий амфотерные оксиды проявляют свойства основных или кислотных оксидов. Примеры амфотерных оксидов и соответствующих им гидратов:
Al(OH)3 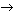 Al2O3
Al2O3 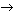 H3AlO3 (HAlO2 ),
H3AlO3 (HAlO2 ),
Zn(OH)2 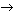 ZnO
ZnO 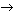 H2ZnO2.
H2ZnO2.
Химические свойства кислотных и основных оксидов отличаются друг от друга.
Х и м и ч е с к и е с в о й с т в а к и с л о т н ы х о к с и д о в
Многие кислотные оксиды реагируют с водой, образуя кислоты:
SO3+H2O = H2SO4 (серный ангидрид →серная кислота)
SO2+H2O = H2SO3 (сернистый ангидрид→ сернистая кислота)
СO2 + H2O 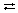 H2CO3, (угольный ангидрид → угольная кислота)
H2CO3, (угольный ангидрид → угольная кислота)
Оксид фосфора (V) в зависимости от условий образует различные по составу гидроксиды:
P2O5 + H2O = 2HPO3, (мета-фосфорная кислота)
P2O5 + 2H2O = H4P2O7 (пиро-фосфорная кислота)
P2O5 + 3H2O = 2H3PO4,(орто-фосфорная кислота)
но:
SiO2 + H2O  (нет реакции).
(нет реакции).
Реакции с основными оксидами протекают как реакции соединения:
СO2 + СаO 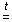 CaCO3.
CaCO3.
Взаимодействие кислотных оксидов с основаниями приводит к образованию как средних солей:
СO2 + 2NaOH = Na2CO3 + H2O.
P2O5 + 6NaOH →2Na3 PO4 + 3H2O
так и кислых (при соответствующих соотношениях реагирующих веществ):
СO2 + NaOH = NaНCO3.
P2O5 + 2NaOH + H2O → 2NaH2PO4
P2O5 + 4NaOH →2Na2 HPO4 + H2O
Кислотные оксиды элементов, находящихся в промежуточной степени окисления, способны взаимодействовать с кислородом, образуя оксиды с более высокой степенью окисления элемента: 2NO + O2→2NO2
2CO+ O2→2CO2
2SO2 + O2 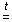 2SO3.
2SO3.
Известны примеры реакций некоторых кислотных оксидов с активными металлами. Так, оксид углерода (IV) проявляет окислительные свойства в реакции с магнием, при этом восстанавливается до оксида углерода(II) например:
СO2 + Mg 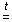 MgO + CO.
MgO + CO.
Некоторые кислотные оксиды реагируют с солями по типу реакции замещения:

Кислотные оксиды не реагируют с водородом, неметаллами, другими кислотными оксидами и кислотами-неокислителями, не действуют на индикаторы.