Оксиды щелочных и щелочно-земельных металлов в реакциях с водой образуют растворимые основания - щелочи:
Na2O + H2O = 2NaOH СаО + H2O = Са(ОН)2
Осн о вные оксиды реагируют с кислотными оксидами с образованием соответствующих солей:
СаО + СО2 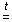 CaCO3 карбонат кальция
CaCO3 карбонат кальция
SO3 + CaO →CaSO4 сульфат кальция
3Na2O + P2O5→ 2Na3PO4 фосфат натрия
BaO + N2O5 → Ba(NO3)2 нитрат бария
При взаимодействии основных оксидов с кислотами, образуются соль и вода:
CaO + H2SO4 →CaSO4 +H2O
3Na2O + 2H3PO4→ 2Na3PO4 + 3H2O
BaO + 2HNO3 →Ba(NO3)2 +H2O
Na2O + 2HCl = 2NaCl + H2O,
CuO + 2HCl = CuCl2 + 2H2O.
Основные оксиды вступают в реакции с простыми и сложными веществами, проявляющими свойства восстановителей.
Например, водород восстанавливает некоторые металлы (от цинка и правее в ряду напряжений металлов) из их оксидов: Fe3 O4 + Н2 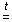 3Fe +4 Н2O.
3Fe +4 Н2O.
СuO + H2 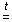 Cu + H2O.
Cu + H2O.
Восстанавливают металлы из их оксидов такие восстановители, как углерод и оксид углерода(II):
2Fe2O3 + 3С 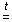 4Fe + 3CO2. Fe2O3 + 3СО
4Fe + 3CO2. Fe2O3 + 3СО 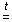 2Fe + 3CO2.
2Fe + 3CO2.
Активные металлы (восстановители) реагируют с оксидами менее активных металлов (этот метод получения металлов из оксидов широко применяется на практике и называется металлотермией, в случае применения алюминия- алюминотермией):
2Al + 3CuO 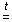 Al2O3 + 3Cu. 4К + ТiО2 = 2К2О + Тi
Al2O3 + 3Cu. 4К + ТiО2 = 2К2О + Тi
Оксиды металлов с меньшей валентностью окисляются в высшие оксиды, и наоборот:
4FeO + O2 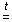 2Fe2O3.
2Fe2O3.
4CrO3 = 2Cr2O3 + 3O2
Кислоты- окислители могут окислять металлы в составе оксидов: так, при окислении оксида железа (II) азотной кислотой, получают соль – нитрат железа (III):
3FeO + 10HNO3 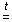 3Fe(NO3)3 + NO + 5H2O
3Fe(NO3)3 + NO + 5H2O
Некоторые осн о вные оксиды термически неустойчивы:
2HgO 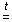 2Hg + O2
2Hg + O2  .
.
Основные оксиды не реагируют между собой, с основаниями и солями, не действуют на индикаторы.
М е т о д ы п о л у ч е н и я о к с и д о в
1.Окисление простых веществ:
При горении щелочных металлов только литий образует оксид: 4 Li + O2 =2 Li2O
а остальные - пероксиды и супероксиды:
2Na + O2 = Na2O2
2K + O2 = K2O4
Активные металлы горят в атмосфере кислорода с образованием оксидов:
2Ca + O2 = 2CaO
4Al + 3O2 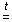 2Al2O3.
Железо при горении образует железную окалину. Так называют смешанный оксид железа (II)-(III):
3 Fe +2 O2 = Fe3O4 (FeO.Fe2O3) 2Al2O3.
Железо при горении образует железную окалину. Так называют смешанный оксид железа (II)-(III):
3 Fe +2 O2 = Fe3O4 (FeO.Fe2O3)
| При горении простых веществ неметаллов образуются кислотные оксиды:
С + О2 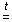 CO2,
S + O2 = SO2
4P + 5O2 = 2P2O5 CO2,
S + O2 = SO2
4P + 5O2 = 2P2O5
|
2.Окисление сложных веществ: При горении (окислении)сложных веществ, как правило, образуются оксиды всех элементов, входящих в его состав:
CS2 + 3O2 = CO2 + 2SO2 2Н2S + 3O2 = 2SO2 + 2H2O
CH4 + 2O2 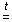 CO2 + 2H2O. 4FeS2 + 11O2 = 2 Fe2O3 + 8SO2
CO2 + 2H2O. 4FeS2 + 11O2 = 2 Fe2O3 + 8SO2
Горение аммиака(как и органических азотсодержащих веществ) приводит к образованию азота:
4NH3 + 3O2 = 2N2 + 6H2O
а для получения оксида азота(II) требуется каталитический процесс:
4NH3 + 5O2 = 4NО + 6H2O
И окисление низших оксидов: В промышленности связанный в оксид азот получают окислением аммиака, но в природе в воздухе происходит связывание азота под воздействием электрических разрядов- молнии (при температуре выше 2000оС)
N2 + O2 = 2 NO
Угарный газ не соединяется с кислородом воздуха при температуре 20оС, но в избытке кислорода горит:
2CO + O2 = 2CO2
Для получения оксида серы (VI) из оксида серы (IV) в процессе окисления применяют в качестве катализатора платину, или оксид ванадия (V): 2SO2 +O2 = 2SO3
3. Разложение сложных веществ (кислот, оснований, солей):
3.1. разложение кислот приводит к образованию кислотных оксидов и воды:
Н2SiO3 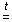 H2O + SiO2, 4HNO3 = 4NO2 + O2 + 2H2O
H2O + SiO2, 4HNO3 = 4NO2 + O2 + 2H2O
3.2. разложение оснований – к образованию основных оксидов и воды:
Cu(OH)2 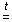 CuO + H2O, Ca(OH)2
CuO + H2O, Ca(OH)2 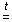 CaO + H2O,
CaO + H2O,
3.3. При разложении солей необходимо учитывать химические особенности элементов, входящих в их состав, например, перманганат калия разлагается с образованием продуктов окислительно-восстановительного взаимодействия:
2KMnO4 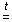 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2  .
.
Карбонаты щёлочноземельных металлов при нагревании образуют основной и кислотный оксиды: CaCO3 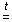 CaO + CO2 (карбонаты щелочных металлов не разлагаются вовсе),
CaO + CO2 (карбонаты щелочных металлов не разлагаются вовсе),
Нитраты разлагаются с образованием свободного кислорода, основного оксида и диоксида азота только, если в состав нитрата входит металл, находящийся в ряду напряжений от Mg до Cu (включительно):
2Cu(NO3)2 = 2CuO + 4NO2 + O2 
Соли кислородсодержащих кислот хлора, в зависимости от условий, могут образовывать
различные продукты реакции:
2KClO3→ 2KCl + 3O2 4KClO3→ 3KCl +KClO4
4. Разложение высших оксидов:
Некоторые кислотные оксиды при разложении образуют оксиды амфотерного характера: 4СrO3 = 2Cr2O3 + 3O2
5. Металлотермия: Активные металлы способны восстанавливать менее активные металлы из их оксидов: TiO2 + 4K = 2K2O + Ti
При реакциях с алюминием (алюминотермия) выделяется значительное количество тепла, например, при взаимодействии алюминия с железной окалиной («термитная смесь») выделяющегося тепла достаточно, чтобы расплавить восстановленное железо
(температура плавления железа более 1500оС)
8Al + 3Fe3O4 = 4Al2O3 + 9 Fe
Для соединений железа со степенью окисления (III) характерно окислительно-восстановительное взаимодействие с восстановителями и понижение степени окисления
Fe2O3 + Fe = 3FeO
6. Для получения редких и неустойчивых оксидов используют фосфорный ангидрид, который обладает способностью «отнимать» воду даже от химических соединений. Например, в реакции оксида фосфора (V) с азотной и хлорной кислотами, образуются оксиды, которые не могут быть получены иначе:
P2O5 + 6HClO4 = 3Cl2O7 + 2H3PO4 P2O5 + 6HNO3 = 3N2O5 + 2H3PO4
Оксиды различной природы и состава широко применяют в химическом синтезе, в технике, в быту, в пищевой отрасли промышленности.
Формулы и тривиальные названия оксидов, которые необходимо запомнить:
СаО – негашеная известь; СО – угарный газ;
СО2 – углекислый газ, твердый СО2 – сухой лед;
Fe3O4 (FeO•Fe2O3) – железная окалина; смешанный оксид железа;
SiO2 – песок, кремнезем, кварц, горный хрусталь; N2O – веселящий газ;
SO2 – сернистый газ; Al2O3 – глинозем.
Тест по теме «Оксиды»
1. Амфотерный оксид и гидроксид образует:
а) цинк; б) магний; в) калий; г) бериллий.
2. Алюминий из глинозема в промышленности получают:
а) термическим разложением; б) электролизом;
в) восстановлением углем; г) восстановлением водородом.
3. Кислотными являются оксиды:
а) оксид хрома(III) и оксид серы(II); б) оксид серы(IV) и оксид хрома(VI);
в) оксид натрия и оксид цинка; г) углекислый газ и речной песок.
4. Из перечисленных соединений к оксидам относятся:
а) Na2O; б) H2O2; в) KO2; г) H2O.
5. Оксид азота(III) является ангидридом кислоты:
а) азотной; б) азотистой; в) синильной; г) вообще не является ангидридом.
6. Соль, при прокаливании которой нельзя получить оксид, это:
а) перманганат калия; б) нитрат натрия; в) карбонат кальция; г) карбонат калия.
7. Наиболее ярко выражены основные свойства у оксида:
а) бериллия; б) магния; в) бария; г) цинка.
8. Непосредственно друг с другом не взаимодействуют:
а) кислород и натрий; б) кислород и медь;в) кислород и хлор; г) кислород и аммиак.
9. Кислотный оксид можно получить в результате реакции разложения:
а) основания; б) гидроксида;в) кислоты; г) соли.
10. Объем (н.у.) порции сернистого газа, содержащей 4,515•1023 атомов кислорода, составляет (в л):
а) 16,8; б) 22,4; в) 5,6; г) 8,4.
Ключ к тесту
| а, г | б | б, г | а, г | б | б, г | в | в | б, в, г | г |