По заданным термохимическим уравнениям рассчитайте стандартную энтальпию реакций образования
указанных сложных веществ:
| 43. | I. 4AsK + 3O2Г = 2As2O3K II. As2O3K + O2Г = As2O5K | –1328 кДж –261 кДж | As2О5 |
| 44. | I. 2CK + O2Г = 2COГ II. COГ + F2Г = COF2Г | –220 кДж –525 кДж | COF2 |
| 45. | I. 2CrK + 3F2Г = 2CrF3K II. 2CrF3K + CrK = 2CrF2K | –2224 кДж –38 кДж | CrF2 |
| 46. | I. 2РK + 3Сl2Г = 2РСl3Г II. РСl5Г = РСl3Г + Сl2Г | –574 кДж +88 кДж | РСl5 |
| 47. | I. 2PbK + O2Г = 2PbOK II. 2РbO2K = 2РbОK + O2Г | –438 кДж +116 кДж | РbО2 |
| 48. | I. ZrK + ZrCl4Г = 2ZrCl2Г II. ZrK + 2Cl2Г = ZrCl4Г | +215 кДж –867 кДж | ZrCl2 |
| 49. | I. 2AsK + 3F2Г = 2AsF3Г II. AsF5Г = AsF3Г + F2Г | –1842 кДж +317 кДж | AsF5 |
| 50. | I. 2ClF5Г = Cl2F6Г + 2F2Г II. Cl2Г + 5F2Г = 2ClF5Г | +152 кДж –478 кДж | Cl2F6 |
| 51. | I. СеK + O2Г = СеO2K II. 3СеO2K + СеK = 2Се2O3K | –1090 кДж –332 кДж | Се203 |
| 52. | I. CuCl2K + CuK = 2CuClK II. СuK + Сl2Г = СuСl2K | –56 кДж –216 кДж | CuCl |
| 53. | I. HgBr2K + HgЖ = Hg2Br2K II. HgBr2K = HgЖ + Br2Ж | –38 кДж +169 кДж | Hg2Br2 |
| 54. | I. IrK + 2SK = IrS2K II. 2IrS2K = Ir2S3K + SK | –144 кДж +43 кДж | Ir2S3 |
| 55. | I. СK + О2Г = СО2Г II. СН4Г + 2О2Г = 2H2OЖ + СО2Г III. H2Г + ½О2Г = H2OЖ | –393,5кДж –890,3кДж –285,8кДж | СН4 |
| 56. | I. СаK + ½О2Г = СаОK II. H2Г + ½О2Г = H2OЖ III. СаОK + H2OЖ = Са(ОН)2K | –635,6кДж –286 кДж –65,0 кДж | Са(ОН)2 |
| 57. | I. СK + О2Г = СО2Г II. H2Г + ½О2Г = H2OГ III. С2H4Г + 3О2Г = 2СО2Г + 2H2OГ | –393,5кДж –242 кДж –1323 кДж | С2H4 |
| 58. | I. СK + О2Г = СО2Г II. 2MgK + О2Г = 2MgOK III.2MgOK + СО2Г =MgCO3K | –393,5кДж –1202 кДж –117,7кДж | МgCO3 |
| 59. | I. MnO2K +2CK = MnK + 2COГ II. CK + ½O2Г = COГ | +293 кДж –110 кДж | MnO2 |
| 60. | I. B2O3K + 3MgK =2BK +3MgOK II. MgK + ½О2Г = MgOK | –531 кДж –601 кДж | B2O3 |
| 61. | I.SiO2K + 2MgK= Si +2MgОK II. MgK + ½О2Г = MgOK | –290 кДж –601 кДж | SiO2 |
| 62. | I.3MgK+2NH3Г = Mg3N2K+3H2 II. ½N2Г + 3/2H2Г = NH3Г | –369 кДж –46 кДж | Mg3N2 |
| 63. | I.AlK + 3H2SГ = Al2S3K + 3H2 II. H2Г + SK = H2SГ | –446 кДж –21 кДж | Al2S3 |
| 64. | I.2AlK + 2NH3Г = 2AlNK + 3H2Г II.½N2Г + 3/2H2Г = NH3Г | –544 кДж –46 кДж | AlN |
| 65. | I. 8AlK + 3Fe3О4K = 4Al2O3K + 8Fe II. AlK + 3/2O2Г = Al2O3K | –3346 кДж –1675 кДж | Fe3О4K |
| 66. | I. 2Al2O3K + 9CK = Al4С3K + 6СОГ II. СK + ½О2Г = СОГ III. AlK + 3/2O2Г = Al2O3K | +2482кДж –110 кДж –1675 кДж | Al4С3 |
| 67. | I. SO2Г + 2H2SГ = 3SK + 2H2OЖ II. SK + О2Г = SО2Г III. H2Г + ½О2Г = H2OЖ | –234 кДж –297 кДж –286 кДж | H2S |
| 68. | I. 2ZnSK + 3О2Г = 2ZnOK + SО2Г II. SO2Г + О2Г = SО3Г III. ZnSO4K =ZnOK + SО3Г | –890 кДж –197 кДж +234 кДж | ZnSO4 |
Химическая кинетика
Химическая кинетика - наука о скоростях и механизмах протекания химических реакций.
Поскольку химическая реакция - это процесс перехода системы из одного состояния в другое, то естественно, что он всегда протекает во времени. С практической точки зрения, мы можем быть заинтересованы как в ускорении прохождения химических процессов, например, при строительстве дорог, так и в максимальном их замедлении, в случае коррозии металлов. Производственные же процессы, как правило, стараются проводить при оптимальных значениях скоростей. Таким образом, без знания основных законов химической кинетики невозможно создавать химическую аппаратуру и научно обоснованно управлять химическими реакциями и отдельным их стадиями.
Понятие скорость характеризуется изменением, какой либо, величины в единицу времени. Чтобы определить скорость химической реакции, необходимо отметить количество реагирующего вещества в данном реакционном пространстве (с1) в данный момент времени (t1), а затем, через определенный промежуток времени (Dt), определить, на какую величину изменилось это количество вещества (Dс).
Таким образом,
Dс = с2 – с1 - изменение количества реагирующего вещества от с1 до с2 за промежуток времени от τ1 до τ2, который определяется значением Dt = t2– t1, где t2 - конечное время, с2 - конечная концентрация.
 Отношение Dс/Dt будет выражать среднюю скорость протекания химической реакции: uср.= Dс/Dt. Значение средней скорости будет тем точнее, чем меньший промежуток времени Dt будет выбран для расчета скорости. Истинное значение скорости химической реакции можно определить выражением
Отношение Dс/Dt будет выражать среднюю скорость протекания химической реакции: uср.= Dс/Dt. Значение средней скорости будет тем точнее, чем меньший промежуток времени Dt будет выбран для расчета скорости. Истинное значение скорости химической реакции можно определить выражением  , которое представляет собой производную количества реагирующего вещества по времени. Полученная величина называется мгновенной скоростью, а сама производная может иметь знак “+” или “–” в зависимости от того, концентрация какого вещества стоит под знаком дифференциала: если скорость определяется относительно продуктов реакции - “+”, так как их количество возрастает, если относительно исходных веществ - “–”, так как их количество убывает.
, которое представляет собой производную количества реагирующего вещества по времени. Полученная величина называется мгновенной скоростью, а сама производная может иметь знак “+” или “–” в зависимости от того, концентрация какого вещества стоит под знаком дифференциала: если скорость определяется относительно продуктов реакции - “+”, так как их количество возрастает, если относительно исходных веществ - “–”, так как их количество убывает.
Итак: скорость химической реакции характеризуется изменением концентрации реагирующих веществ в единицу времени.
Закон действующих масс - основной закон химической кинетики.
Химическая реакция, под которой понимают превращение веществ, является результатом столкновения частиц (атомов, молекул, ионов, радикалов и т.п.). Очевидно, что чем больше частиц содержится в данном реакционном объеме, тем чаще возможны их столкновения и тем более эти столкновения вероятны.
Если реакции происходят в жидкой среде, количества реагирующих (сталкивающихся) частиц могут быть выражены в различных единицах измерения и отнесены к общему объему или массе реакционной смеси. В любом случае, полученные соотношения представляют собой концентрацию реагирующих веществ. Чем выше концентрация частиц вещества, тем выше вероятность их столкновения и, следовательно, выше вероятность осуществления химической реакции между ними.
Пусть два вещества А и В реагируют друг с другом по схеме
а А + b B ↔ c C + d D,
где а, b, c и d - стехиометрические коэффициенты данного уравнения. Для образования веществ С и D, в соответствии со схемой, необходимо, чтобы в какой-то момент времени в какой-либо точке пространства одновременно произошло столкновение “а” частиц вещества А и “b” частиц вещества B.
Вероятность столкновения реагирующих веществ будет определяться вероятностями их одновременного появления в данной точке, а следовательно, она должна быть пропорциональна произведению этих вероятностей или произведению концентраций.
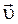 ~ [A]×[A]…[A] × [B]…[B]×[B] = [A] a × [B] b,
~ [A]×[A]…[A] × [B]…[B]×[B] = [A] a × [B] b,
а b где  - скорость прямой реакции, а и b - количество частиц А и В, соответственно, которые должны одновременно столкнуться для того, чтобы химическая реакция имела место. [A], [B] – равновесные концентрации исходных веществ А и В.
- скорость прямой реакции, а и b - количество частиц А и В, соответственно, которые должны одновременно столкнуться для того, чтобы химическая реакция имела место. [A], [B] – равновесные концентрации исходных веществ А и В.
Аналогичное выражение можно вывести для прохождения обратной реакции:  ~ [С]×[С]…[С] × [D]…[D]×[D] = [C] c ×[D]d,
~ [С]×[С]…[С] × [D]…[D]×[D] = [C] c ×[D]d,
c d
где  - скорость обратной реакции, с и d - количество частиц С и D, соответственно, которые должны одновременно столкнуться для того, чтобы химическая реакция имела место. [С], [D] - концентрации продуктов реакции C и D.
- скорость обратной реакции, с и d - количество частиц С и D, соответственно, которые должны одновременно столкнуться для того, чтобы химическая реакция имела место. [С], [D] - концентрации продуктов реакции C и D.
Полученные выражения количественно устанавливают основной закон химической кинетики. Поскольку в химических процессах мы чаще имеем дело с конкретными массами веществ, выведенная закономерность называется законом действующих масс. Скорость химической реакции пропорциональна концентрациям реагирующих веществ, взятых в степенях, соответствующих их стехиометрическим коэффициентам.
Для расчетных целей полученные выражения закона действующих масс преобразуются к виду:
 =
= 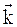 [A] a ×[B] b - для прямой реакции,
[A] a ×[B] b - для прямой реакции,
 =
= 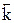 [C] c ×[D] d – для обратной реакции,
[C] c ×[D] d – для обратной реакции,
где 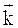 ,
, 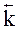 - коэффициенты пропорциональности, соответственно, прямой и обратной реакций, называемые константами скоростей химических реакций. В общем случае, константа скорости зависит от термодинамических параметров, особенностей строения атомов и молекул, но не зависит от концентрации реагирующих веществ и времени. Последовательный учет всех факторов, которые влияют на константу скорости реакции, позволяет глубже понять ее смысл.
- коэффициенты пропорциональности, соответственно, прямой и обратной реакций, называемые константами скоростей химических реакций. В общем случае, константа скорости зависит от термодинамических параметров, особенностей строения атомов и молекул, но не зависит от концентрации реагирующих веществ и времени. Последовательный учет всех факторов, которые влияют на константу скорости реакции, позволяет глубже понять ее смысл.
Всякая система самопроизвольно стремится к такому состоянию, в котором она обладает минимальным запасом энергии при данных условиях, такое состояние и называют равновесным. Любое изменение расстояния между частицами выводит систему из равновесия и требует затрат энергии. Так, при сближении частиц, повышается энергия сил отталкивания, а при удалении частиц друг от друга – возрастает энергия сил кулоновского притяжения.
Общая энергия системы, которая соответствует энергии связи и есть энтальпия образования данного вещества при н.у. (DН¦o). В общем случае, энтальпия – это энергетический запас вещества или смесей веществ, при данных условиях.
Момент сближения частиц характеризуется переходным или активированным состоянием.
Переходное состояние частицы неустойчиво и длится доли секунды. Это время необходимо частице для перехода в новое состояние равновесия. Если энергия молекулы АВ, определяемая, как энтальпия ее образования (ΔН¦°АВ), окажется меньше затраченной (ЕА), состояние нового равновесия будет устойчивым и АВ будет существовать. В противном случае, переходное состояние вернется к исходному положению А2 и В2 и новое вещество не образуется.
Следовательно, для образования нового вещества исходные частицы сначала должны выйти из устойчивого исходного состояния, то есть повысить свою энергию на величину разности между суммарными энергиями их конечного и исходного состояний, то есть на величину энергии активации (ЕА). Энергия активации – это та минимальная энергия, которая необходима частицам для выведения их из равновесия и перехода в активное состояние.
Процесс образования продуктов реакции можно характеризовать изменением энтальпий исходного и конечного состояний с помощью графика. Пусть потенциальная энергия каждой системы: исходной, состоящей из молекул А2 и В2, и конечной - 2АВ описывается кривыми изменения суммарных потенциальных энергий.
Исходное состояние взаимодействующих молекул характеризуется определенным суммарным значением энтальпии образования Н2, которое соответствует суммарной потенциальной энергии 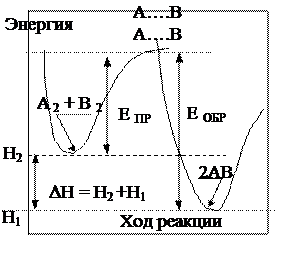 данной системы. На образование переходного состояния (т.н. «активированный комплекс ») требуется затрата энергии, равная величине энергии активации ЕА = ЕПР - для прямой реакции. В результате превращения, новое вещество АВ (продукт реакции), может обладать более низким значением энтальпии Н1, которое также соответствует его суммарной потенциальной энергии, поэтому изменение энтальпий исходного и конечного состояний (DН) называется энтальпией химической реакции и равно тепловому эффекту данной реакции с обратным знаком ΔН = – Q.
данной системы. На образование переходного состояния (т.н. «активированный комплекс ») требуется затрата энергии, равная величине энергии активации ЕА = ЕПР - для прямой реакции. В результате превращения, новое вещество АВ (продукт реакции), может обладать более низким значением энтальпии Н1, которое также соответствует его суммарной потенциальной энергии, поэтому изменение энтальпий исходного и конечного состояний (DН) называется энтальпией химической реакции и равно тепловому эффекту данной реакции с обратным знаком ΔН = – Q.
Соответственно, если реакция обратима, как в большинстве производственных процессов, она может пойти в обратном направлении. В этом случае затраты энергии на образование активированного комплекса будут характеризоваться другой величиной энергии активации - ЕА = ЕОБР., а изменение энтальпии равно по величине энтальпии прямой реакции, но обратно ей по знаку. По графику видно, что DН также можно рассчитать по разности величин энергий активации прямой и обратной реакций: DН = ЕОБР - ЕПР.
Влияние температуры на скорость химической реакции
впервые установил Вант-Гофф. Правило Вант-Гоффа гласит что, при повышении температуры на каждые 10 ° скорость химической реакции возрастает в 2-4 раза. Это правило не является строгим, но, с помощью теории Аррениуса, его справедливость впоследствии была доказана. u t1 /u t2 = g (t2 – t1)/10, k t + 10/ k t = g ~2 – 4, где g - температурный коэффициент.
Данный закон выведен экспериментальным путем для небольшого интервала температур, но часто находит применение в технике. Так в химической кинетике доказывается, что не все частицы, участвующие в химической реакции, способны образовывать новые вещества.
Пример. При образовании HJ из молекул Н2 и J2, находящихся в газообразном состоянии при Т = 700 К и Р = 101,3 кПа, в1 см3 за одну секунду может произойти 2×10 28 столкновений молекул. То есть реакция должна произойти мгновенно. Расчет скорости показывает, что теоретически, скорость реакции должна соответствовать образованию 1,11×1011 моль вещества в 1 см 3 за 1 секунду. Реально же она протекает в 0,9×1014 раз медленнее.
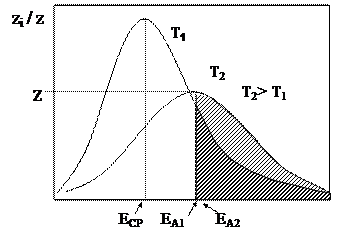 Согласно распределению Максвелла – Больцмана, все частицы, находящиеся в реакционном пространстве, распределяются по энергиям в соответствии с графиком.
Согласно распределению Максвелла – Больцмана, все частицы, находящиеся в реакционном пространстве, распределяются по энергиям в соответствии с графиком.
Пусть z i - число частиц с заданным значением энергии, а zi /z - доля частиц с заданным значением энергии от общего количества частиц; Т1, Т2 – температура реакции, К, где Т1< Т2; Еср1 и Еср2 - средние значения энергии частиц при данных значениях Ti, которым соответствует наибольшая доля реагирующих частиц.
На кривой распределения энергий частиц, участвующих в реакции имеется максимум, которым обладает значительная доля молекул. Вероятность достижения молекулами энергии, превышающей значение ЕА, невелика при низких значениях температур (Т1) и рассчитывается как отношение доли молекул, имеющих энергию активации z° к общему числу частиц z.
Заштрихованная область соответствует доле частиц, обладающих энергией, не меньшей, чем энергия активации. Данные графика свидетельствуют о том, что при низких температурах доля частиц, обладающих энергией, превышающей энергию активации незначительна, а при повышении температуры величина средней энергии частиц может достигать значения энергии активации.
Одно из важных положений химической кинетики состоит в том, что в химической реакции могут принять участие только активные частицы, то есть те, которые обладают энергией, превышающей значение энергии активации. Остальные же в реакцию не вступают. Закон Максвелла-Больцмана позволяет рассчитать количество активных частиц: z° = z × exp(-EA/RT).
С повышением температуры число активных частиц возрастает, а следовательно, число активных столкновений, приводящих к химической реакции, увеличивается, поэтому скорость ее также возрастает. Причем данное правило характерно как для скорости прямой, так и для скорости обратной химических реакций.
Энергия активации – это энергетический барьер, который должны преодолеть частицы для образования новых веществ. Чем выше величина этого барьера, тем труднее его преодолеть, тем выше требуется поднять температуру реакции.
Способность к осуществлению многих химических реакций зависит от величины энергетического барьера. Для образования новых соединений атомы или молекулы должны преодолеть этот энергетический барьер называемый энергией активации. Величина ее зависит от особенностей строения самих веществ и внешних термодинамических факторов.
ПРИМЕР. Не происходит образования молекулы воды из водорода и кислорода, самовозгорания древесины на воздухе при нормальной температуре (или окисления целлюлозы до углекислого газа и воды) и т.п.
При комнатной температуре обычно происходят лишь те реакции, энергия активации которых не превышает значений 60 - 105 кДж /мол. Если значение ЕА < 60 кДж /моль, скорость реакций чрезвычайно высока, если же ЕА <105 кДж /моль - реакция при комнатной температуре крайне замедлена, при ЕА >150 кДж /моль - реакция маловероятна.
Поскольку υ ~ [A]× [B], а коэффициентом пропорциональности является k, то именно она и должна учитывать долю активных столкновений частиц, приводящих к химическому взаимодействию. k = f (z °), то есть: 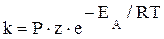 , где Р× z = ko – коэффициент пропорциональности, постоянная Аррениуса.
, где Р× z = ko – коэффициент пропорциональности, постоянная Аррениуса. 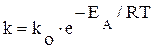
Данное уравнение носит название уравнения Аррениуса. Величина z° входит в значение константы скорости химической реакции, определяя ее зависимость от температуры для прямой и обратной реакции, соответственно в виде:
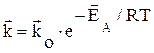 ;
; 
Для осуществления химических реакций, энергия активации которых превышает указанное значение, требуется увеличение кинетической энергии реагирующих частиц либо изменение схемы технологического процесса. Первое осуществляется, как правило, путем изменения термодинамических параметров: Т, Р, V или концентрации, второе – путем введения веществ, ускоряющих химические реакции – катализаторов или тормозящих нежелательные процессы – ингибиторов.
Типы химических реакций
Все типы химических реакций можно подразделить на простые и сложные. К простым - относят реакции, в которых происходит обычное столкновение молекул, приводящее к образованию нового вещества. Сложные подразделяются на:
 - параллельные, идущие в одну сторону, но протекающие одновременно (реакция разложения бертолетовой):
- параллельные, идущие в одну сторону, но протекающие одновременно (реакция разложения бертолетовой):
6 KClO3 = 3 KClO4 + KCl
= 2 KCl + 3O2
- последовательные, где одна реакция, предшествует другой (реакции, лежащие в основе выплавки стали):
Fe2O3 + CO → 2 FeO + CO2; FeO + CO → Fe + CO2.
- сопряженные, в которых одна реакция идет только в присутствии другой: основная реакция Zn + H2O → Zn(OH)2 + H 2 ↑
вспомогательная реакция 2ZnSO4+ 2H2O→(ZnOH)2SO4 + H2SO4
механизм протекания реакции:
 Цинк вступает в химическую реакцию с водой при нормальных условиях, только в присутствии соли сульфата цинка, поскольку, в результате гидролиза, образуется серная кислота, которая взаимодействует с активным металлом, вытесняющим из нее водород.
Цинк вступает в химическую реакцию с водой при нормальных условиях, только в присутствии соли сульфата цинка, поскольку, в результате гидролиза, образуется серная кислота, которая взаимодействует с активным металлом, вытесняющим из нее водород.
- обратимые, идущие как в прямом, так и в обратном на правлении: 2ZnSO4 + 2H2O ↔ (ZnOH)2SO4 + H2SO4 – гидролиз.
Обратимые реакции относят к особому типу химических реакций, поскольку в условиях промышленного производства в замкнутой системе, практически не существует необратимых процессов. Понятие обратимости тесно связано с учением о равновесных химических процессах.
При решении задач, следует учесть, что СИСХ = [C] + DС, где СИСХ – исходная концентрация вещества; [C] – равновесная концентрация вещества; DС – концентрация прореагировавшего вещества или ее изменение во времени, соответственно, моль/л.
В начале реакции, ее продуктов еще нет, поэтому их концентрации равны 0. Изменение концентраций продуктов реакции при наступлении равновесия, численно равны равновесным концентрациям веществ.
ПРИМЕР. Дана реакция: 2HCl = Cl2 + H2. Рассчитать равновесные концентрации компонентов, если СИСХ (НСl) = 0,5, а прореагировало 0,1 моль/л.
| Условие задачи: | Дано: Вступило в реакцию | Рассчитать: | Дано: Прореагировало | DС для Н2 и Сl2 определяется по соотношению компонентов в уравнении реакции |
| СИСХ | [C]= СИСХ - DС | DС | ||
| HCl | 0,5 | 0,5 - 0,1 = 0,4 | 0,1 | |
| H2 | |0,5| | 0,5 | ||
| Cl2 | |0,5| | 0,5 |
Задания к разделу 7.2
| 1. | Константа скорости реакции 2АГ + ВГ ↔ СГ равна 0,8. С ИСХ,А и С ИСХ,В равны 2,5 моль/л и 1,5 моль/л, соответственно. В результате реакции, при t ¹ 0 [В] оказалась равной 0,5 моль/л. Вычислить, чему стала равна [А] и ut¹0. | |||
| 2. | В системе 2NOГ + Сl2Г↔ 2NOClГ CИСХ NO и Cl2 равны 0,4 моль/л и 0,3 моль/л, соответственно. Во сколько раз изменится скорость реакции по сравнению с начальной, в тот момент, когда успеет прореагировать 50% NO? | |||
| 3. | Скорость химической реакции 2NOГ + О2 Г↔ 2NO2 Г при СИСХ NO = 0.3 моль/л и О2 – 0,15 моль/л равна 1,2×10–3 моль/л×с . Найти значение k скорости реакции. | |||
| 4. | При 508 0С k скорости реакции Н2 + J2 ↔ 2НJ равна 0,16, CИСХ Н2 и J2 равны 0,04 моль/л и 0,05 моль/л, соответственно. Определить uо реакции и скорость ut¹о, когда СИСХ водорода уменьшилась вдвое. | |||
| 5. | В сосуд емкостью 10 л ввели 3,2 г паров серы и 6,4 г О2. Во сколько раз скорость химической реакции SГ+ О2 Г→ SO2 Г в начальный момент будет отличаться от скорости этой же реакции в момент, когда прореагировало 20 % серы? | |||
| 6. | Во сколько раз необходимо увеличить С А, чтобы при уменьшении С В в 4 раза скорость реакции 2АГ + ВГ ↔ СГ не изменилась? | |||
| 7. | Константа скорости реакции N2 + O2 ↔ 2NO равна 0,8. СИСХ (моль/л), N2 = 0,049, С ИСХ O2 = 0,01. Определить их концентрацию в момент (t¹0), когда образовалось 0,005 моль/л NO, и uо и ut¹0. | |||
| 8. | Реакция идет по уравнению 2NO + О2 → 2NO2. Концентрации исходных веществ были: NO – 0,03 моль/л, О2 – 0,05 моль/л. Как изменится скорость реакции, если увеличить концентрацию О2 до 0,1 моль/л и концентрацию NO до 0,06 моль/л? | |||
| 9. | Окисление серы и оксида серы(IV) идут по уравнениям: SК + О2Г ↔ SO2Г; 2SO2Г + О2Г ↔ 2SO3Г. Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в 4 раза. | |||
| 10. | Реакция между веществами А и В протекает по уравнению 2А + В ↔ С, концентрация вещества А равна 6 моль/л , а вещества В – 5 моль/л. Константа скорости реакции равна 0,5. Вычислить скорость химической реакции в начальный момент и в момент, когда в реакционной смеси останется 45 % вещества В. | |||
| 11. | Константа скорости реакции АГ + 2ВГ ↔ 3СГ равна 0,6 л2×моль–2×с–1. Начальные концентрации А и В равны 1,0 моль/л и 3,0 моль/л, соответственно. В результате реакции концентрация вещества В уменьшилась на 0,8 моль/л. Вычислить, чему стала равна концентрация вещества А и скорость реакции ut¹0. | |||
| 12. | Начальные концентрации веществ в реакции СО + Н2ОГ ↔ СО2 + Н2 были равны (моль/л): СО = 0,5; Н2ОГ = 0,6; СО2 = 0,4; Н2 = 0. Вычислить концентрации всех веществ после того, как прореагировало 60 % Н2О и скорости прямой реакции ut=0 и ut¹0, если  . .
| |||
| 13. | В процессе реакции 3А + 4В ↔ С концентрация вещества А уменьшилась на 0,06 моль/л. Как изменились концентрации веществ В и С? Рассчитать скорости прямой реакции ut=0 и ut¹0, если С о,А и С о,В были равны 2,5 моль/л и 4,5 моль/л, соответственно, а 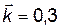 . .
| |||
| 14. | СИСХ (моль/л) реагентов N2 и Н2 равны 1,2 и 2,2, соответственно. Определить концентрации N2 и Н2 в момент достижения продукта реакции NH3 концентрации 0,4 моль/л? Рассчитать скорости прямой реакции ut=0 и ut¹0, если  . .
| |||
| 15. | Рассчитать скорости прямой реакции СОГ + Н2ОГ ↔ Н2Г + СО2Г ut,1 и ut,2, если  . В при t1 концентрации (моль/л) веществ равны: СО = 0,24; Н2ОГ = 0,4; СО2 = 0,3; Н2 = 0,1. Вычислить концентрации всех веществ в реакции после того (t2), как прореагировало 40 % СО. . В при t1 концентрации (моль/л) веществ равны: СО = 0,24; Н2ОГ = 0,4; СО2 = 0,3; Н2 = 0,1. Вычислить концентрации всех веществ в реакции после того (t2), как прореагировало 40 % СО.
| |||
| 16. | Рассчитать ut,1 и ut,2 прямой реакции Н2 + J2 ↔ 2HJ, если  . В момент времени t1 С (моль/л) были: Н2 – 0,049; J2 – 0,024 и HJ – 0,01. Найти концентрации всех участвующих в реакции веществ при t2, когда концентрация водорода уменьшится на 0,012 моль/л. . В момент времени t1 С (моль/л) были: Н2 – 0,049; J2 – 0,024 и HJ – 0,01. Найти концентрации всех участвующих в реакции веществ при t2, когда концентрация водорода уменьшится на 0,012 моль/л.
| |||
| 17. | При некоторой температуре константа скорости 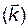 реакции Н2 + I2 ↔ 2HI равна 0,16. Начальные концентрации Н2 – 0,04 моль/л; I2 – 0.05 моль/л. Определить начальную скорость реакции и скорость в момент, когда концентрация водорода уменьшилась вдвое. реакции Н2 + I2 ↔ 2HI равна 0,16. Начальные концентрации Н2 – 0,04 моль/л; I2 – 0.05 моль/л. Определить начальную скорость реакции и скорость в момент, когда концентрация водорода уменьшилась вдвое.
| |||
| 18. | Для реакции 2NOГ + Сl2Г↔ 2NOClГ начальные концентрации NO и Cl2 равны 0,4 моль/л и 0,4 моль/л, соответственно. Во сколько раз по сравнению с начальной изменится скорость реакции в тот момент, когда успеет прореагировать половина оксида азота? | |||
| 19. | Скорость образования HI из H2 и J2 при 443 оС равна 1,5·10 -2 моль/л×с, когда [H2] = [ J2] = 1 моль/л. Скорость распада HJ при той же температуре и при [HJ] = 1 моль/л равна 3,0·10–4 моль/л×с. Вычислить К равновесное при данной температуре. | |||
| 20. | Средняя скорость реакции H2 + CI2 ↔ 2HCI 0,04 моль/л·с. Каковы концентрации H2 и CI2 через 20 с после начала реакции, если их начальные концентрации были 2 моль/л и 3 моль/л, соответственно? | |||
| 21. | Во сколько раз следует увеличить концентрацию окиси углерода(II) в системе 2COГ ↔ СО2Г + СТВ, чтобы скорость реакции увеличилась в 4 раза? | |||
| 22. | Рассчитать для 2COГ + О2Г ↔ 2СО2Г значение константы скорости реакции, если при концентрации веществ СО и О2, равных, соответственно 0,02 моль/л и 0,0065 моль/л, скорость реакции равна 6·10–4 моль/л с. | |||
| 23. | Для прямой реакции 2АГ + ВГ ↔ 2СГ k = 0,8 л2×моль–2×с–1. Начальные концентрации (моль/л) С о,А = 0,3 и С о,В = 0,5. В результате реакции концентрация вещества А уменьшилась на 0,1 моль. Вычислить скорости реакции uо и ut¹о. | |||
| 24. | Реакция идет по уравнению 4NH3Г + 5О2Г ↔ 4NOГ + 6Н2Опар. Как изменить скорость прямой реакции, если увеличить давление в 2 раза? | |||
| 25. | Во сколько раз изменится скорость реакции 2COГ + О2Г ↔ 2СО2Г, если концентрацию СО увеличить в 2 раза, а концентрацию вещества О2 уменьшить в 2 раза? | |||
| 26. | Для прямой гомогенной реакции АГ + 2ВГ ↔ СГ k = 0,3 л2× моль–2×с–1. Начальные концентрации (моль/л) С о,А = 2 и С о,В = 2,5. В результате реакции концентрация вещества В оказалась равной 0,5 моль/л. Вычислить скорости реакции uо и ut¹0. | |||
| 27. | В системе 2NOГ + Сl2Г↔ 2NOClГ начальные концентрации NO и Cl2 равны 0,2 моль/л и 0,2 моль/л, соответственно. Во сколько раз изменится скорость реакции по сравнению с начальной в тот момент, когда успеет прореагировать половина оксида азота? | |||
| 28. | В сосуд емкостью 1,25 л ввели 0,4 г паров серы и 0,8 г О2. Во сколько раз скорость химической реакции SГ+ О2 Г→ SO2 Г в начальный момент будет отличаться от скорости в момент, когда прореагировало 20 % серы? | |||
| 29. | Реакция между веществами А и В протекает по уравнению 2А + В ↔ С. Константа скорости реакции равна 0,3. Вычислить скорости химической реакции в начальный момент, когда концентрации вещества А равна 3 моль/л , а вещества В – 2 моль/л, и в момент, когда в реакционной смеси останется 60 % вещества В. | |||
| 30. | В процессе реакции 3А + 4В ↔ С концентрация вещества А уменьшилась на 0,1 моль/л. Как при этом изменились концентрации веществ В и С? Рассчитать скорости прямой реакции ut=0 и ut¹0, если С о,А и С о,В были равны 2,0 моль/л и 3,0 моль/л, соответственно, а 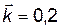 . .
| |||
| 31. | Начальные концентрации (моль/л) реагентов N2 и Н2 равны 1,0 и 2,0, соответственно. Чему равны концентрации азота и водорода в момент достижения продуктом реакции NH3 концентрации 0,2 моль/л? Рассчитать скорости прямой реакции ut=0 и ut¹0, если 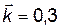 . .
| |||
| 32. | Рассчитать скорости прямой реакции СОГ + Н2ОГ ↔ Н2Г + СО2Г ut,1 и ut,2, если 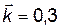 . В некоторый момент времени (t1) концентрации (моль/л) веществ равны: СО = 0,3; Н2ОГ = 0,5; СО2 = 0,1; Н2 = 0,2. Вычислить концентрации всех веществ в реакции после того (t2), как прореагировало 20 % СО. . В некоторый момент времени (t1) концентрации (моль/л) веществ равны: СО = 0,3; Н2ОГ = 0,5; СО2 = 0,1; Н2 = 0,2. Вычислить концентрации всех веществ в реакции после того (t2), как прореагировало 20 % СО.
| |||
| 33. | Для реакции 2NOГ + Сl2Г↔ 2NOClГ начальные концентрации NO и Cl2 равны 0,2 моль/л и 0,3 моль/л, соответственно. Во сколько раз по сравнению с начальной изменится скорость реакции в тот момент, когда успеет прореагировать 30 % оксида азота? | |||
| 34. | Константа скорости реакции 2АГ + ВГ ↔ 2СГ равна 0,4 л2×моль–2×с–1. С о,А = 0,2 и С о,В = 0,4. В результате реакции концентрация вещества В уменьшилась на 0,1 моль. Вычислить скорости реакции uо и ut¹0. | |||
| 35. | Константа скорости реакции 2АГ + 3ВГ ↔ СГ равна 0,8 л4×моль–4×с–1. Начальные концентрации С о,А и С о,В равны 1,0 моль/л и 1,5 моль/л, соответственно. В результате реакции в момент времени t ¹ 0 концентрация вещества В оказалась равной 1,0 моль/л. Вычислить, чему стала равна концентрация вещества А и скорость реакции ut¹о. | |||
| 36. | Константа скорости реакции 3Н2 + N2 ↔ 2NН3 равна 0,16 л3×моль–3×с–1, начальные концентрации Н2 и N2 равны 0,09 моль/л и 0,03 моль/л, соответственно. Определить начальную скорость (uо) реакции и скорость (ut¹о), когда концентрация водорода уменьшилась на 20 %. | |||
| 37. | В сосуд емкостью 15 л ввели 4,8 г паров серы и 9,6 г О2. Во сколько раз скорость химической реакции SГ+ О2 Г→ SO2 Г в начальный момент будет отличаться от скорости этой же реакции в момент, когда прореагировало 20 % серы? | |||
| 38. | Константа скорости реакции N2 + O2 ↔ 2NO равна 0,4 л×моль–1×с–1. СИСХ (моль/л) С о, N2 = 0,08, С о, О2 = 0,02. Определить концентрацию этих веществ в момент (t¹0), когда образовалось 0,01 моль/л NO, и скорости (uо и ut¹о) реакции. | |||
| 39. | Реакция между веществами А и В протекает по уравнению 2А + В ↔ С, начальные концентрации (моль/л) С о,А = 3, а С о,В = 2. Константа скорости реакции равна 0,5 л2×моль–2×с–1. Вычислить скорости реакции в начальный момент и в момент, когда в реакционной смеси останется 30 % от исходного количества вещества В. | |||
| 40. | Начальные концентрации (моль/л) реагентов N2 и Н2 равны 0,6 и 1,1, соответственно. Чему равны концентрации азота и водорода в момент достижения продуктом реакции NH3 концентрации 0,2 моль/л? Рассчитать скорости прямой реакции ut=о и ut¹о, если  . .
| |||
| 41. | Для реакции 2NOГ + Сl2Г↔ 2NOClГ начальные концентрации NO и Cl2 равны 0,3 моль/л и 0,2 моль/л, соответственно. Во сколько раз по сравнению с начальной изменится скорость реакции в тот момент, когда успеет прореагировать 40 % оксида азота? | |||
| 42. | Константа скорости реакции 2АГ + 3ВГ ↔ СГ равна 0,8 л4×моль–4×с–1. Концентрации С о,А и С о,В равны 0,1 и 0,3 моль/л, соответственно. В результате реакции в момент времени t ¹ 0 концентрация вещества В уменьшилась на 0,1 моль. Вычислить, чему стала равна концентрация вещества А и скорости реакции ut=о и ut¹о. | |||
| 43. | Известно, что константа скорости реакции первого порядка и
Поиск по сайту©2015-2025 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование. Дата создания страницы: 2016-07-22 Нарушение авторских прав и Нарушение персональных данных |
Поиск по сайту: Читайте также: Деталирование сборочного чертежа Когда производственнику особенно важно наличие гибких производственных мощностей? Собственные движения и пространственные скорости звезд |