СОДЕРЖАНИЕ
Введение. 2
Глава 1. Литературный обзор. 3
Глава 2.Свойства молибдена и его соединений. 7
2.1. История открытия элемента. 7
2.2. Физические свойства молибдена. 8
2.3. Природные соединения молибдена. 9
2.4. Электронная структура атома, его расположение в периодической системе химических элементов Д. И. Менделеева. 11
2.5. Химические свойства молибдена, его оксидов и гидроксидов. 14
2.5.1. С водородом. 16
2.5.2. С галогенами. 16
2.5.3. С серой. 19
2.5.4. С азотом. 20
2.5.5. С углеродом. 20
2.5.6. С кислородом. 21
2.6. Биологическая роль молибдена. 23
2.7. Применение молибдена. 25
2.8. Экологическое влияние отходов молибденовой промышленности. 28
Глава 3. Методы и методики получения молибдена и его соединений. 30
3.1. Основы технологии переработки молибденовых руд. 30
3.2. Получение парамолибдата аммония (NH4)6Mo7O24 × 4H2O.. 31
3.3. Получение молибденовой кислоты Н2МоО4 или молибдата кальция СаМоО4 36
3.4. Возгонка из огарков МоО3 38
3.5. Получение гетерополикислот. 39
3.6. Другие методы получения соединений молибдена. 40
Глава 4.Извлечение молибдена из отработанных руд методом экстракции. 47
Выводы. 50
Список использованной литературы. 51
Введение
Согласно современных данных, при переработке молибденовых руд процент потерь молибдена составляет около 30 - 40 %, что для современного производства является очень высоким показателем. Поэтому перед современной химической промышленностью стоит задача разработать методы и пути переработки отходов производства молибдена с целью повышения его выхода.
Актуальность темы: работа должна способствовать утилизации отходов, вторичная переработке отходов производства молибдена
Цель работы: определить основные способы переработки отходов производства молибдена.
Задачи: разработать пути совершенствования обработки молибденсодержащих отвалов и отходов с целью повышения выхода молибдена из сырья.
Объект: отходы после переработки молибденовых руд, а также отвалы и шлаки после выделения молибденового ангидрида МоО3.
Предмет: предметом работы является рассмотрение основных методов переработки молибденовых руд и выделения из них молибденового концентрата в разном виде для дальнейшей переработки.
Глава 1. Литературный обзор
Молибден находит широкое применение в современной технике, как в виде чистого металла, так и как компонент сплавов. Большие количества молибдена потребляет металлургия для получения легированных сталей и чугунов, жаропрочных и корозионностойких сплавов. В советском Союзе собственное производство молибдена было налажено в 1928 году. Широкое применение молибдена потребовало проведения широких научных исследование его свойств, методик получения его соединений из руд, получения чистого молибдена. Поэтому в печати вышло достаточно большое количество книг и монографий, которые рассматривали свойства молибдена, а также различные аспекты получения данного металла.
Использование минералов, содержащих молибден, история открытия данного элемента подробно рассмотрена Б. В. Некрасовым в [12]. Также в [12] дано обзор основных минералов, содержащих молибден. Более подробно минералогию молибдена рассмотрено в [20], где поведено полное описание всех минералов, которые содержат молибден. Также проведено анализ запасов молибденовых руд на основе территориального принципа, приведены приблизительные запасы молибденовых руд в различных странах, а также экономически обоснованные данные по их разработке. Рассмотрены причины разработки скарновых руд молибдена.
Свойства молибдена подробно рассмотрены К. А. Большаковым в [20]. Также основные свойства молибдена подробно рассмотрены в [22], а также различных справочниках, например [6], [16], где приведены не только основные физические свойства молибдена, но и свойства его основных соединений и различные константы, например комплексных соединений. Надо отметить некоторое несовпадение основных констант для молибдена взятых из различных источников. Поэтому при написании работы ориентировались, в основном, на данные, взятые из [22].
Химические свойства молибдена подробно рассмотрены многими авторами. Свойства молибдена довольно полно описаны К. А. Большаковым в [20]. Свойства комплексных соединений молибдена рассмотрены в [3] А. И. Бусевым, в монографии которого основной упор сделано на методы и способы выявления соединений молибдена в растворах и рудах, рассмотрены способы растворения соединений молибдена и перевода их в раствор. Биологическая роль молибдена и его соединений, их токсичность раскрыты в [22], где показано влияние молибдена и его соединений на процессы окисления ферментами различных веществ белковой природы. Показана также антираковая активность молибдена, приведены дневные нормы потребления молибдена в зависимости от возраста человека.
Переработка молибденовых руд и получение полуфабрикатов для изготовления металлического молибдена, приведены в работах [8], [9], [14], [17], [20], [23]. Наиболее полно получение оксида молибдена МоО3 из молибденсодержащих руд показано в работе [8], [20]. В работе [8] А. Н. Зеликман и Б. Г. Коршунов показали получение оксида молибдена из молибденовых руд, также в работе [8] показано получение оксида молибдена из руд, содержащих вольфрам. Технология гравитационного обогащения молибденовых руд описана в работе [2].
Наиболее полно технология получения полуфабрикатов молибдена и переработка молибденовых руд показана в работе [20]. В ней К. А. Большаков детально остановился на описании процессов протекающих при переработке молибденовых руд и получении оксида молибдена. Показана роль окислительного обжига молибденового концентрата для получения оксида молибдена. В работах [8], [20] рассмотрено получение различных соединений молибдена из огарков после обжига молибденового концентрата. В работе [20] детально рассмотрено получение различных соединений молибдена: парамолибдата аммония (NH4)6Mo7O24 × 4H2O, молибденовой кислоты Н2МоО4 или молибдата кальция СаМоО4, гетерополикислот молибдена. В работе [20] К. А. Большаков детально остановился на переработке отвалов и отходов молибденового производства с целью получения товарного молибдена. Согласно работы [20] отвалы от выщелачивания раствором NH3 огарков, полученных после обжига богатых молибденовых концентратов, могут содержать до 20 – 25% Мо в составе соединений, не разлагаемых растворами аммиака, - СаМоО4, MoO2, MoS2. в работе [20] К. А. Большаков рассматривает различные методы извлечения молибдена из отвалов, а именно при помощи спекания отвалов с содой и последующим выщелачиванием спекшейся массы водой, при помощи выщелачивания растворами соды в автоклавах и обработкой отвалов кислотами.
Наиболее интересен метод обработки отвалов кислотами, поскольку он позволяет проводить обработку отвалов, содержащих значительное количество соединений вольфрама. В работе [20] показано, что вольфрамат кальция соляной кислотой на холоду не разлагается, что позволяет частично разделять соединения вольфрама и молибдена. Поэтому солянокислая обработка рациональна, если в отвалах от аммиачного выщелачивания есть соединения вольфрама.
При переработке отвалов молибденового производства наиболее рациональным является использование процессов ионного обмена или экстракции, что позволяет не использовать сложной аппаратуры, высоких давлений и температур. Процессы экстракции молибдена из растворов рассмотрены в работах [11], [13]. В работе [11] Меркин Э. Н. на основе данных исследований рассмотрел возможность выделения некоторых металлов, среди которых был и молибден, органическими жирными кислотами. В работе рассмотрено влияние на экстракцию вида неорганического аниона, РН среды, растворителя и других условий экстракции.
Экстракция молибдена детально рассмотрена в работе [13]. Г. Ритчи и А. Эшбрук показали, что из анионообменных экстрагентов молибден достаточно успешно экстрагируется триоктиламином (C8H17)3N и аммониевым основанием – диалкилметилбензиламмоний хлоридом. Рассмотрена также экстракция молибдена трибутилфосфатом (C4H9)3PO4, метилизобутилкетоном C5H12CO, циклогексаноном (СН2)5СО и ацетофеноном СН3СОС6Н5. Экстрагирование молибдена дорганическими веществами с целью его выделения из отходов молибденового производства является наиболее рациональным способом получения молибдена.
Глава 2.Свойства молибдена и его соединений
Рассмотрим основные физические и химические свойства молибдена, что поможет в дальнейшем объяснить его способы переработки и извлечения из руд.
2.1 История открытия элемента
Молибденит (дисульфид молибдена, MoS2) был известен древним грекам и римлянам с незапамятных времен [1, 12]. Этот свинцово-серый с металлическим блеском минерал (другое название – молибденовый блеск) сходен с галенитом (свинцовым блеском, PbS) и графитом. Мягкость минерала позволяла использовать его (вместе с графитом) как грифель для карандашей, поэтому долгое время молибденит путали с галенитом и графитом, хотя, в отличие от последнего, он оставлял на бумаге зеленовато-серый цвет. В средневековой Европе три минерала (PbS, MoS2 и графит) имели одно название – Molybdaena. История открытия элемента № 42 связана со Швецией. В 1758 шведский минералог и химик Аксель Фредерик Кронштедт (1722–1765) высказал предположение, что графит, галенит и молибденовый блеск три самостоятельных вещества [12]. Двадцать лет спустя, в 1778, химическим составом молибденита заинтересовался шведский химик Карл Вильгельм Шееле. Прокипятив его с концентрированной азотной кислотой, он получил белый осадок «особой белой земли», которую назвал молибденовой кислотой. Хотя во времена Шееле и не знали, что «земли» представляют собой оксиды металлов, уникальная химическая интуиция подсказывала ему, что металл можно получить прокаливанием молибденовой кислоты с углем. Экспериментальные трудности (у него не было подходящей печи) не позволили Шееле самостоятельно решить эту задачу и лишь в 1782 шведскому химику Петеру Якобу Гьельму, которому Шееле прислал образец молибденовой кислоты, удалось восстановить ее углем и получить королек металла (сильно загрязненного карбидами) [12, 17, 18]. После удачно проведенного опыта Шееле писал Гьельму: «Радуюсь, что мы теперь обладаем металлом – молибденом!». Относительно чистый металл удалось получить много лет спустя Йенсу-Якобу Берцелиусу в 1817 [18]. Совершенно чистый молибден, способный к ковке, получили лишь в начале 20 века [14].
2.2 Физические свойства молибдена
Внешний вид металлического молибдена зависит от способа его получения. Компактный (в виде слитков, проволоки, листов, пластин) молибден – довольно светлый, но блеклый металл, а молибден, полученный в виде зеркала разложением, например, карбонила – блестящий, но серый [20, 23]. Молибденовый порошок имеет темно-серый цвет. Плотность молибдена 10280 кг/м3. Температура плавления 2623° С, кипения 4639°С [ 6, 16]. Основные физические свойства молибдена приведены в таблице 1.
Таблица 1. Основные физические свойства молибдена
| Атомный радиус, А° | 1,36 |
| Грамм-атомный объем, см3 | 9,41 |
| Ионный радиус, А: | |
| Мо2+, А | 1,01 |
| Мо4+, А | 0,68 |
| Мо6+, А | 0,5 – 0,62 |
| Плотность, г/см3 | 10,21 |
| Т. пл., °С | 2622±10 |
| Т. кип., °С | ~ 4864 |
| Кристаллическая решетка | Пространственно-центрированная кубическая |
| Потенциал ионизации, В | 7,2 (Мо0→ Мо1+) |
| Поперечное сечение захвата тепловых нейтронов, барн/атом | 2,7 |
Известна только одна (при обычном давлении) кристаллическая модификация металла с кубической объемно центрированной решеткой. В совершенно чистом состоянии компактный молибден пластичен, ковок, тягуч, довольно легко подвергается штамповке и прокатке. При высоких температурах (но не в окислительной атмосфере) прочность молибдена превосходит прочность большинства остальных металлов. При загрязнении углеродом, азотом или серой молибден, подобно хрому, становится хрупким, твердым, ломким, что существенно затрудняет его обработку. Водород очень мало растворим в молибдене, поэтому не может, заметно влиять на его свойства. Молибден – хороший проводник электричества, он в этом отношении уступает серебру всего в 3 раза. Электропроводность молибдена больше, чем у платины, никеля, ртути, железа и многих других металлов [20]. В обычных условиях молибден устойчив даже во влажном воздухе.
2.3 Природные соединения молибдена
Из 17 известных минералов Мо наиболее существенное промышленное значение до сих пор имеет молибденит MoS2 [20]. Из руд, содержащих молибденит, добывают подавляющую массу молибдена. В зоне окисления молибденовых, медно-молибденовых и вольфрамо - молибденовых месторождений встречаются повеллит, молибдит (ферримолибдит) Fe2Os∙3MoO3∙7H2О молибдошеелит Са(Мо,W)O4, вульфенит РЬМоО4, чиллагит Pb(Mo, W)O4, линдгренит Си3(МоО4)2(ОН)2 и другие комплексные минералы (с висмутом, мышьяком, оловом и т. д.) Первые три минерала последнее время приобретают некоторое промышленное значение [23]. Это связано с тем, что по мере выработки богатых чисто сульфидных молибденовых и комплексных месторождений начинают разрабатываться месторождения смешанных сульфидно-окисленных руд. В сульфидных месторождениях окисленные минералы встречаются как в виде пленок на молибдените, так и в виде самостоятельных кристаллов вторичного происхождения.
Молибденит – минерал черного цвета, внешне очень похожий на графит. Имеет чешуйчатое строение. Кристаллизуется в гексагональной слоистой решетке [20]. При нормальной температуре химически устойчив. Начинает окисляться на воздухе выше 300 – 400°С. При 500 – 550°С сгорает полностью до МоО3 и частично до МоО2. При более высокой температуре получающийся МоО3 возгоняется и, охлаждаясь, образует друзы бледно зеленоватых игл. Плотность минерала 4,75, твердость по Моосу 1. Молибденит обладает хорошими смазывающими свойствами. Постоянная примесь в нем – рений.
Повеллит – наиболее распространенный минерал зоны окисления молибденовых месторождений. Серый. Плотность 4,3, твердость
по Моосу 3,5. Кристаллизуется в бипирамидах тетрагональной системы. При облучении ультрафиолетовым излучением люминесцирует. Это может использоваться в анализе и обогащении руд. Цвет люминесценции желтый. Очень хрупок и поэтому переизмельчается при дроблении.
Молибдо - шеелит – разновидность шеелита, в которой часть атомов W замещена атомами Мо (обычно не выше нескольких процентов). Разности, содержащие до 15% Мо, носят название зейригит [20, 23]. Кристаллы молибдо - шеелита, как и повеллита, - тетрагональные бипирамиды. Плотность 5,8—6,2, твердость по Моосу 4,5. Минерал, содержащий более 0,5% W, в ультрафиолетовых лучах люминесцирует желтым цветом.
Молибдит Fe2(MoO4)3∙7H2O, или Fe2O3∙xMoO3∙yH2O, - чешуйчатый, мягкий минерал серо-желтого цвета. Образуется в участках месторождений, содержащих большое количество железных минералов.
Вульфенит РЬМоО4 – минерал тетрагональной сингонии. Образует буро-коричневые или красные бипирамиды.
Другие минералы молибдена встречаются, в частности, в урановых полиметаллических месторождениях, осадочных породах органического происхождения.
Промышленные молибденовые руды делятся по форме рудных тел и минеральному составу на жильные (кварцевые), прожилково-вкрапленные (медно-молибденовые, медные порфировые, с молибденом) и скарновые (молибденовые, волъфрамо-молибденовые, медно-молибденовые). Ранее наибольшее значение имели кварцевые жильные месторождения. Среднее содержание молибдена в них было 0,3 – 0,4% и до 1 %. Они в основном выработаны. Сейчас наибольшее значение имеют молибденовые, медно-молибденовые и медно-порфировые месторождения прожилково-вкрапленного типа, а также скарновые. В первых молибдена 0,05 – 0,15%, а в наиболее крупных (Клаймакс, США) – до 0,4% [20]. Вкрапленность молибдена в них значительно более мелкая, чем в жилах. Сопутствующие рудные минералы – халькопирит, пирит, реже другие сульфиды, арсениды, магнетит. Как из медно-молибденовых, так и из медно-порфировых руд молибден добывают попутно с медью. Это экономически выгодно и в случае очень низкого содержания молибдена.
Скарновые руды – это руды, образовавшиеся на контакте известняков и кислых пород типа гранитов. Сопутствующие рудные минералы в них те же, что и в предыдущих типах руд. Но особенно обычен комплекс с шеелитом и другими вольфрамсодержащими минералами. Из нерудных минералов преобладают кварц, кальцит, флюорит. Оболочки вторичных окисленных образований осложняют обогащение сульфидной руды. Обогащение осложняется также мелкой вкрапленностью сульфидных минералов, большим содержанием кальцита, доломита, флюорита.
2.4 Электронная структура атома, его расположение в периодической системе химических элементов Д. И. Менделеева
Порядковый номер элемента в периодической системе химических элементов Д. И. Менделеева равен 42 [1, 5, 12]. Это значит, в молекуле молибдена будет 42 электрона.
Электронная формула молибдена будет такова: 
Составим также его электронно-графическую формулу:

Рис. 1. Электронно-графическая формула молибдена.
На рис. 1 приведена электронно-графическая формула молибдена, на которой указано расположение всех электронов в атоме молибдена.
Порядковый номер химического элемента в периодической системе химических элементов – 42. У молибдена на электронных уровнях находится 42 электрона, а в ядре должно находится также 42 протона.
Молибден расположен в периодической системе химических элементов в пятом периоде, это значит, что у него будет пять электронных слоев с расположенными на них электронами. Главное квантовое число внешнего электронного уровня равно 5.
Молибден расположен в шестой группе, побочной подгруппе. Молибден относят к элементам подгруппы хрома, в которую входят хром, молибден и вольфрам, которые обладают похожими свойствами. У него будет на электронных уровнях один s-электрон и 5 d-электронов на предвнешнем уровне.
В состав ядра атома изотопа молибдена-96 входят 42 протона (p) и 54 нейтрона (n):  , где массовое число и порядковый номер элемента (число протонов) обозначают числовыми индексами слева от символа химического элемента; верхний индекс означает массовое число, нижний – заряд ядра. Количество нейтронов ядра элементов определяют по массовому числу элемента за вычетом количества протонов.
, где массовое число и порядковый номер элемента (число протонов) обозначают числовыми индексами слева от символа химического элемента; верхний индекс означает массовое число, нижний – заряд ядра. Количество нейтронов ядра элементов определяют по массовому числу элемента за вычетом количества протонов.
Таким образом, в состав атома молибдена входят ядро, состоящее из 42 протонов, 54 нейтронов и электронное облако, представленное 42 электронами.
Вследствие устойчивости d5-конфигурации энергетически оказывается более выгодным переход одного из ns-электронов в (n-1) d-состояние. Поэтому молибден, как и хром в s-состоянии внешнего уровня имеют по одному, а в предпоследнем слое по 13 электронов. Таким образом, имеет место «проскок» электрона:

Проскок электрона можно объяснить с точки зрения квантово-механических представлений повышенной энергетической стабильностью конфигурации: 4d5 [1, 5].
Покажем расположение валентных электронов в атоме молибдена. Как видно из электронной формулы молибден относится к d-элементам, поскольку у него заполняется 4d-подуровень.

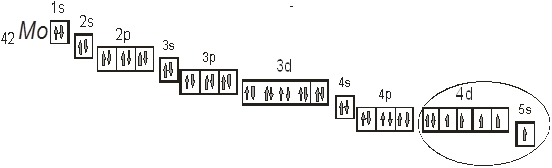
Рис. 2. Расположение валентных электронов в атоме молибдена.
На приведенном рис. 2 эллипсом выделено расположение валентных электронов в атоме молибдена. Как видно в создании химической связи будут брать участие электроны как 5s- так и 4d-подуровня.
Поскольку молибден расположен в шестой группе периодической системы, и не в главной подгруппе, а в побочной, то он относится к металлам. В химических реакциях он будет проявлять металлические свойства. Для металлов более приемлема отдача электронов. Поэтому молибден может отдавать максимум шесть электронов с  - подуровня и с 4d-подуровня. Поэтому молибден будет проявлять степень окисления +2, +3, +4, +5, +6. соединения с этими степенями окисления обладают разной стойкостью, наиболее стойкими будут соединения с степенью окисления равной +6 [1].
- подуровня и с 4d-подуровня. Поэтому молибден будет проявлять степень окисления +2, +3, +4, +5, +6. соединения с этими степенями окисления обладают разной стойкостью, наиболее стойкими будут соединения с степенью окисления равной +6 [1].
2.5 Химические свойства молибдена, его оксидов и гидроксидов
Литой и плотно спеченный молибден при комнатной и слегка повышенной температуре стоек против действия воздуха и кислорода [1, 12]. При нагревании до темно-красного каления поверхность металла быстро тускнеет и около 600°С молибден загорается, выделяя белый дым – возгон МоО3. Налет окисла легко разрушается и при длительном нагревании происходит полное сгорание металла до МоО3. Молибденовый порошок окисляется при еще более низкой температуре, а наиболее мелкий порошок способен самовозгораться на воздухе. При нагревании во влажной атмосфере, в среде восстановительного или инертного газа, не очищенных тщательно от кислорода и паров воды, наблюдается постепенное более или менее полное окисление металла по реакции:

При нагревании молибдена в токе SO2 образуется смесь окислов и дисульфида молибдена, в токе НС1 – летучие хлориды (МоСІ3) и оксихлориды молибдена.
В растворах, содержащих окислитель (кислород, HNO3, НС1О3 и др.), молибден окисляется. Растворы при недостатке окислителя окрашиваются в синий цвет. Азотная кислота, одна и в смеси с соляной и серной – окисляет и растворяет металл:

При избытке кислоты из бесцветного раствора выпадает белый или слегка желтоватый осадок молибденовой кислоты Н2МоО4. Концентрированная HNO3 задерживает растворение, создавая пассивирующую пленку окислов [22]. Разбавленная НС1 довольно хорошо растворяет компактный металл: за 18 ч потеря массы 20-30%. В концентрированной НС1 растворение более медленное: за 18 ч при 110°С потеря массы 0,34%:

Фтористый водород и плавиковая кислота быстро действуют на молибден, переводя его во фториды. Разбавленная H2SO4 (d=l,3 г/мл) слабо действует на молибден даже при 110°. Концентрированная H2SO4 (d= 1,82 г/мл) на холоду действует слабо: за 18 ч потеря массы 0,24%. При 200 – 250°С растворение идет быстрее. Фосфорная и органические кислоты воздействуют на металл слабо, но в присутствии окислителей (в том числе воздуха) растворимость заметно увеличивается.
Растворы щелочей и аммиака действуют на молибден медленно, но их действие усиливается окислителями с повышением температуры. При растворении молибдена в щелочах получаем молибдаты щелочных метал лов, реакция будет ускоряться при использовании расплавов щелочей:

Молибден стоек к действию влаги без аэрации, при аэрации молибден будет окисляться при условии, что он находится в контакте с другим менее активным металлом и есть гальванический элемент. В таком гальваническом элементе будет окисляться более активный металл.
Рассмотрим реакции взаимодействия молибдена с неметаллами. Молибден довольно активно реагирует с неметаллами (кремнием, бором, галогенами, серой и т. п.), учитывая то что молибден имеет несколько степеней окисления то получается в таких реакциях несколько продуктов.
2.5.1 С водородом
Молибден не реагирует с водородом с получением химических соединений. Имеет место только физическое растворение водорода в молибдене с образованием нестойких связей. Растворимость водорода в молибдене растет с повышением температуры до 0,5 см3 в 100 граммах металла [20].
2.5.2 С галогенами
С молибденом фтор образует летучие фториды. Хлор и бром ре6агируют с ним при температуре красного каления. Йод реагирует с молибденом очень медленно. В присутствии влаги реакция с галогенами ускоряется и она становится возможной даже на холоду.
Молибден образует гексафторид MoF6, пентафторид MoF5, тетрафторид MOF4 и трифторид MоF3; гексахлорид МоС16, пентахлорид МоС15, тетрахлорид МоС13, трихлорид МоС13 и комплексный псевдодихлорид [Мо6(С1)8]С14; тетрабромид МоВг4, трибромид МоВг3 и комплексный псевдодибромид [Мо6Вг8]Вг4 [20, 23]. С иодом достоверно известно лишь два соединения – дииодид МоІ2 и трииодид МоІ3. Помимо этих соединений, известен ряд оксигалогенидов и несколько менее достоверных соединений.
Гексафторид молибдена получается действием сухого фтора в смеси с азотом на металл (в платиновой трубке), трифторида брома на металл при 250°, безводного HF на MoCl 5:
2МоС15 + 12HF = 2MoF6 + 10НС1 + Н2

Гексафторид конденсируется при -70°С в виде белых кристаллов и отгоняется под вакуумом при 40°. Плавится при 17,5°С и кипит при 35°С. Молекула имеет октаэдрическую структуру с атомом металла в центре октаэдра и атомами фтора в вершинах его. Устойчив в сухом воздухе, хлоре, двуокиси серы. Гидролизуется:
MoF6 + 4Н2О = Н2МоО4 + 6HF
Образует с фторидами щелочных металлов комплексные соли типа Me2(MоF8).
Трифторид молибдена получается нагреванием МоВг3 в токе безводного HF. При нормальных условиях твердый. При нагревании во влажном воздухе диссоциирует:
4MoF3 + 6Н2О + 3O2 = 4МоО3 + 12HF
В сухом воздухе устойчив до 800°. При действии водорода восстанавливается до металла. Водой на холоду медленно разлагается.
У молибдена (VI) выделены два оксифторида - MoOF4 и MоO2F2. Это твердые, белые, тяжелые кристаллические вещества, получающиеся фторированием молибдена в присутствии кислорода или обменными реакциями МоО3 с фторидами.

MoCl6 термически очень неустойчив и чувствителен к малейшим следам влаги. Получен недавно длительным кипячением тионилхлорида с МоО3. МоС15 получается хлорированием молибдена в отсутствие воды и воздуха при 600 – 750°С. Кристаллизуется в виде темно-зеленых тригональных бипирамид. Температура плавления 194°С, температура кипения 238°С. Плотность МоС15 2,9275. Он растворяется в безводном эфире,спиртах, углеводородах, кетонах, альдегидах, сероуглероде, аминах с образованием комплексов. При нагревании в отсутствии кислорода разлагается:
МоС15 = МоС13 + С12
Водород при 900°С восстанавливает его до металла:
2МоС15 + 5Н2 → 10НС1 + 2Мо
Восстанавливать можно над накаленной металлической нитью в токе его пара в смеси с водородом. В этом случае на нити осаждается плотный слой молибдена, но при 250° образуется трихлорид:
МоС15 + Н2 → МоСІ3 + 2НС1
При нагревании МоС15 в сухом воздухе образуется оксихлорид МоО2С12. При нагревании во влажном воздухе МоС15 полностью разлагается, образуя окси - и гидроксихлориды. В воде полностью гидролизируется с большим выделением тепла.
Тетрахлорид молибдена получается хлорированием МоО3 смесью СІ2 и ССІ4. При нагревании без доступа влаги и кислорода МоСІ4 диспропорционирует на MoCl 5 и MoCl3. При нагревании в присутствии влаги и кислорода образуются оксихлориды и гидроксихлориды. С рядом веществ, в том числе органических, тетрахлорид образует продукты присоединения.
Трихлорид МоС13 получается в виде твердого красного вещества частичным восстановлением MoCl5 водородом при 250°, а также пропусканием смеси паров МоС15 с инертным газом над молибденом.

Трихлорид разлагается, не плавясь. Сублимирует в токе инертного газа. Устойчив в сухом воздухе при нормальной температуре, а при нагревании переходит в оксихлориды. При нагревании в инертном газе разлагается на МоСІ4 и комплексные нелетучие хлориды. Водой и водными растворами щелочей разлагается соответственно при нагревании и на холоду. С аммиаком образует комплексы. Окислителями окисляется до Н2МоО4. В соляной кислоте не растворяется. Растворяется в солянокислых растворах МоО3, образуя комплексы.
Все бромиды получаются действием Вг2 на Мо в среде СО. Так, черно-зеленые иглы тетрабромида получаются около 600°С при атмосферном давлении, тетрабромид – преимущественно при 350 – 500°С. При более низком давлении или несколько более высокой температуре получается смесь бромидов, в том числе комплексных. Известны также красно-оранжевые кристаллы диоксибромида МоО2Вг2 и желтые игольчатые кристаллы бромомолибденовой кислоты H3(MoO3Br3).

Достоверно известен лишь диодид молибдена Mol2 [23]. Получается он взаимодействием паров йода с металлом выше 1000°С:

Другие йодиды молибдена неизвестны.
2.5.3 С серой
Сера не реагирует с молибденом до температуры 400 – 450°С, при более высокой температуре образуется дисульфид молибдена MoS2:

Сероводород реагирует с молибденом при высокой температуре, образуя MoS2. В парах хлоридов серы образуются сульфохлориды молибдена.
Непрямыми методами были получены сульфиды молибдена MoS3, Mo2S5, Mo2S3. Первые два диссоциируют при температурах выше 400°С.
Помимо этих простых сульфидов известны также и полисульфид Mo(S2)2, тиомолибдаты Ме2MoS4. Высший сульфид MoS3 образуется при пропускании сероводорода через растворы молибдатов щелочных металлов:

Дисульфид молибдена  – важнейший минерал молибдена. Он образуется в земной коре в высотемпературных условиях. Имеет сложную слоистую гексагональную кристаллическую решетку. Пары воды окисляют
– важнейший минерал молибдена. Он образуется в земной коре в высотемпературных условиях. Имеет сложную слоистую гексагональную кристаллическую решетку. Пары воды окисляют  при красном калении. Кислоты-окислители разлагают
при красном калении. Кислоты-окислители разлагают  , переводя его в
, переводя его в  , неокисляющие кислоты не действуют на него. Сульфиды щелочных металлов и щелочи разлагают
, неокисляющие кислоты не действуют на него. Сульфиды щелочных металлов и щелочи разлагают  при сплавлении.
при сплавлении.
2.5.4 С азотом
С азотом молибден не реагирует, азот незначительно растворяется в молибдене. Нитриды молибдена добыты другим путем.
При температуре 400 – 745°С порошок молибдена реагирует с аммиаком с получением нитридов молибдена: МоN, Mo2N, β-фаза, содержащая 28% азота. Во всех трех фазах были установлены определенные кристаллические структуры. В вакууме при нагревании они легко разлагаются.
Нитриды, как и карбид Мо2С и бориды, являются соединениями, в которых валентные соотношения не сохранены. Мо3N и Mo2N относятся к так называемым фазам внедрения, в которых атом неметалла внедряется между атомами металла, при этом сохраняется кристаллическая структура последнего. МоN имеет более сложную структуру [8] и не может быть отнесен к фазам внедрения.
2.5.5 С углеродом
Молибден с углеродом образует два карбида: Мо2С и МоС [21, 23]. Это очень твердые, тяжелые, тугоплавкие металлоподобные соединения. Они близки по свойствам к фазам внедрения, имеющим металлический характер (проводимость, внешний вид и т. п.), обусловливаемый особенностями их атомно-кристаллической структуры. Мо2С образуется при 2400°С. Это темно-серый порошок, получаемый обычно науглероживанием в твердой фазе смеси молибденового порошка и сажи при 1400- 1500°С. Может быть также получен науглероживанием накаленной молибденовой проволоки из газовой фазы или взаимодействием МоО3 с СО и углеводородами. МоС плавится при 2650°С. Карбиды молибдена, благодаря своей твердости и тугоплавкости, играют важную роль в инструментальной и других отраслях современной техники.
Молибден образует с окисью углерода под высоким давлением гексакарбонил Мо (СО)6. Он диссоциирует при 150°С. Это ромбоэдрические белые кристаллы, возгоняющиеся при пониженном давлении и комнатной температуре, растворимые в эфире и бензоле. С органическими основаниями образует комплексы. При разложении Мо(СО)6 в зависимости от условий образуется металлическое зеркало или порошок из мелких гранул молибдена.
2.5.6 С кислородом
Литой и плотно спеченный слиток молибдена при нормальной и несколько повышенной температуре стоек к действию кислорода и воздуха [20]. При нагревании до темно-красного каления поверхность металла быстро тускнеет и при 600°С молибден загорается выделяя дым – возгон МоО3. Налет окисла легко разрушается и при длительном нагревании происходит полное сгорание металла до МоО3.

Молибденовый порошок окисляется при более низкой температуре, а мелкодисперсный порошок молибдена может самовозгораться на воздухе или в токе кислорода.
Рассмотрим ряд оксидов молибдена. Для молибдена были идентифицированы оксиды с химической формулой МоО3, и МоО2. Ковалентность молибдена в оксидах равна 3 и 2. Кроме того, получены оксиды промежуточного между МоО3 и МоО2 состава: Мо8О23, Мо9О26, Мо4О11, Мо17О47. характер связи в оксидах в основном ионный, частично ковалентный.
МоО и Мо2О3 не выделены в свободном состоянии, хотя ранее в литературе и упоминалось о их выделении [20, 23]. Рентгенографически идентифицирована фаза, содержащая кислород в количестве, соответствующему составу Мо3О. оксид МоО2 более тугоплавок и термодинамически устойчив чем оксид МоО3.
Поскольку молибден относится к металлам, то его оксиды должны проявлять основные свойства. Но оксиды МоО3, и МоО2 проявляют не основные свойства, а кислотные. Они дают ряд соединений общей формулой Н2МоО4 и Н2МоО3. основные свойства проявляет оксид Мо2О3.
МоО3 характерен гидрат состава Н2МоО4 и Н2МоО4 ×Н2О. Н2МоО4 - белые мелкие кристаллы гексагональной формы. Дигидрат Н2МоО4 × Н2О образуется при стоянии подкисленного раствора молибдатов в течении нескольких недель, а также при внесении затравки Н2МоО4 × Н2О в сильно подкисленный раствор парамолибдата аммония. Н2МоО4 - молибденовая кислота, кислота средней силы, например, она более сильная чем угольная кислота и вытесняет ее из ее солей:

Гидраты окислов с валентностью металла между VI и IV получены в виде соединений МоО(ОН)3 и Мо(ОН)5. сила этих электролитов очень слабая, они малорастворимы в воде.
МоО2 характерен гидрат состава Н2МоО3, который в свободном состоянии не выделен, выделен только в растворах, также получены его соединения состава Ме2МоО3. слабый электролит.
Также при действии аммиака на растворы молибдатов получен Мо(ОН)3 - аморфный порошок черного цвета, не растворим в воде и растворах щелочей, легко раств