Варианты заданий контрольной работы
В контрольной работе необходимо решить задачи и ответить на вопросы согласно варианту по таблице 1. Номер варианта выбирается по сумме двух последних цифр зачетной книжки. Вариант № 19 выдается по индивидуальному заданию преподавателя.
Таблица 1 - Таблица вариантов
| Номер варианта | Номера задач | Номера вопросов | |||
| 1 тип | 2 тип | 3 тип | 4 тип | ||
| 6, 10 | |||||
| 8, 12 | |||||
| 10, 14 | |||||
| 12, 16 | |||||
| 1, 18 | |||||
| 3, 17 | |||||
| 2, 5 | |||||
| 4, 10 | |||||
| 6, 12 | |||||
| 1, 8 | |||||
| 3, 10 | |||||
| 2, 12 | |||||
| 1, 4 | |||||
| 3, 7 | |||||
| 5, 9 | |||||
| 7, 11 | |||||
| 9, 6 | |||||
| 11, 8 | |||||
| 6, 13 | |||||
| 8, 15 |
Задача №1.
Обратимый адиабатный процесс для смеси идеальных газов
1. Смесь идеальных газов состоит из 8 кг  , 10 кг
, 10 кг 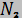 и 2кг
и 2кг  . В начальном состоянии объем смеси
. В начальном состоянии объем смеси  м3, а температура
м3, а температура  °С. В результате адиабатного сжатия давление смеси возрастает до значения
°С. В результате адиабатного сжатия давление смеси возрастает до значения  МПа. Определить давление смеси в начальном состоянии, объем и температуру смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в
МПа. Определить давление смеси в начальном состоянии, объем и температуру смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в 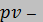 и
и  диаграммах.
диаграммах.
2. Смесь идеальных газов задана объемными долями:, 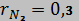 ,
,  . Общая масса смеси
. Общая масса смеси  кг. В начальном состоянии объем смеси
кг. В начальном состоянии объем смеси  м3 и температура
м3 и температура  °С. В результате адиабатного сжатия давление смеси увеличивается до
°С. В результате адиабатного сжатия давление смеси увеличивается до  МПа. Определить давление смеси в начальном состоянии, температуру и объем смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в
МПа. Определить давление смеси в начальном состоянии, температуру и объем смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в 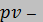 и
и  диаграммах.
диаграммах.
3. Смесь идеальных газов состоит из 30 кг  , 24 кг
, 24 кг 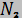 и 6 кг
и 6 кг  . В начальном состоянии объем смеси
. В начальном состоянии объем смеси  м3 и температура
м3 и температура  °С. В результате адиабатного расширения температура газа уменьшается до
°С. В результате адиабатного расширения температура газа уменьшается до  °С. Определить давление смеси в начальном состоянии, объем и давление в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в
°С. Определить давление смеси в начальном состоянии, объем и давление в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в  и
и  диаграммах.
диаграммах.
4. Смесь идеальных газов задана объемными долями:, 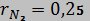 ;
;  . Общая масса смеси
. Общая масса смеси  кг. Параметры смеси в начальном состоянии:
кг. Параметры смеси в начальном состоянии:  МПа,
МПа,  °С. В результате адиабатного сжатия объем смеси уменьшается до значения
°С. В результате адиабатного сжатия объем смеси уменьшается до значения  м3. Определить объем смеси в начальном состоянии, давление и температуру смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в
м3. Определить объем смеси в начальном состоянии, давление и температуру смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в  и
и  диаграммах.
диаграммах.
5. Смесь идеальных газов состоит из 15 кг  , 12 кг
, 12 кг 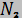 и 3 кг
и 3 кг  . Объем смеси в начальном состоянии
. Объем смеси в начальном состоянии  м3, а давление
м3, а давление  МПа. В результате адиабатного сжатия температура смеси возрастает до
МПа. В результате адиабатного сжатия температура смеси возрастает до  °С. Определить температуру смеси в начальном состоянии, объем и давление смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в
°С. Определить температуру смеси в начальном состоянии, объем и давление смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в 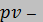 и
и  диаграммах.
диаграммах.
6. Смесь идеальных газов состоит из 32 кг СO2, 40 кг 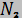 и 8 кг
и 8 кг  . В начальном состоянии параметры смеси
. В начальном состоянии параметры смеси  МПа и
МПа и  °С. В результате адиабатного расширения давление смеси уменьшается до
°С. В результате адиабатного расширения давление смеси уменьшается до  МПа. Определить объем смеси в начальном и конечном состояниях, температуру и плотность смеси в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в
МПа. Определить объем смеси в начальном и конечном состояниях, температуру и плотность смеси в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в 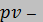 и
и  диаграммах.
диаграммах.
7. Смесь идеальных газов задана объемными долями:  ,
, 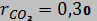 и
и 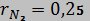 . Общая масса смеси
. Общая масса смеси  кг. Объем смеси в начальном состоянии
кг. Объем смеси в начальном состоянии  м3, а давление
м3, а давление 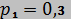 МПа. В результате адиабатного расширения объем смеси увеличился до значения
МПа. В результате адиабатного расширения объем смеси увеличился до значения  м3. Определить температуру смеси в начальном состоянии, давление я температуру смеси в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Принять, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в
м3. Определить температуру смеси в начальном состоянии, давление я температуру смеси в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Принять, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в 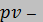 и
и  диаграммах.
диаграммах.
8. Смесь идеальных газов задана объемными долями:  ,
,  и
и  . Общая масса смеси
. Общая масса смеси  кг. Объем смеси в начальном состоянии
кг. Объем смеси в начальном состоянии  м3, температура
м3, температура  °С. В результате адиабатного расширения смеси ее давление уменьшается до значения
°С. В результате адиабатного расширения смеси ее давление уменьшается до значения  МПа. Определить давление смеси в начальном состоянии, температуру и объем смеси в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения.
МПа. Определить давление смеси в начальном состоянии, температуру и объем смеси в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения.
Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в 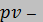 и
и  диаграммах.
диаграммах.
9. Смесь идеальных газов состоит из 20 кг 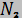 16 кг
16 кг  и 4 кг
и 4 кг  . Параметры смеси в начальном состоянии
. Параметры смеси в начальном состоянии  МПа и
МПа и  °С. В результате адиабатного сжатия давление смеси возрастает до значения
°С. В результате адиабатного сжатия давление смеси возрастает до значения  МПа. Определить объем смеси в начальном и конечном состояниях, температуру и плотность смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в
МПа. Определить объем смеси в начальном и конечном состояниях, температуру и плотность смеси в конечном состоянии, работу сжатия и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в 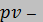 и
и  диаграммах.
диаграммах.
10. Смесь идеальных газов задана объемными долями:,  и
и 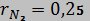 . Общая масса смеси
. Общая масса смеси  кг. В начальном состоянии параметры смеси
кг. В начальном состоянии параметры смеси 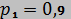 МПа и
МПа и  °С. В результате адиабатного расширения объем смеси увеличивается до значения
°С. В результате адиабатного расширения объем смеси увеличивается до значения  м3. Определить объем смеси в начальном состоянии, температуру и давление смеси в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в
м3. Определить объем смеси в начальном состоянии, температуру и давление смеси в конечном состоянии, работу расширения и изменение внутренней энергии смеси. Считать, что теплоемкость газов не зависит от температуры и определяется по табл. 1 приложения. Определить парциальные давления газов, входящих в смесь, в конечном состоянии. Изобразить процесс в 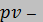 и
и  диаграммах.
диаграммах.
Порядок решения задачи
Все задачи условно можно разделить на 2 типа:
- смесь газов задана массами газов составляющих смеси  ;
;
- смесь газов задана объемными долями составляющих смеси  .
.
В дальнейшем все зависимости, предназначенные только для одного типа задач, будут отмечены соответствующими комментариями.
Молярные массы газов, составляющих смесь:
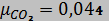 кг/моль,
кг/моль,  кг/моль,
кг/моль,  кг/моль
кг/моль
Определить массу смеси (если смесь задана массами газов)

Определить массовые доли компонентов (если смесь задана массами газов)

Определить молярную массу смеси (если смесь задана массами газов)
Определить молярную массу смеси (если смесь задана объемными долями газов)
Определить недостающий параметр начального состояния - объем (температуру, давление) в начальном состоянии из уравнения состояния (уравнение Клапейрона-Менделеева)
откуда
где  – температура в градусах Кельвина,
– температура в градусах Кельвина, 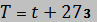 .
.
Удельная теплоемкость при постоянном давлении для смеси (если смесь задана массами газов)

где  ,
,  - мольные теплоемкости газов (таблица 1 приложений).
- мольные теплоемкости газов (таблица 1 приложений).
Удельная теплоемкость при постоянном объеме для смеси (если смесь задана массами газов)

где  ,
,  - мольные теплоемкости газов (таблица 1 приложений).
- мольные теплоемкости газов (таблица 1 приложений).
Удельная теплоемкость при постоянном давлении для смеси (если смесь задана объемными долями газов)
где  ,
,  - мольные теплоемкости газов (таблица 1 приложений).
- мольные теплоемкости газов (таблица 1 приложений).
Удельная теплоемкость при постоянном объеме для смеси (если смесь задана объемными долями газов)
где  ,
,  - мольные теплоемкости газов (таблица 1 приложений).
- мольные теплоемкости газов (таблица 1 приложений).
Показатель адиабаты смеси

Определить  для адиабатного процесса из выражения (если это необходимо)
для адиабатного процесса из выражения (если это необходимо)


Плотность смеси в конечном состоянии

Определить  для адиабатного процесса из выражений (если это необходимо)
для адиабатного процесса из выражений (если это необходимо)

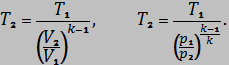
Определить  для адиабатного процесса из выражений (если это необходимо)
для адиабатного процесса из выражений (если это необходимо)


Определить парциальные давления газов в конечном состоянии (если смесь задана массами газов)
Определить парциальные давления газов в конечном состоянии (если смесь задана объемными долями газов)


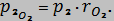
Уравнение первого закона термодинамики
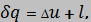

Изменение внутренней энергии
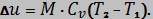
Работа сжатия (расширения)
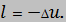
Задача №2.
Сочетание двух простейших термодинамических процессов идеального газа
11. Воздух из начального состояния 1 ( МПа и
МПа и 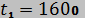 °С) изохорно охлаждается до температуры
°С) изохорно охлаждается до температуры  °С, а затем изотермически сжимается до состояния 3, в котором
°С, а затем изотермически сжимается до состояния 3, в котором  . Показать процесс 1-2-3 в
. Показать процесс 1-2-3 в 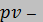 и
и  диаграммах. Определить значения
диаграммах. Определить значения  ,
, 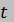 и
и  воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
12. Кислород из начального состояния 1 изотермически сжимается до состояния 2, а затем в изохорном процессе охлаждается до состояния 3, в котором  . В точке 2 параметры кислорода
. В точке 2 параметры кислорода 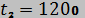 °С и
°С и  МПа, в точке 3 температура
МПа, в точке 3 температура  °С. Показать процесс 1-2-3 в
°С. Показать процесс 1-2-3 в 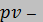 и
и  диаграммах. Определить значения
диаграммах. Определить значения  ,
, 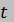 и
и  воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
13. Воздух из начального состояния 1 изотермически сжимается до состояния 2, а затем в изобарном процессе расширяется до состояния 3, в котором  . Параметры воздуха в точке 2
. Параметры воздуха в точке 2  МПа и
МПа и  °С. Температура воздуха в точке 3
°С. Температура воздуха в точке 3 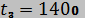 °С. Показать процесс 1-2-3 в
°С. Показать процесс 1-2-3 в 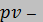 и
и  диаграммах. Определить значения
диаграммах. Определить значения  ,
, 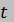 и
и  воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
14. Кислород из начального состояния 1 изотермически расширяется до состояния 2, в котором параметры кислорода  МПа и
МПа и  °С, а затем сжимается в изобарном процессе до объема
°С, а затем сжимается в изобарном процессе до объема  . Температура кислорода в состоянии 3
. Температура кислорода в состоянии 3  °С. Показать процесс 1-2-3 в
°С. Показать процесс 1-2-3 в 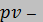 и
и  диаграммах. Определить значения
диаграммах. Определить значения  ,
, 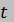 и
и  воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
15. Воздух из начального состояния 1 ( МПа и
МПа и  °С) в изобарном процессе нагревается до температуры
°С) в изобарном процессе нагревается до температуры  °С, а затем изотермически сжимается до состояния 3, в котором
°С, а затем изотермически сжимается до состояния 3, в котором  . Показать процесс 1-2-3 в
. Показать процесс 1-2-3 в 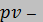 и
и  диаграммах. Определить значения
диаграммах. Определить значения  ,
, 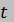 и
и  воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
16. Воздух из начального состояния 1 ( МПа,
МПа,  °С) в изохорном процессе нагревается до
°С) в изохорном процессе нагревается до  °С, а затем изотермически расширяется до состояния 3, в котором
°С, а затем изотермически расширяется до состояния 3, в котором  . Показать процесс 1-2-3 в
. Показать процесс 1-2-3 в 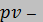 и
и  диаграммах. Определить значения
диаграммах. Определить значения  ,
, 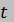 и
и  воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
17. Азот от состояния 1 ( МПа и
МПа и  °С) в изобарном процессе расширяется до состояния 2, в котором
°С) в изобарном процессе расширяется до состояния 2, в котором  °С, а затем изотермически переводится в состояние 3, в котором
°С, а затем изотермически переводится в состояние 3, в котором  . Показать процесс 1-2-3 в
. Показать процесс 1-2-3 в 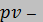 и
и  диаграммах. Определить значения
диаграммах. Определить значения  ,
, 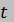 и
и  воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
18. Кислород из состояния 1 изотермически расширяется до состояния 2, в котором  МПа и
МПа и  °C, а затем в изохорном процессе нагрева переходит в состояние 3, в котором
°C, а затем в изохорном процессе нагрева переходит в состояние 3, в котором  и
и 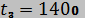 °С. Показать процесс 1-2-3 в
°С. Показать процесс 1-2-3 в 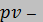 и
и  диаграммах. Определить значения
диаграммах. Определить значения  ,
, 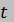 и
и  воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
19. Азот из состояния 1 ( МПа и
МПа и  °С) в изохорном процессе охлаждается до температуры
°С) в изохорном процессе охлаждается до температуры  °С, а затем изотермически сжимается до состояния 3, в котором
°С, а затем изотермически сжимается до состояния 3, в котором  . Показать процесс 1-2-3 в
. Показать процесс 1-2-3 в 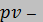 и
и  диаграммах. Определить значения
диаграммах. Определить значения  ,
, 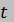 и
и  воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
20. Воздух из состояния 1 (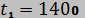 °C и
°C и  МПа) в изобарном процессе охлаждается до температуры
МПа) в изобарном процессе охлаждается до температуры  °С, а затем изотермически расширяется до состояния 3, в котором
°С, а затем изотермически расширяется до состояния 3, в котором  . Показать процесс 1-2-3 в
. Показать процесс 1-2-3 в 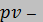 и
и  диаграммах. Определить значения
диаграммах. Определить значения  ,
, 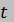 и
и  воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
воздуха в точках 1, 2 и 3. Вычислить удельные значения работы, теплоты, изменения внутренней энергии и энтропии воздуха в процессах 1-2, 2-3 и 1-2-3 в целом. Изохорный процесс рассчитать с учетом зависимости теплоемкости воздуха от температуры (см. табл. 2 и 3 приложения).
Порядок решения задачи
Определить объем (температуру, давление) в состоянии, в котором известно два их трех параметров состояния ( ) из уравнения состояния (уравнение Клапейрона-Менделеева)
) из уравнения состояния (уравнение Клапейрона-Менделеева)
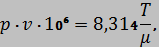
Откуда:
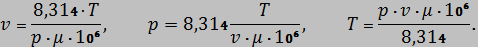
Значения  для каждого из трех состояний для удобства можно сводить в таблицу 2.
для каждого из трех состояний для удобства можно сводить в таблицу 2.
Таблица 2 – Параметры состояний газа
| Параметр | Состояние газа | ||

| |||
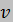
| |||

|
Для изохорного процесса соотношения между температурой и давлением в начальном и конечном состоянии

Уравнение первого закона термодинамики

Работа по расширению газа в изохорном процессе

Изменение внутренней энергии


Изменение энтропии

Для изотермического процесса соотношения между объемом и давлением в начальном и конечном состоянии

Работа по расширению газа в изотермическом процессе

Изменение внутренней энергии

Приращение теплоты

Изменение энтропии

Для изобарного процесса соотношения между температурой и объемом в начальном и конечном состоянии

откуда

Работа по расширению газа в изобарном процессе

Приращение теплоты

Изменение внутренней энергии воздуха
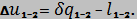
Изменение энтропии

Для процесса 1-2-3 в целом:
- работа

- изменение внутренней энергии

- приращение теплоты
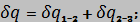
- изменение энтропии
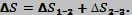
Задача №3.
Применение дифференциальных соотношений термодинамики
21. Определить приращение изохорной теплоемкости вещества при изотермическом изменении его удельного объема от  м3/кг до
м3/кг до  м3/кг (
м3/кг ( К), если свойства этого вещества при v = const задаются уравнением
К), если свойства этого вещества при v = const задаются уравнением  , где
, где  и
и  — постоянные величины (
— постоянные величины ( Па/К2). Дифференциальные соотношения приведены в таблице 4 приложения.
Па/К2). Дифференциальные соотношения приведены в таблице 4 приложения.
22. Вещество подчиняется уравнению состояния Ван-дер-Ваальса

где  и
и  — постоянные величины (
— постоянные величины ( = 191 Н·м4/кг2). Найти изменение внутренней энергии при изотермическом изменении удельного объема от
= 191 Н·м4/кг2). Найти изменение внутренней энергии при изотермическом изменении удельного объема от  = 0,1 м3/кг до
= 0,1 м3/кг до 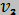 = 0,4 м3/кг. Дифференциальные соотношения приведены в таблице 4 приложения.
= 0,4 м3/кг. Дифференциальные соотношения приведены в таблице 4 приложения.
23. Определить приращение энтальпии вещества при изотермическом изменении давления от  МПа до
МПа до  МПа, если вещество подчиняется уравнению состояния
МПа, если вещество подчиняется уравнению состояния  , где
, где  м3/кг. Дифференциальные соотношения приведены в таблице 4 приложения.
м3/кг. Дифференциальные соотношения приведены в таблице 4 приложения.
24. Вещество подчиняется уравнению состояния  , где
, где  — постоянная величина. Найти значение энтропии этого вещества при
— постоянная величина. Найти значение энтропии этого вещества при  МПа и
МПа и  °С, приняв за начало отсчета значение энтропии в точке
°С, приняв за начало отсчета значение энтропии в точке  МПа и
МПа и  °С (молекулярная масса
°С (молекулярная масса 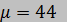 кг/кмоль). Дифференциальные соотношения приведены в таблице 4 приложения.
кг/кмоль). Дифференциальные соотношения приведены в таблице 4 приложения.
25. Определить приращение изобарной теплоемкости вещества при изотермическом изменении давления от  МПа до
МПа до 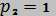 МПа (
МПа ( К), если свойства этого вещества при
К), если свойства этого вещества при  задаются уравнением
задаются уравнением  , где
, где  и
и  — постоянные величины (
— постоянные величины ( м3/кг). Дифференциальные соотношения приведены в таблице 4 приложения.
м3/кг). Дифференциальные соотношения приведены в таблице 4 приложения.
26. Используя соотношение для дифференциального дроссель - эффекта (см. таблицу 4 приложения), определить изменение температуры при дросселировании вещества, подчиняющегося уравнению состояния  , если
, если  м3/кг,
м3/кг,  кДж/(кг·К), а давление уменьшается от
кДж/(кг·К), а давление уменьшается от 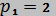 МПа до
МПа до 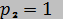 МПа.
МПа.
27. Вещество подчиняется уравнению состояния  , (
, ( м3/кг). Найти изменение энтропии в изотермическом процессе, если удельный объем уменьшается от
м3/кг). Найти изменение энтропии в изотермическом процессе, если удельный объем уменьшается от  м3/кг до
м3/кг до  м3/кг, а молекулярная масса
м3/кг, а молекулярная масса  кг/кмоль. Дифференциальные соотношения приведены в таблице 4 приложения.
кг/кмоль. Дифференциальные соотношения приведены в таблице 4 приложения.
28. Вещество подчиняется уравнению состояния  , где
, где 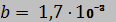 м3/кг. Найти количество теплоты, которое подводится к 1 кг этого вещества при изотермическом расширении (
м3/кг. Найти количество теплоты, которое подводится к 1 кг этого вещества при изотермическом расширении ( К) от
К) от  м3/кг до
м3/кг до  м3/кг (молекулярная масса
м3/кг (молекулярная масса  кг/кмоль). Дифференциальные соотношения приведены в таблице 4 приложения
кг/кмоль). Дифференциальные соотношения приведены в таблице 4 приложения
29. Определить изобарную теплоемкость вещества, подчиняющегося уравнению состояния  (
( — постоянная величина), если изохорная теплоемкость при той же температуре
— постоянная величина), если изохорная теплоемкость при той же температуре 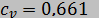 кДж/(кг·К), а молекулярная масса
кДж/(кг·К), а молекулярная масса  кг/кмоль. Дифференциальные соотношения приведены в таблице 4 приложения
кг/кмоль. Дифференциальные соотношения приведены в таблице 4 приложения
30. Определить приращение энтальпии вещества при изохорном изменении температуры от  К до
К до  К (
К ( м3/кг), если вещество подчиняется уравнению состояния
м3/кг), если вещество подчиняется уравнению состояния  , где
, где  м3/кг. Дифференциальные соотношения приведены в таблице 4 приложения
м3/кг. Дифференциальные соотношения приведены в таблице 4 приложения
Пример решения задачи
Определить приращение энтальпии вещества при изохорном изменении температуры от  К до
К до  К (
К ( м3/кг), если вещество подчиняется уравнению состояния
м3/кг), если вещество подчиняется уравнению состояния  , где
, где  м3/кг.
м3/кг.
Дано:




 м3/кг м3/кг
|
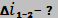
|
Дифференциальное соотношение изменения энтальпии при постоянном объеме:

| (1) |
Выразим из уравнения состояния давление:

| (2) |
Тогда:

| (3) |

| (4) |
Подставив выражения (3) и (4) в (1) получим:
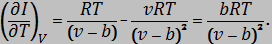
| (5) |
Определим изменение энтальпии интегрированием выражения (5):
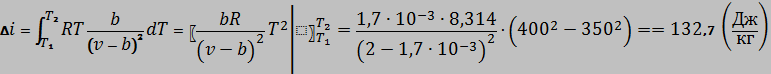
Задача №4.
Процессы истечения идеальных газов в сужающихся соплах и соплах Лаваля
31. К соплу парциальной газовой турбины подводятся продукты сгорания топлива с начальными параметрами  МПа и
МПа и 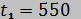 °С. В сопле давление понижается до
°С. В сопле давление понижается до  МПа. Считая продукты сгорания идеальным газом с
МПа. Считая продукты сгорания идеальным газом с  Дж/(кг·К) и
Дж/(кг·К) и  =1,33, определить: 1) какой тип сопла применен в турбине; 2) параметры и скорость газа в выходном сечении сопла; 3) расход газа, если минимальный диаметр сопла
=1,33, определить: 1) какой тип сопла применен в турбине; 2) параметры и скорость газа в выходном сечении сопла; 3) расход газа, если минимальный диаметр сопла  = 10 мм. Потерями на трение пренебречь.
= 10 мм. Потерями на трение пренебречь.
32. Воздух с начальными параметрами 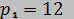 МПа и
МПа и  °С вытекает через сопло во внешнюю среду, давление в которой постоянно и равно 0,1 МПа. Считая воздух идеальным газом с
°С вытекает через сопло во внешнюю среду, давление в которой постоянно и равно 0,1 МПа. Считая воздух идеальным газом с