Введение: очень лёгкая тема, пожалуй, самая лёгкая за весь курс. Не будем грузить мозг определениями «осмос», «осмолярность» и тому подобным. Для успешного прохождения теста они почти не нужны. Основа темы — две формулы.
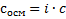
Где сосм — осмолярность, с — концентрация в моль/л, i — изотонический коэффициент Вант-Гоффа. Вся суть в нём. В книжке написана формула, как его считать, но можно проще, i = количество ионов, образующихся при диссоциации данного вещества. Например:
NaCl, i=2, 1 натрий + 1 хлор = 2 иона
KNO3, i=2, 1 калий + 1 нитрат = 2 иона
Li2SO4, i=3, 2 лития + 1 сульфат = 3 иона
CaCl2, i=3, 1 кальций + 2 хлора = 3 иона
Na3PO4, i=4, 3 натрия + 1 фосфат = 4 иона
CH3COOH, HNO2, i=1,2. У слабых электролитов (два приведенных, азотиста кислота, уксусная кислота, основные встречающиеся) дробное i, можно считать грубо, что 1,2
C6H12O6, i=1. У неэлектролитов, всяких глюкоз, манноз, рибоз, сахароз, вот этой всей хероты вида СхНуОй, мочевины (СО(NH2)2) = 1, они не распадаются на ионы.
!!! Обязательно убедитесь, что определение коэффициента iпонятно. От этого зависит вся тема.
Если в растворе несколько веществ, то осмолярность считаем как сумму:
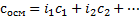
И осмотическое давление вычисляется так:
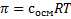
Где 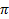 — осмотическое давление, сосм — осмолярность (только что считали). R = 8,31, константа, T — температура в градусах Кельвина. 25 Цельсия = 298 Кельвина, 37 Цельсия = 310 Кельвина. Уельвин = Цельсий + 273.
— осмотическое давление, сосм — осмолярность (только что считали). R = 8,31, константа, T — температура в градусах Кельвина. 25 Цельсия = 298 Кельвина, 37 Цельсия = 310 Кельвина. Уельвин = Цельсий + 273.
Осмолярность можно сравнивать. Если у одного раствора осмолярность меньше, он называется гипотоническим. Тогда у второго раствора осмолярность больше, он называется гипертоническим. Растворы с одинаковой осмолярностью называются изотоническими.
Типичныевопросы:
1. Ряд осмолярностей/осмотических давлений.
Пример:

Тоже ничего особенного…
Как с этим бороться:
Да все тем же коэфициентомi. Для каждого вещества ряда просчитываем i*c, получится: Na2SO4 (0,1*3=0.30) – KCl (0,1*2=0.20) – C12H22O11 (0,1*1=0.10), получается, что осмолярности в ряду 0,30-0,20-0,10 убывает. Поскольку, как обычно, температура постоянна, R=8,31 просто константа, то на расчет давления можно забить и сравнивать осмолярности. Предупреждаем: изменяется немонотонно, это когда, например 0,3-0,1-0,2.
2. Ряд осмолярностей, соотнесение.
Пример:

Опять i…
Как с этим бороться:
Для решения такого вопроса (Вы не поверите) снова применяется изотонический коэффициент. Определяем коэффициенты i для всех веществ вопроса. Получается KI (i=2), CaCl2 (i=3), CH3COOH (i=1.2), C6H12O6 (i=1). Огромная просьба не путать азотную HNO3 – сильная, и азотистую HNO2 – слабая, кислоты. Меньшему i соотносят меньшую цифру, большему — большую. Стоит заметить, что вещества всегда подобраны так, чтобы были i=1; 1,2; 2 и 3. Если у вас у двух веществ получились одинаковые i, либо вы делаете хуиту, либо, что маловероятно, но все-таки возможно, в вопросе есть две одинаковых цифры — опечатка.
3. Задача про изотоничность.
Пример:
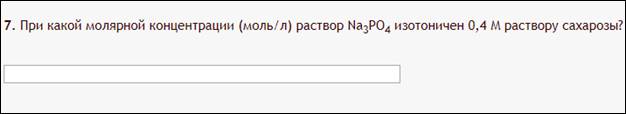
Первая лёгкая задача…
Как с этим бороться:
Вы таки не поверите, но опять нужны коэффициенты i. Не загружая голову длинным выводом нужной формулы, приводим почти готовую:
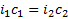
i *cдвух растворов приравняли, потому что растворы изотоничны, значит их осмолярности равны. Вставим цифры:

Выражаем с, как в первой теме, с=0,4/4=0,1. Изи же.
4. Задача рассчитать осмолярность.
Пример:
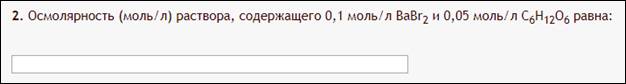
Вторая задача, наконец-то что-то более серьезное…
Как с этим бороться:
А берете формулу из введения, ту самую 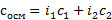 , ебаните в неё цифры, и бинго — ответ. Коэффициенты i тоже нужно определить. У CaBr2 (i=3), C6H12O6 (i=1). Получается
, ебаните в неё цифры, и бинго — ответ. Коэффициенты i тоже нужно определить. У CaBr2 (i=3), C6H12O6 (i=1). Получается 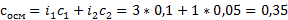 . Если концентрации не будут даны, то они считаются отдельно, как
. Если концентрации не будут даны, то они считаются отдельно, как 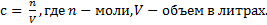
5. Задача расчитать осмотическое давление.
Пример:

Третья задача, самая сложная.
Как с этим бороться:
Аналогично прошлой, только длиннее. Сначала посчитать концентрации.
как 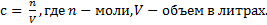 Делается это два раза, потому что веществ – два. Для KOH концентрация будет 0,01/0,1 = 0,1, а для глюкозы концентрация = 0,015/0,1=0,15 моль/л. Потом считаем осмолярность как в прошлой задаче. Осмолярность
Делается это два раза, потому что веществ – два. Для KOH концентрация будет 0,01/0,1 = 0,1, а для глюкозы концентрация = 0,015/0,1=0,15 моль/л. Потом считаем осмолярность как в прошлой задаче. Осмолярность
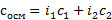 .
.
Две формулы можно свести в одну, вот так
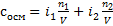 .
.
Тут n — моли первого и второго вещества, V объем раствора (проверьте, чтобы были литры, 100 мл = 0,1 литр), i- коэффициенты веществ, определять как раньше. В примере 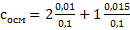 . Считать не будем, слишком легко. Затем вычисляется осмотическое давление по формуле
. Считать не будем, слишком легко. Затем вычисляется осмотическое давление по формуле 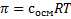 . Осмолярность уже нашли, R=8,31, а вот с температурой есть забавный баг. Температура нужна в градусах Кельвина, а не Цельсия, как дана. Если дана 25С, то = 298 градусов Кельвина, если 37С, то = 310 Кельвина. Перевод делается прибавлением +273 к градусам Цельсия, если кому интересно. В формулу Цельсия не ставить, ошибка получится!!! Только Кельвин. Расчеты не приводим ввиду очевидности. Не забудьте округлить до целых.
. Осмолярность уже нашли, R=8,31, а вот с температурой есть забавный баг. Температура нужна в градусах Кельвина, а не Цельсия, как дана. Если дана 25С, то = 298 градусов Кельвина, если 37С, то = 310 Кельвина. Перевод делается прибавлением +273 к градусам Цельсия, если кому интересно. В формулу Цельсия не ставить, ошибка получится!!! Только Кельвин. Расчеты не приводим ввиду очевидности. Не забудьте округлить до целых.
6. Соотнесите изотонические растворы.
Пример:

На что хватило фантазии в 2021 году
Как с этим бороться:
Новый тип вопросов, возникший в 2021 году. Видна серьёзная работа. Просчитываем осмолярности всех восьми растворов, затем находим попарно одинаковые. Например, Ca(NO3)2имеет осмолярность = 0,12*3=0,36. HClимеет осмолярность = 0,15*2=0,3. И так далее. Раствор KBr имеет осмолярность 0,18*2 = 0,36 и это совпадает с 0,12 моль Ca(NO3)2 – нашли пару изотоничных.
7. Истинность суждений.
Пример:
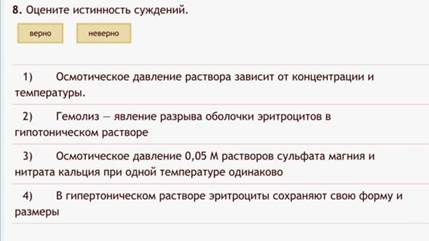
Ну за что, второе верно-неверно в тест. Блеать…
Как с этим бороться:
Просто никак. Смиритесь, теоретическая химия – это не ваше.
Для самых упорных сообщаем, что истинно:
· Грубодисперсные 10-4 – 10-5, микрогетерогенные 10-6 – 10-7, ультрамикрогетерогенные 10-8 – 10-9.
· Когда просят сравнивать осмотические давления, сравнить i*cдля этой пары веществ. Например, сульфат магния и нитрат кальция не изотоничны, потому что у них разные i.
· Осмотическое давление — коллигативное свойство — зависит от концентрации, степени диссоциации (у электролитов) и температуры. Не зависит от природы вещества.
· Виды дисперсных систем, золи, аэрозоли и прочее лучше посмотреть в методичке РНИМУ
· При осмосе через мембрану проходит только вода
· При любом виде распада (гидролиз белка на аминокислоты, полисахаридов до моносахаридов, измельчение частиц) осмотическое давление растёт. При укрупнении (раствор, в котором происходит полимеризация, слипание-агрегация частиц) осмотическое падает.
· И там еще невероятное количество хуиты, на которую в двух словах не ответишь.
Существует 2ой закон Марии П.: Два верных-Два неверных. Опытным путём установлено, что сейчас закон не работает.