Ароматические углеводороды являются циклическими соединениями, обладают свойствами непохожими на свойства ненасыщенных соединений.
Ароматические соединения – это органические соединения, которые в составе содержат бензольные кольца.
Изначально, ароматическими соединениями была группа веществ, которая обладала приятным запахом. Однако в настоящее время понятие «ароматичность» имеет другой смысл.
Гомологический ряд ароматических углеводородов имеет общую формулу CnH2n-6.
К наиболее важным ароматическим соединениям относятся бензол – С6Н6 и его гомологи, такие, как: толуол С6Н5СН3, ксилол С6Н4(СН3)2 и другие.
Структурную формулу бензола можно изобразить несколькими способами: в первом случае мы видим наличие трёх двойных связей, во втором – наличие бензольного кольца.
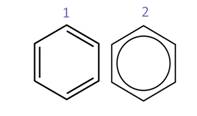
Первую структурную формулу предложил немецкий учёный Ф. Кекуле.
Ф. Кекуле – немецкий химик, он внёс большой вклад в развитие учения о валентности, теорию строения органических молекул.

В 1865 году он высказал предположение, что молекула бензола имеет форму правильного шестиугольника, образованного шестью атомами углерода, с которыми связаны шесть атомов водорода. В этом шестиугольнике чередуются простые и двойные связи.
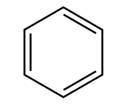
Запись структурной формулы, предложенной Кекуле, подтверждают и экспериментальные данные. Действительно, все атомы водорода и углерода в молекуле бензола лежат в одной плоскости, угол связи между атомами 1200, как у алкенов, для гидрирования бензола нужно 3 моль водорода, как для гидрирования трёх двойных связей.
Как видно из структурной формулы, двойные связи чередуются с одинарными. Такое расположение связей вызывает образование единого электронного облака, которое охватывает все шесть атомов углерода.
Экспериментально доказано, что в молекуле бензола нет двойных и одинарных связей, длины всех С – С-связей раны 0,140 нм. Каждый атом углерода в молекуле бензола находится в состоянии sp2-гибридизации, он связан с двумя соседними атомами углерода и одним атомом водорода σ-связями. Поэтому молекула бензола имеет вид плоского шестиугольника, где все атомы лежат в одной плоскости. Электронное облако четвёртого р-электрона, который не участвует в гибридизации, ориентировано перпендикулярно к плоскости бензольного кольца. Такие 6 р-электронов перекрываются над и под плоскостью кольца, образуя общее электронное облако и единую химическую связь для всех атомов углерода. Две области электронной плоскости расположены по обе стороны от σ-связей.
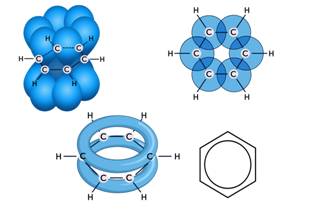
Поэтому формула бензола с окружностью символизирует равноценность связей между атомами углерода.
Рассмотрим номенклатуру аренов. Для названия этого класса соединений часто используют тривиальные названия. Например, бензол, толуол, стирол, кумол и другие. По международной заместительной номенклатуре арены рассматривают как производные бензола, где положение заместителей указывается цифрами, при чём номера атомов углерода, от которых отходят заместители, должны получить наименьшие номера.
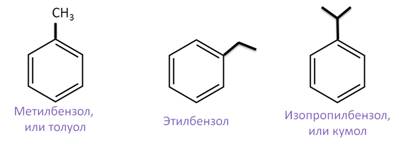
Назовём следующие арены: первый арен называется метилбензол, или толуол, второй арен называется этилбензол, третий называется изопропилбензол, или кумол.
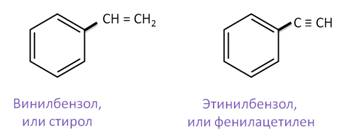
Рассмотрим арены, содержащие заместители с кратными связями: первый арен называется винилбензол, или стирол, второй – этинилбензол, или фенилацетилен.
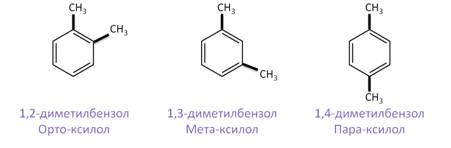
Если в аренах два одинаковых заместителя, то вместо цифр можно использовать приставки: положение 1,2 называется «орто», положение 1,3 – «мета», а положение 1,4 – «пара». Поэтому следующие гомологи бензола можно назвать так:
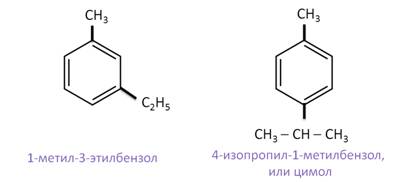
Если в аренах два различных заместителя, то нумерацию определяет младший заместитель.
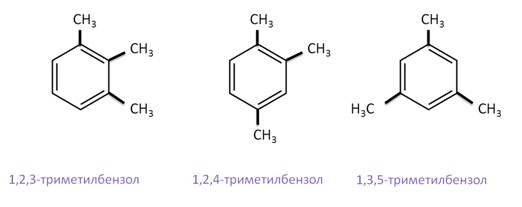
Рассмотрим более сложные примеры, где арен содержит три заместителя. Первый арен называется 1,2,3-триметилбензол, второй – 1,2,4-триметилбензол, а третий – 1,3,5-триметилбензол.
Для аренов характерна изомерия, связанная со строением радикалов, их составом и положением.
Рассмотрим изомерию, связанную со строением боковых цепей. Так, изомерами между собой являются пропилбензол, или кумол, и изопропилбензол.
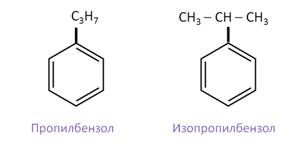
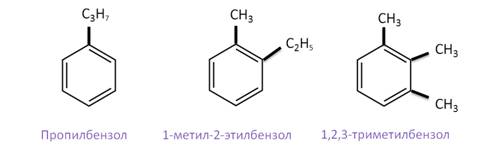
Если это изомерия, связанная с числом атомов углерода в заместителях, то изомерами между собой будут пропилбензол, 1-метил-2-этилбензол и 1,2,3-триметилбензол, которые содержат в сумме по 3 атома углерода в заместителях.
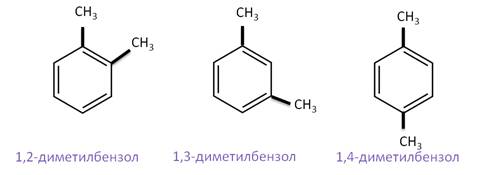
Рассмотрим изомерию, связанную с положением заместителей в цикле. Такими изомерами между собой будут 1,2-диметилбензол, 1,3-диметилбензол и 1,4-диметилбензол.
Таким образом, общая формула аренов CnH2n-6, все атомы молекулы бензола лежат в одной плоскости, и длины всех С – С-связей равны 0,140 нм. Для аренов характерна изомерия, связанная со строением радикалов, их составом и положением.
Бензол и его ближайшие гомологи являются бесцветными жидкостями со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, но растворяются в органических растворителях: спирте, эфире, ацетоне. Бензол и его гомологи являются хорошими растворителями. Большинство ароматических соединений являются токсичными веществами.
Например, бензол – бесцветная жидкость с характерным запахом, кристаллизуется при 5,5 0C и кипит при 80,1 0C. Бензол является токсичным веществом, опасны и его пары. Вдыхание паров длительное время приводит к заболеваниям крови, бензол может также нарушать структуру хромосом.
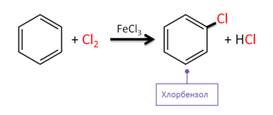
Для бензола и его гомологов характерны реакции замещения. Так, при хлорировании бензола в присутствии катализатора FeCl3 образуется хлорбензол. Данные реакции идут легче, чем у алканов.
К реакциям замещения относится и реакция бензола с азотной кислотой. Роль катализатора здесь выполняет серная кислота. Так, в реакции бензола с азотной кислотой в присутствии серной кислоты образуется нитробензол, имеющий запах миндаля.

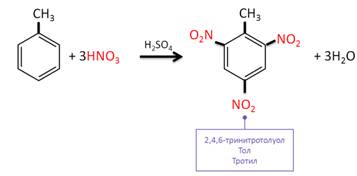
В реакции метилбензола – толуола – с азотной кислотой образуется 2,4,6-тринитротолуол, тол или тротил.
По химическим свойствам алкильные радикалы, которые есть у гомологов бензола, подобны алканам. Поэтому в отсутствии катализатора или при действии УФ-облучения идёт радикальная реакция замещения в боковой цепи. Причём атом водорода замещается у того атома углерода, который непосредственно связан с бензольным кольцом.
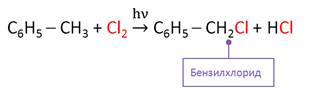
Таким образом, в реакциях замещения сохраняется ароматическая структура молекулы.
В более жёстких условиях бензол и его гомологи вступают в реакции присоединения, при этом наблюдается потеря ароматической структуры.
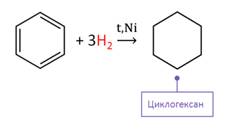
Так, бензол присоединяет водород в присутствии катализатора Ni, при этом образуется циклогексан.
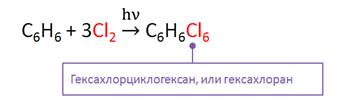
В реакции бензола с хлором в присутствии света также идёт реакция присоединения, при этом образуется гексахлорциклогексан – гексахлоран.
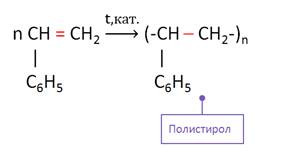
Гомологи бензола, имеющие заместители с кратными связями, вступают в реакции полимеризации. Так, при полимеризации стирола образуется полистирол.
Бензол сгорает на воздухе с образованием коптящего пламени.
2C6H6 + 15O2 → 12CO2↑ + 6H2O
Бензол при обычных условиях не обесцвечивает бромную воду и водный раствор марганцовки. А его гомологи окисляются перманганатом калия, то есть обесцвечивают раствор марганцовки.
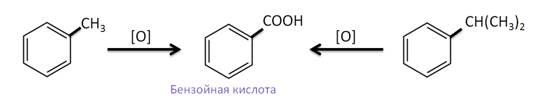
Так, при действии на гомологи бензола сильными окислителями, образуется бензойная кислота, не смотря на то, какой была цепь заместителя.
Если гомолог содержит две боковые цепи, то образуются двухосновные кислоты.
Рассмотрим способы получения ароматических углеводородов. Самый первый способ получения бензола в промышленности основан на перегонке каменноугольной смолы.
Бензол и его гомологи в основном получают при термических и каталитических превращениях некоторых продуктов перегонки нефти, из каменноугольной смолы и коксового газа.
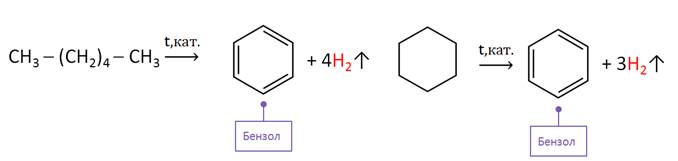
Так, бензол и его гомологи можно получить дегидрированием гексана и его гомологов. Из гексана получают циклогексан, а из него – бензол.
Дегидрированием метилциклогексана можно получить толуол.
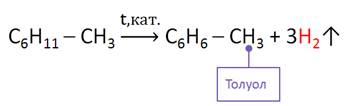
Бензол также можно получить пропусканием ацетилена через нагретый активированный уголь. Эта реакция называется реакцией Зелинского.
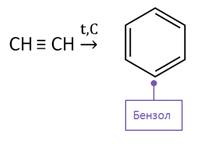
 Николай Дмитриевич Зелинский – русский и советский химик-органик, создатель научной школы, один из основоположников органического катализа и нефтехимии. Наиболее известен как изобретатель первого эффективного противогаза.
Николай Дмитриевич Зелинский – русский и советский химик-органик, создатель научной школы, один из основоположников органического катализа и нефтехимии. Наиболее известен как изобретатель первого эффективного противогаза.
В лаборатории бензол и его гомологи можно получить сплавлением солей бензойной кислоты с твёрдыми щелочами. Так, при сплавлении бензоата натрия с гидроксидом натрия образуется бензол и карбонат натрия.
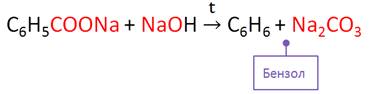
Гомологи бензола можно получить по реакции Вюрца-Фиттинга. Суть реакции заключается в действии натрия на галогенпроизводные. Так, в реакции хлорбензола и хлорметана с натрием образуется метилбензол и хлорид натрия.
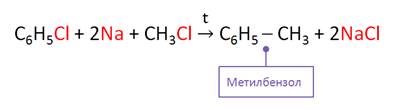
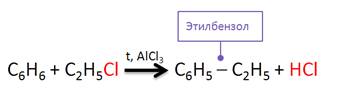
Гомологи бензола получают также по реакции Фриделя-Крафтса. Эта реакция алкилирования бензола. Так, в реакции бензола с хлорэтаном образуется этилбензол и хлороводород.
Рассмотрим применение бензола и его гомологов. Бензол, например, является хорошим растворителем. Его используют для получения анилина, хлорбензола, фенола и стирола.
Толуол является также растворителем, его используют при производстве красителей, лекарственных и взрывчатых веществ.
Ксилолы применяют в качестве растворителя, в синтезе органических веществ.
Изопропилбензол применяют в производстве фенола и ацетона.
Хлорпроизводные бензола используют для защиты растений, для протравливания семян против головни, для борьбы с вредными насекомыми.
Стирол, из которого получают полистирол, используется в производстве игрушек, предметов домашнего обихода, получении пенополистирола.
Таким образом, характерными свойствами бензола и его гомологов являются реакции замещения. В жёстких условиях бензол подвергается реакциям присоединения. Ароматические соединения получают при термической и каталитической ароматизации продуктов перегонки нефти. Ароматические соединения широко применяются в качестве исходного сырья для получения пластмасс, волокон, красителей, взрывчатых веществ и других продуктов, а также в качестве растворителей.