Предисловие.
Будучи огорчен качеством преподавания химии в РНИИМУ, и тем более, способом последующего контроля качества образования – тестами, я решил оказать посильную помощь студентам в сдаче оных. Пособие представляет собой краткую, насколько возможно, инструкцию, как минимально загрузив голову таки сдать этот окаянный тест. Я исследовал большое их количество, обобщил результаты.
На каждый вид вопросов я постарался дать ответ, в меру научный, чтобы все-таки не слишком уйти от своих химических корней, но и достаточно ясный, чтобы он мог быть воспринят среднестатистическим студентом. Теперь я представляю свой труд для использования широкой общественностью, надеюсь, моё творение сможет послужить к чьей-нибудь пользе.
Конечно, многим хотелось бы иметь готовые ответы и не париться. Думаю, что за годы работы eois общественность накопила некоторый объем ответов, он постепенно совершенствуется, доля верных ответов растет, уже в 2016 она была больше 70%. Правда, обновление вопросов в 2017 добавило веселья. Однако, в отношении химии мне это кажется неудачным путем. Объясню, почему я так считаю. Во-первых, вопросов большое количество, и они, как назло, очень похожи. Это делает трудным списывание с правильных ответов, и, одновременно, делает тесты уязвимыми к методичкам вот такого плана, с разбором вопросов на группы и злой иронией по этому поводу. Во-вторых, некоторые персонажи, как Карина, например, почему-то борются со списыванием, что делает этот процесс не самым простым трюком. А глядя на всё это глобально, по-моему, все же лучше что-то понимать и мыслить, чем списывать.
Заранее благодарен за адекватные комментарии, дополнения и исправления к тексту. Текст создан исключительно из гуманных соображений и распространяется безвозмездно.
Удачи, ни пуха, ни пера, дорогие любители химии.
Алексей «Леша-химик» Федоров,
..2017.
Тема 7. Буферные растворы.
Введение:
Тема устроена очень красиво. Будет много проще, если Вы поймете эту красоту, тогда не будет нужды в делении на вопросы, каких-то читах, разборах по вопросам, и тому подобной хуите. Если теория — это не ваше, можете спокойно дропнуть этот раздел, в вопросах тоже есть всё нужное. Но мы настоятельно рекомендуем остаться с нами.
Итак, буферные растворы. Скорее всего, вы знаете, что в человеческом желудке сильнокислая среда, и нужно это затем, чтобы расщеплять белки до аминокислот. Но, что если человек выпьет три литра воды? Кислота разбавится, да еще и всё это стечет в кишечник, а там среда щелочная, в итоге все нейтрализуется, человек не сможет усваивать ни белки, ни углеводы, и всё пойдёт по пизде, и этот пидорас сдохнет нахуй? Однако, точно известно, что три литра воды к смерти не приводит. Желающие идут проверять, остальные продолжают курить теорию вместе с нами.
Буферный раствор — раствор, поддерживающий рН (кислотность, короче) постоянным при добавлении кислот и щелочей в небольших количествах и разбавлении. Оговоримся: у буферного раствора есть ёмкость, при которой он может поддерживать рН относительно постоянным. Бесконечное количество кислоты или щелочи, конечено, ни один буферный раствор не нейтрализует.
Но постойте, это же охренеть! В него льют кислоту — он нейтрализует её. В него льют щелочь — он нейтрализует и её тоже. В него льют воду — он держит рН постоянным и просит ещё. Кто он?!?! Что он такое?!?! Буферный рааааааствор, встречайте (далее БР). Он офигенен. Он просто бесконечно крут. Как он, мать его, это делает? Да он же состоит из сопряженной кислотно-основной пары. Строго надо говорить, что состоит из кислоты и сопряженного основания или основания и сопряженной кислоты. Но мы далее для краткости будем говорить просто, сопряжённое основание и сопряжённая кислота. Это какая-то хуита без Н+ и та же самая с Н+. Например, NH3 / NH4+. НРО42- /Н2РО4-. СН3СОО-/СН3СООН. И так далее. Полный список см. таблицу (сразу договоримся, что в растворе молеклы легко распадаются на ионы, например поэтому СН3СООNa и СН3СОО- одно и то же. Может встречаться вариант как молекула и как ион, одно и то же, не удивляйтесь. Натрий легко удаляется диссоциацией):
| Название: | Состав | Формула для рН | |
| Сопряженна кислота | Сопряженное основание | ||
| Ацетатная | СН3СООН | СН3СОО- (или СН3СООNа) | 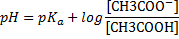
|
| Гидрокарбонатная | Н2СО3 (или СО2+Н2О) | НСО3- (или NаНСО3) | 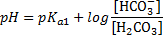
|
| Карбонатная | НСО3- (или NаНСО3) | СО32- (или Nа2СО3) | 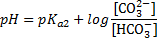
|
| Аммиачная | NH4+ (или NH4Cl) | NH3 | 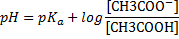
|
| (Тригидро)Фосфатная | Н3РО4 | Н2РО4- | 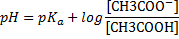
|
| Дигидрофосфатная | Н2РО4- | НРО42- | 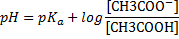
|
| Гидрофосфатная | НРО42- | РО43- | 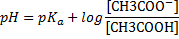
|
| Аминокислотная-1 | NH3+-CH(R)-COOH Катионная форма | NH3+-CH(R)-COO- Диполярная форма | 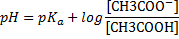
|
| Аминокислотная-2 | NH3+-CH(R)-COO- Диполярная форма | NH2-CH(R)-COO- Анионная форма | 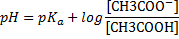
|
| Метиламиновая | [CH3NH3]Cl | СН3NH2 | 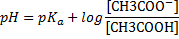
|
| И многие другие | НХ | Х | 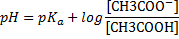
|
Как же этот хитрый пидор работает? А вот так. Для примера возьмём аммиачный буферный раствор. Он состоит из сопряженного основания NH3 и сопряженной кислоты NH4+ (NH4Cl) Имея в виду это, рассмотрим случаи.
1) Если к нему добавили сильную кислоту, например HCl. Так как в БР есть основание (сопряженное), оно будет её нейтрализовывать.
NH3 + HCl = NH4Cl
Или в ионном виде
NH3 + H+ + Cl- = NH4+ + Cl-
А если сократить хлорид
NH3 + H+ = NH4+
Пресвятой Менделеев, получилась сопряженная кислота. Из сопряженного основания получилась сопряженная кислота, при этом важно, что сильная кислота нейтрализовалась нахер. Значит, рН останется примерно постоянным (сопряженная кислота — слабая, она влияет на рН, конечно, но много слабее, чем HCl. Ион Н+ связывается)
2) Если к тому же буферному раствору добавили щелочь. Теперь-то этот пидор не отвертится? Хер там плавал. Ведь в нём есть и сопряженная кислота, которая может нейтрализовать щелочи.
NH4Сl + NaOH = NH3 + H2O + NaCl
Или в ионном виде
NH4+ + Сl- + Na+ + OH- = NH3 + H2O + Na+ + Cl-
Или, сократив одинаковое
NH4+ + OH- = NH3 + H2O
В рот мне ноги, это же сопряжённое основание. Охренеть, из сопряженной кислоты получилось сопряженное основание! А щелочь нейтрализовалась. Сами Гендерсон и Гассельбах охренели бы от такого поворота. А рН остается примерно постоянным. Этот мелкий засранец снова выкрутился. Вот же ж!
Подобные реакции могут быть написаны для любого другого БР и называются механизмами буферного действия. Хотя напрямую это не касается тестов, это может быть в колке, если он будет устным, и, кроме того, половина вопросов тестов как бы подразумевает, что механизм работы БР понятен.
Еще вернемся к таблице и прокомментируем некоторые подводные грабли. Таблица состоит из названия буферной системы, её компонентов и формулы для расчета рН. Например, если где-то попадается "аммиачная буферная система", то нужно самостоятельно догадаться, что это NH3/NH4+. В суставах все просто, основание на Н меньше, кислота на Н больше. В формулах самая подстава. Обратите внимание, что есть формулы с рКа1, есть с рКа2, есть с рКа3. Номер константы соответствует стадии диссоциации той кислоты, что есть в этом БР. Например, в гидрокарбонатной системе кислота Н2С3, диссоциирующая По первой ступени, в формуле константа рКа1. Для карбонатной буферной системы кислота НСО3-, диссоциирующая уже по второй ступени, поэтому константа в формуле рКа2. Еще более наглядно это видно на группе Фосфатный БР. Уделите время пониманию этого, это реально упростит понимание тестовых вопросов.
Типичные вопросы:
1. Типы буферных систем.
Пример:
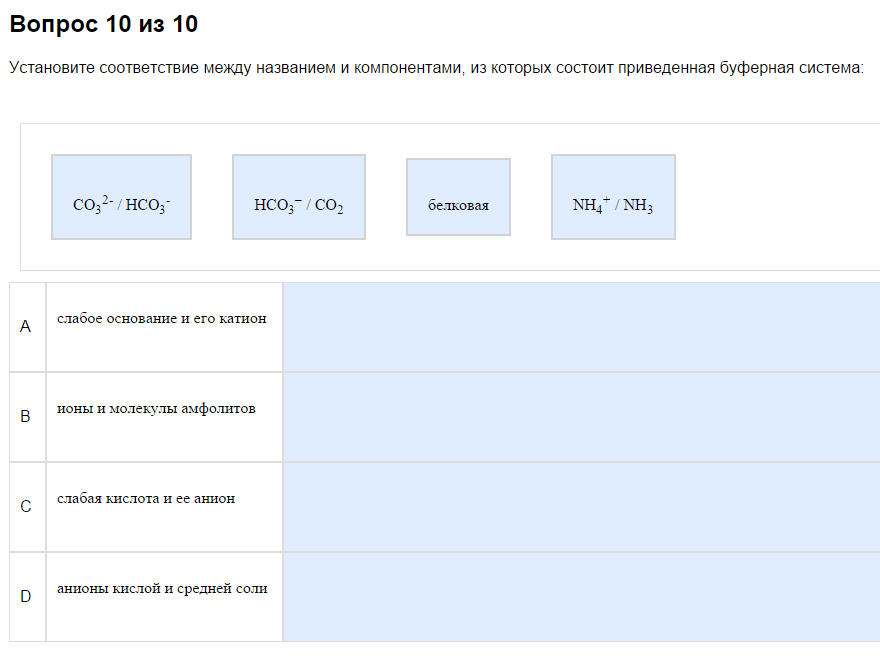
На первый взгляд путано, фактически несложно…
Как с этим бороться:
Всегда в наборе есть
Слабая кислота и её соль. Вспомните прошлую тему, найдите, какие кислоты слабые. Здесь то же самое. Чаще всего это что-то-СООН, но аккуратно.
Слабое основание и его соль. См. прошлую тему про слабые основания. Чаще всего это амины, что-то типа что-то там такое NxHy.
Анионы кислой и средней соли. О кислых соплях также можно почитать в прошлойтеме. Обычно что-то вида НА+А, например НСО3+СО3
Амфолит. Это аминокислоты. Самые большие формулы из предложенных. В них обязательно должны быть СОО(Н) и NH2(3). Они ж аминокислоты. Могут быть названиями, глицин, плагин, скрин, лизин - это все о них. Могут быть белки, это тоже Амфолиты, производные аминокислот.
2. Аминокислотные буфера.
Пример:

Суперлайт…
Как с этим бороться:
Очень легкая задача. Сравниваем рН с рI. Если рН<pI, аминокислоты в картонной и диполярной форме. Если рН>.pI, то в анионной и диполярной. Да, все так просто. Нет, это не наёб. Нет, ошибки в том, что диполярная забавна два раза, нет.
3. Подбор формулы.
Пример:

…
Как с этим бороться:
Несложно, в целом. Во-первых, если в теории вы ничего не поняли, можно тупо брать формулы из таблицы. Там есть почти все нужное. Обращайте внимание, где первая константа, где вторая, и что на что делить. Если в теории вы разобрались, то еще лучше. БР состоит из пары основание-кислота. Даже если попадется непонятный БР, то в любом случае, рН=рКа(кислоты)+log(основание/кислота).
4. Интервал буферного действия.
Пример:
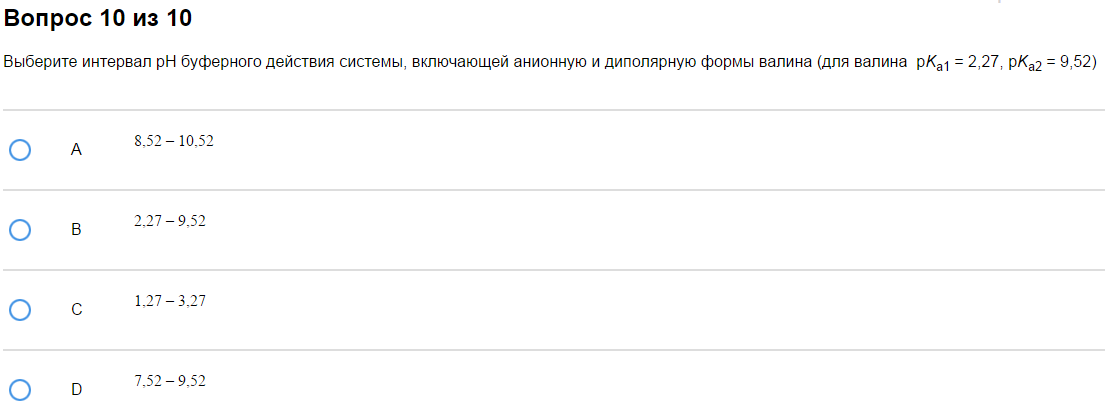
…
Как с этим бороться:
Тоже очень просто. Интервал буферного действия это область рН от рКа-1 до рКа+1. Например, если рКа=4,75, то интервал равен от 3,75 до 5,75. Подвох в том, что константы может быть дано несколько. Использовать надо ту же самую, по которой считали рН. Ту же самую, которая рКа кислоты в БР. Если дана БР из NaHCO3+Na2CO3, то её рН считается по рКа2 (мм. таблицу БР) и следовательно, интервал тоже по ней же.
5. Соотношение компонентов, рН и рКа.
Пример:

…
Как с этим бороться:
.
6. Нейтрализовать больше кислоты / больше щелочи / поровну.
Пример:
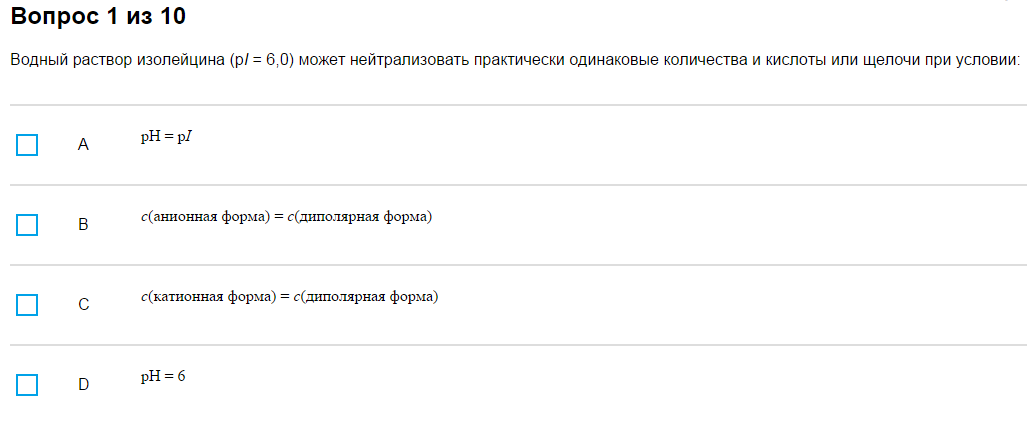
…
Как с этим бороться:
7. Задача, в которой смешали.
Пример:

…
Как с этим бороться:
8. Задача, в которой добавляют сильную кислоту или щёлочь.
Пример:

.
Как с этим бороться:
9. Задача про буферную ёмкость, Вк или Вщ.
Пример:
Раз

И два:

…
Как с этим бороться:
10. Норма, ацидоз, алкалоз.
Пример:

…
Как с этим бороться:
.
11. Буферные системы крови.
Пример:

Наконец-то что-то медицинское…
Как с этим бороться:
.
12. Верно-неверно.
Пример:
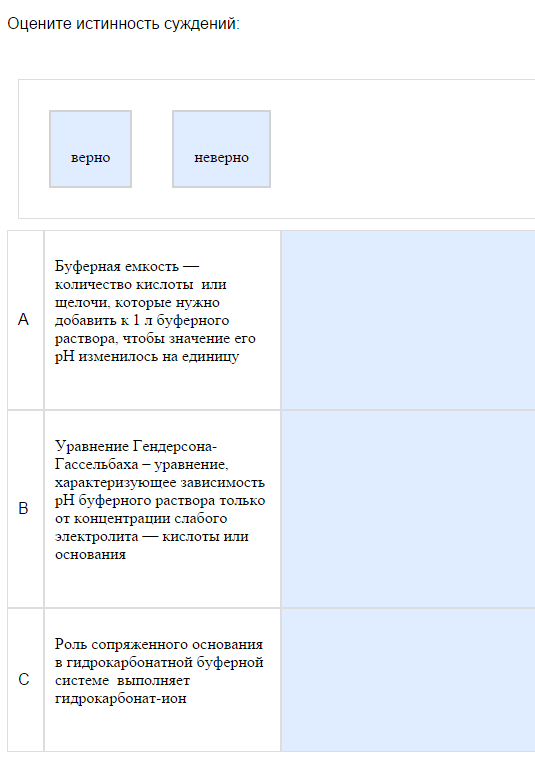
…
Как с этим бороться:
.
Прежде, чем предложить Вам, мы всегда проверяем наши теоретически выкладки практикой. Пффф, ничего сложного
Спасибо за внимание!
Если вам понравились наши разборы, Вы можете поддержать наш проект тут
https://vk.com/mars_him_prom
через функцию «поддержать…»
Спешл фор ю — симпотичная девушка