Карбоновые кислоты.
Карбоновыми кислотами называются соединения, содержащие карбоксильную группу

Карбонил+ гидроксил=карбоксил
I.Классификация.
1. По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, или одноосновные (одна группа —СООН), дикарбоновые, или двухосновные (две группы —СООН), и т. д.
2.В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты бывают
алифатическими (например, уксусная или акриловая),
алициклическими (например, циклогексанкарбоновая) или
ароматическими (бензойная, фталевая).
Если в углеводородном радикале карбоновых кислот атом (атомы) водорода замещен на другие функциональные группы, то такие кислоты называются гетерофункциональными. Среди них различают галогенкарбоновые (например, CH2Cl—СООН), нитрокислоты (например, NО2—С6Н4СООН), аминокислоты (см. “Азотсодержащие соединения”), оксикислоты (например, СН3—СН(ОН)—СООН) и др.
Карбоновые кислоты с числом атомов углерода выше 6 называют высшими (жирными) кислотами.
Номенклатура. В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая. Карбоновые кислоты часто имеют тривиальные названия: муравьиная, уксусная и др. (см. табл.).
Карбоновые кислоты
| Формула | Систематическое название | Тривиальные названия и анионы | |
| Монокарбоновые кислоты | |||
| НСООН | Метановая | Муравьиная-формиат | |
| СН 3СООН | Этановая | Уксусная-ацетат | |
| C2H5COOH | Пропановая | Пропионовая-пропионат( | |
| Бутановая Пентановая Гексановая | |||
| C6H5COOH | Бензойная | ¾ бензоат | |
| C6H4(ОН)СООН | 0рто-гидроксибензойная | Салициловая-салицилат | |
| ЖИРНЫЕ | |||
| СН3(СН2)14СООН | Гескадециловая(С16) | Пальмитиновая- | |
| СН3(СН2)16СООН | Октадециловая (С18) | Стеариновая-стеарат | |
| Д о п и с а т ь с а м и м | Олеиновая Линолевая линоленовая | ||
| CH2==CH—СООН | Пропеновая | Акриловая-акрилат | |
| Дикарбоновые кислоты | |||
| НООС—СООН | Этандиовая | Щавелевая-оксалат | |
| НООС—CH2—СООН | Пропандиовая | Малоновая-малонат | |
| НООС—СН2—CH2—СООН | Бутандиовая- этандикарбоновая кислота | Янтарная-сукцинат | |

| Бензол-1,2-дикарбоновая (орто-изомер) | Фталевая-фталат | |

| Бензол-1,4-дикарбоновая (пара-изомер) | Терефталевая | |
Названия ароматических кислот производят от бензойной кислоты, например:

Изомерия. Возможны следующие виды изомерии:
1. Изомерия углеродной цепи. Она начинается с бутановой кислоты (С3Н7СООН), которая существует в виде двух изомеров: масляной и изомасляной (2-метилпропановой) кислот.
2. Изомерия положения кратной связи, например:
СН2==СН—СН2—СООН СН3—СН==СН—СООН
Бутен-3-овая кислота Бутен-2-овая кислота
(винилуксусная кислота) (кротоновая кислота)
3. Цис-, транс-изомерия, например:

4. Межклассовая изомерия: например, масляной кислоте (СН3—СН2—CH2—СООН) изомерны метиловый эфир пропановой кислоты (СН3—СН2—СО—О—СНз) и этиловый эфир уксусной кислоты (СН3—СО—О —CH2—СН3).
5. У гетерофункционалъных кислот возможна изомерия, связаннаяс положением функциональных групп, например, существуют три изомера хлормасляной кислоты: 2-хлорбутановая, 3-хлорбутановая и 4-хлорбутановая.
(Для гетерофункциональных кислот возможна также оптическая изомерия).
Способы получения.
1. Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот:

2. Другой общий способ — гидролиз тригалогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода:

3. Взаимодействие реактива Гриньяра с СО2(не обязат знать):

4. Гидролиз сложных эфиров:

5. Гидролиз ангидридов кислот:
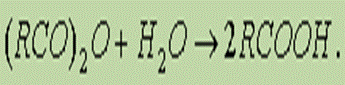
Для отдельных кислот существуют
специфические способы получения:
А).Муравьиную кислоту получают нагреванием оксида углерода (II) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой:

Окисление углеводородов
Б)Уксусную кислоту получают в промышленных масштабах каталитическим окислением бутана кислородом воздуха:

В)Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия (см.ранее “Ароматические углеводороды”):
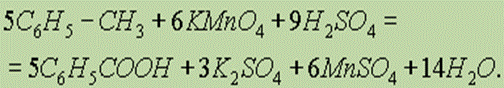
Насыщенные алифатические монокарбоновые кислоты образуют гомологический ряд, который характеризуется общей формулой СnН2n+1СООН.
Физические свойства.
Низшие члены этого ряда(С1— С9) представляют собой жидкости, обладающие характерным острым запахом. Средние представители ряда—вязкие, “маслообразные” жидкости; начиная с С10 — твердые вещества.
Кислоты, содержащие 1—3 углеродных атома, неограниченно смешиваются с водой. С дальнейшим ростом углеводородного радикала растворимость монокарбоновых кислот уменьшается, твердые высшие жирные кислоты в воде не растворяются(поэтому не являются электролитами и не изменяют окраску индикаторов).
Ненасыщенные кислоты, как правило, жидкости.
Все дикарбоновые и ароматические кислоты при комнатной температуре — кристаллические вещества.

Строение. Карбоксильная группа СООН состоит из карбонильной группы С==O и гидроксильной группы ОН, которые оказывают взаимное влияние друг на друга. В группе СО атом углерода несет частичный положительный заряд и притягивает к себе неподеленную электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается и связь O-Н ослабляется (увеличиваются кислотные свойства):

В свою очередь, группа ОН “гасит” положительный заряд на группе СО, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Химические свойства.
I.СВОЙСТВА ОБЩИЕ ДЛЯ ВСЕХ КИСЛОТ (ОРГ И НЕОРГ)
1. Диссоциация кислот. В водном растворе карбоновые кислоты диссоциируют:
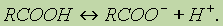
Однако это равновесие диссоциации сильно сдвинуто влево, поэтому карбоновые кислоты, как правило, слабые кислоты .(КИСЛЫЕ НА ВКУС ВСЕ, что растворимы в воде)
Вследствие взаимного влияния атомов в молекулах дикарбоновых кислот они являются более сильными, чем одноосновные.
2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот: реагируют с активными металлами, основными оксидами, основаниями:
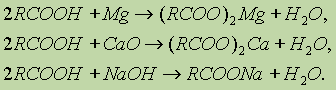
Карбоновые кислоты — в основном-слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей.:
 СH3COONa + HCl = СH3COOH + NaCl
СH3COONa + HCl = СH3COOH + NaCl
3СН3(СН2)14СООK + H3PO4= 3СН3(СН2)14СОOН +K3PO4
Жидкое мыло