Азотометрические методы
Азотометрические методы определения общего белка сыворотки основаны на определении количества белкового азота, образующегося при разрушении аминокислот, входящих в состав белков. Впервые метод был предложен Кьельдалем в 1883 году. В методе Кьельдаля, в настоящее время представляющем в целом исторический интерес, азот, содержащийся в составе белков, окисляют до иона аммония и его количество определяют титрованием точным раствором соляной кислоты. Кроме того, ион аммония может быть определен реактивом Несслера, манометрическим методом после превращения иона аммония в молекулярный азот под действием гипобромита или с помощью оптического теста Варбурга при участии фермента глутаматдегидрогеназы. Исходя из того, что белки из биологических объектов содержат в среднем 16 % азота, полученное в результате анализа количество азота умножают на коэффициент 6,25. Исторически используют фактор 6,25, хотя его величина зависит от белкового состава исследуемого образца. Для отдельных фракций белка в сыворотке или плазме величина фактора колеблется в диапазоне от 5,69 до 6,52.
(Метод Дюма, метод Кьельдаля)
Недостатком азотометрических методов является длительность и сложность процедуры, даже при том, что аммиак, образующийся в реакции, можно определять ферментативным методом. Автоматизация позволяет использовать этот метод в ряде случаев в качестве метода сравнения из-за его достаточной точности и воспроизводимости.
Преципитационные» методы
«Преципитационные» методы определения общего белка основаны на снижении растворимости белков и образовании суспензии взвешенных частиц под воздействием различных агентов. О содержании белка в исследуемой пробе судят либо по интенсивности светорассеяния (нефелометрический метод анализа), определяемого числом светорассеивающих частиц, либо по ослаблению светового потока образовавшейся суспензией (турбидиметрический метод анализа).
|
|
Результаты данной группы методов зависят от множества факторов: скорости смешивания реактивов, температуры реакционной смеси, значения рН среды, присутствия посторонних соединений, способов фотометрии. Тщательное соблюдение условий реакции способствует образованию стабильной суспензии с постоянным размером взвешенных частиц и получению воспроизводимых результатов. «Преципитационные» методы для определения белка в сыворотке крови не получили признания и нашли применение при определении белка в моче, спинномозговой жидкости и многих индивидуальных белков с использованием специфических антител.
Колориметрические (фотометрические) методы
Колориметрические методы определения общего белка основаны на цветных реакциях белков с хромоген-образующими реактивами или на неспецифическом связывании красителя.
Среди колориметрических методов определения концентрации общего белка сыворотки наиболее распространенным считается биуретовый метод, основанный на так называемой «цветной биуретовой реакции», в ходе которой белки реагируют в щелочной среде с сульфатом меди с образованием соединений, окрашенных в фиолетовый цвет, интенсивность окраски зависит от концентрации общего белка в сыворотке
Колориметрические методы определения общего белка достаточно просты и относительно дешевы. К недостатку метода относится интерферирующее действие некоторых веществ (в том числе лекарств).
|
|
Наиболее распространённым количественными методами являются метод Кьельдаля, Лоури с реактивом Фолина, Войвуда в модификации Т.А. Глагоревой, К.А. Мерка.
1) Б и у р е т о в ы й м е т о д- по пептидным связям белковой молекулы;
Принцип метода. Метод основан на способности белков давать с раствором сернокислой меди фиолетовое окрашивание в щелочной среде. Для биуретовой реакции необходимо наличие двух ОН-групп и трех атомов азота, находящихся в полипептидной цепи. Группа, образующая пептидную связь (– ОС – NH –) в щелочной среде, присутствует в своей таутомерной форме. В избытке щелочи происходит диссоциация водорода енольной ОН-группы, при этом возникает отрицательный заряд, с помощью которого кислород, взаимодействуя с медью, образует соль; кроме того, медь образует дополнительные (дативные) связи с атомами азота пептидных связей. Возникший комплекс характеризуется высокой стабильностью.
Чувствительность данного метода позволяет определять белок в диапазоне концентраций от 2 до 10 мг в пробе.
Реактивы: 1. Раствор сывороточного альбумина, содержащий 10 мг белка в 1 мл (стандартный раствор).
2. Биуретовый реактив: 0,15 г СuSО4∙5Н2О и 0,6 г натрий-калия виннокислого (NаКС4Н4О6•4Н2О) р астворяют в 50 мл Н2О, при энергичном перемешивании приливают 30 мл 10 % раствора NаОН, затем добавляют 0,1 г КI. Объем раствора доводят дистиллированной водой до 100 мл. Реактив хранят в парафинированной или полиэтиленовой склянке в течение 1 мес. Ход работы. Для построения калибровочного графика из стандартного раствора альбумина готовят растворы белка, содержащие 2, 4, 6, 8 и 10 мг альбумина в 1 мл. В каждую пробирку, содержащую 1 мл раствора белка соответствующего разведения добавляют 4 мл биуретового реактива, перемешивают и оставляют при комнатной температуре на 30 мин. Измеряют оптическую плотность раствора на ФЭК при 540 нм в 1 см кювете.
|
|
На каждую точку проводят два определения, для построения калибровочного графика используют среднее арифметическое.
Содержание белка в исследуемых растворах рассчитывают по калибровочному графику.
-------------------------------------------------------------------------------------------------------
Б и у р е т о в ы й м е т о д.Основан на образовании биуретового комплекса (имеет фиолетовый цвет) пептидных связей белков с двухвалентными ионами меди. В методе используют т. н. биуретовый реактив, состоящий из KOH, CuSO4 и цитрата натрия (или тартрата натрия). В образовавшемся комплексе медь связана с 4 азотами координационными связями, а с 2 кислородами — электростатическими. Полноценный комплекс образуется лишь с пептидами, состоящими более чем из 4 остатков.
Интенсивность окраски раствора прямо пропорциональна концентрации белка в сыворотке и определяется фотометрически.
К достоинствам метода стоит отнести его низкую чувствительность к посторонним веществам, невысокую погрешность.
Комплексной медно-натриевой соли пептидов приписывают следующее строение:
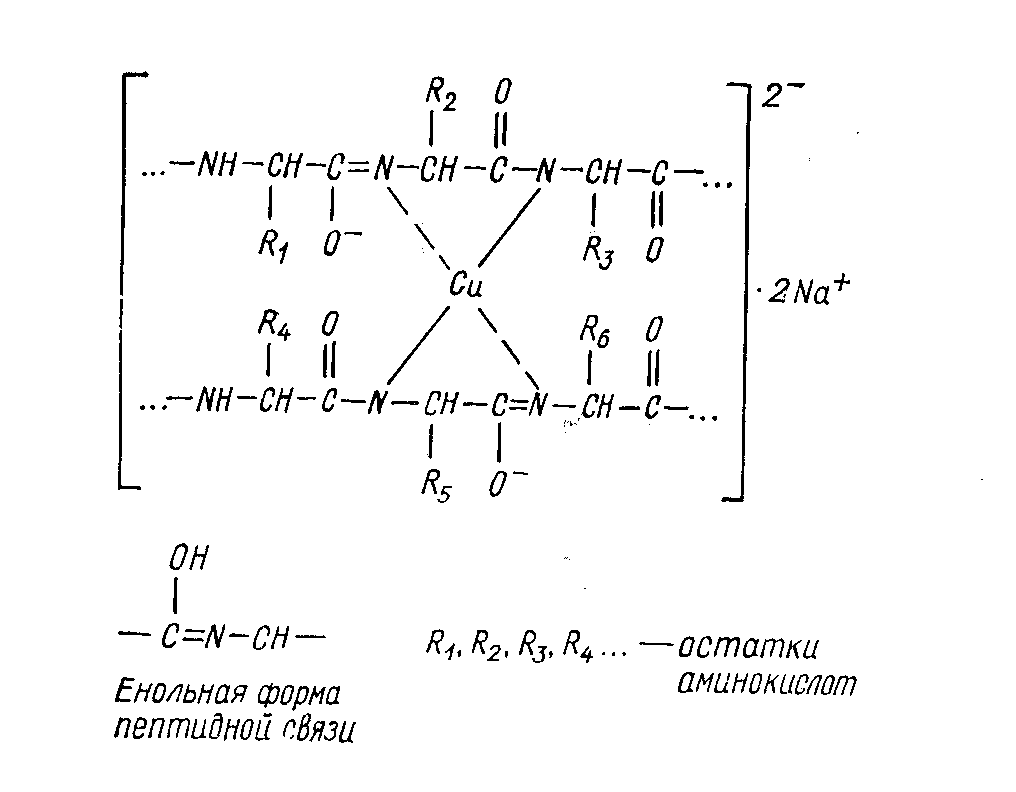
---------------------------------------------------------------------------------------------------------
#4
Sinnerman
Биуретовая реакция на белок
Принцип метода
Пептидные связи белка с солями меди в щелочной с образуют комплекс фиолетового цвета. Белки предварительно осаждают трихлоруксусной кислотой.
Необходимые реактивы
I. 10%-ный раствор трихлоруксусной кислоты.
II. 20%-ный раствор меди (CuSO4∙5H2O).
III. 3%-ный раствор NaOH.
М е т о д Л о у р и. Метод количественного определения белка, основанный на измерении концентрации окрашенных продуктов, образующихся в результате сочетания двух химических реакций: биуретовой реакции на пептидную связь и взаимодействия реактива Фолина-Чокалтеу с ароматическими аминокислотами.
Фолина — Чокалтеу реактив смесь растворов вольфрамовокислого и молибденовокислого натрия, к которой добавляют последовательно фосфорную, соляную кислоту и, после кипячения, сульфат лития, а также несколько капель бромной воды;
Метод Лоури
Метод Лоури объединяет биуретовый реагент с другим (реагент Фолина), последний реагирует с остатками тирозина и триптофа в белках. Это дает синеватый цвет, который поглощает в область между 500 - 750 нм в зависимости от того, какая требуется чувствительность. Существует небольшой пик поглощения около 500 нм, который может быть использован для определения высоких концентраций белка и интенсивный пик около 750 нм, который может быть использован для определения низких концентраций белка. Этот метод является более чувствительной к низкому содержанию белков, чем просто метод с биуретовым реактивом.
Принцип В щелочной среде ионы Cu+2 образуют комплекс с пептидными связями, переходя в Cu+. Одновалентные ионы меди реагируют с реактивом Фолина (фосфомолибденовая кислота с фенолом), образуя нестабильный продукт, переходящий в молибденовую синь, с максимумом адсорбции при 750 нм. Увеличение адсорбции при 750 нм пропорционально концентрации белка. Метод очень чувствителен к наличию в растворе посторонних восстановителей (что затрудняет его использование при определении белка в неочищенных препаратах), чувствительность к белку — 10 — 100 мкг/мл.
(Синие окрашивание.)