Практическая работа.
Определение нормальности и титра раствора.
Объемным (титриметрическим) анализом называют метод количественного химического анализа аналитической химии, основанный на точном измерении объемов растворов, реагирующих между собой нацело веществ.
Основной операцией объемного анализа является титрование – постепенное приливание одного раствора, находящегося в бюретке, к точно известному объему другого вещества, находящемуся в колбе, до точки эквивалентности.
Точкой эквивалентности считают момент титрования, в который все вещество из раствора в колбе прореагирует. Точка эквивалентности фиксируется глазом аналитика по изменению внешнего вида (например, цвета) растворов реакционной системы или специально добавленного индикатора.
По точно измеренным объемам растворов двух реагирующих веществ и известной концентрации одного из них рассчитывают неизвестную концентрацию другого раствора.
Расчеты основывают на законе эквивалентов: “Вещества вступают в химические реакции друг с другом строго определенными массами их эквивалентов”.
Например, для реакции: А + В → С + Д
выражение закона эквивалентов:
m (A) /m (B) = M (1/z A)/ M (1/z B)
Можно закон сформулировать упрощенно: “Количества эквивалентов прореагировавших веществ равны между собой”, что для той же реакции
А + В → С + Д
можно записать:
n (1/z A) = n (1/z B).
Методы объёмного анализа
В зависимости от типа химической реакции, используемой в целях анализа, различают методы объемного анализа:
· - методы, основанные на применении реакций обмена (метод нейтрализации или кислотно-основное титрование; метод осаждения);
· - методы, основанные на применении реакций окисления-восстановления (оксидиметрия или редоксметрия, или окислительно-восстановительное титрование);
· - методы, основанные на применении реакций комплексообразования (комплексонометрия или комплексонометрическое титрование).
Примеры типовых задач и расчетов в объемном анализе.
Задача.
Какова масса двухводного кристаллогидрата щавелевой кислоты, необходимая для приготовления 200 мл раствора с молярной концентрацией эквивалента 0,1500 моль/л? Каков титр этого раствора?
Решение:
1) М (Н2С2О4 · 2Н2О) = 126,07 г/моль (из справочной таблицы)
2) Z = 2, 1/ z = ½ = 0,5
3) m (Н2С2О4 · 2Н2О) = C (½Н2С2О4 · 2Н2О) · M (½Н2С2О4 · 2Н2О) · V (Н2С2О4)
m (½Н2С2О4 · 2Н2О) = 0,1500 моль/л · ½ · 126 г/моль · 0,2 л = 1,8900 г.
4) Т (½Н2С2О4 · 2Н2О) = m (½Н2С2О4 · 2Н2О) / V (Н2С2О4)
Т (½Н2С2О4 · 2Н2О) = 1,8900 г / 200 мл = 0,009450 г/мл
Ответ: m ((½Н2С2О4 · 2Н2О) = 1,8900 г.
Т (½Н2С2О4 · 2Н2О) = 0,009450 г/мл.
Задача.
Каковы титр и нормальная концентрация раствора серной кислоты, если на титрование 15,0 мл его затрачено 13,7 мл титрованного раствора гидроксида калия с молярной концентрацией 0,1304 моль/л?
Решение:
1) H2SO4 + 2 KOH → K2SO4 + 2 H2O
Z (H2SO4) = 2, 1/z = ½ = 0,5 Z
(KOH) = 1
По закону эквивалентов:
V (H2SO4 )/ V (KOH) = C (KOH) / C (½ H2SO4 )
C (½H2SO4) = 0,1304 моль/л · 13,7 мл / 15,0 мл = 0,1191 моль/л
2) Т(H2SO4) = С (½ H2SO4) · М(½ H2SO4) / 1000,
М (½ H2SO4) = ½ · 98,078 = 49, 039 г/моль
Т (H2SO4) = 0,1191 моль/л · 49,03 г/моль/1000 мл = 0,005836 г/мл
Ответ: C (½ H2SO4) = 0,1191 моль/л
Т (H2SO4) = 0,005836 г/мл
Практическая работа.
Определение кристаллизационной воды в кристаллогидратах (Определение кристаллизационной воды в хлориде бария).
Цель работы: Определение массовой доли кристаллизационной воды в кристаллогидрате 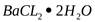 методом отгонки.
методом отгонки.
Сущность работы: Определение основано на разложении кристаллогидрата хлорида бария при нагревании при температуре 120-125°С с выделением воды:
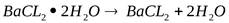
По убыли массы пробы, взятой для анализа, определяют массовую долю кристаллизационной воды в образце.
Оборудование и материалы :
1. Бюкс стеклянный для взвешивания
2. Свежеперекристаллизованный химически чистый 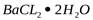 .
.
Выполнение работы:
В тщательно вымытый, высушенный и взвешенный, вместе с крышкой на аналитических весах бюкс, помещают 1,5 г свежеперекристаллизованный химически чистого 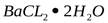 . Затем бюкс охлаждают в эксикаторе и, закрыв крышкой, взвешивают на аналитических весах. Затем бюкс снова взвешивают на аналитических весах и определяют точную массу навески, взятой для анализа. Открыв бюкс, помещают крышку сверху, повернув ее на ребро и выдерживают бюкс в сушильном шкафу при температуре 125° С два часа. Операцию повторяют до достижения постоянной массы. Как правило, одновременно проводят не менее двух параллельных опытов.
. Затем бюкс охлаждают в эксикаторе и, закрыв крышкой, взвешивают на аналитических весах. Затем бюкс снова взвешивают на аналитических весах и определяют точную массу навески, взятой для анализа. Открыв бюкс, помещают крышку сверху, повернув ее на ребро и выдерживают бюкс в сушильном шкафу при температуре 125° С два часа. Операцию повторяют до достижения постоянной массы. Как правило, одновременно проводят не менее двух параллельных опытов.
Результаты взвешиваний заносят в таблицу. Результаты взвешивания.
| Объект взвешивания | Масса, г. | ||||
| До высушивания | После высушивания | ||||
| Бюкс № 1 | Бюкс с веществом | 13,5269 | 13,3180 | 13,3066 | 13,3064 |
| Пустой бюкс | 12,0296 | 12,0296 | 12,0296 | 12,0296 | |
| Навеска | 1,4973 | - | - | 1,2768 | |
| Бюкс № 2 | Бюкс с веществом | 7,9499 | 7,7320 | 7,2777 | 7,2777 |
| Пустой бюкс | 6,4397 | 6,4397 | 6,4397 | 6,4397 | |
| Навеска | 1,5120 | - | - | 1,2880 |
И проводят расчет массовой доли кристаллизационной воды.
1. Рассчитывают массу воды.
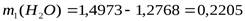
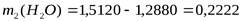
2. Рассчитываем массовую долю кристаллизационной воды.
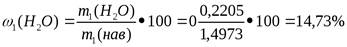
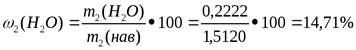
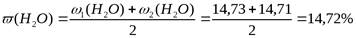
3. Сравниваем с теоретической величиной.
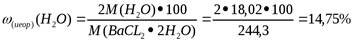
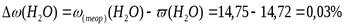
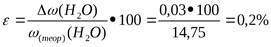
Контрольные вопросы .
В чем заключается сущность гравиметрического метода. Назовите его достоинства и недостатки.