Строение электронных оболочек атома.
-Главные частицы в атоме протоны, нейтроны, электроны.
-Ядро составляют нуклоны (нуклеус-ядро) - протоны и нейтроны.
-Изменение числа p + и n0 изучает физика, так как это ядерные процессы.
-Изменение числа p + это значит изменение порядкового номера,
значит, будет другой ХЭ (физика).
-Изменение числа n0 это значит изменение массового числа (относительной атомной массы), значит, будет изотоп ХЭ-та (физика).
-А вот строение электронных оболочек и изменение числа е– атомов имеют важную роль для химии, так как именно электроны обуславливают химические свойства веществ.
-Вращение электронов по орбиталям происходит не хаотично (как мошки вокруг светящейся лампочки), а упорядоченно.
Нильс Бор – основоположник атомной физики и другие учёные
доказали:
- электроны в атомах располагаются определенными слоями – оболочками и в определенном порядке.
Важнейшей характеристикой электрона на определенной орбитали является энергия его связи с ядром.
*Электроны в атоме притягиваются к ядру сильнее, другие слабее. *Объясняется это удаленностью электронов от ядра:
чем ближе электроны к ядру, тем больше связь их с ядром,
но меньше запас энергии - их сложнее оторвать.
Рассмотрим конкретные примеры:
- водород находится в 1 периоде, значит у атома Н один энергетический уровень (орбиталь) Н)
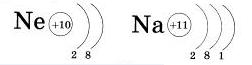
-бор находится во 2 периоде, значит у атома В два энергетических уровня (орбиталей) В)), так же С)) О)) Ne))
-магний находится в 3 периоде, значит у атома Mg))) три энергетических уровня и у Al))) Si))) S))) Сl))) Ar)))
Заполнение энергетических уровней электронами:
-вспомним, число электронов в атоме равно порядковому номеру №:
С - 6 О -8 Ne -10 Al -13 Si -14 S-16 Сl-17 Ar-18 и т.д.
Как они распределены по орбиталям?
Каждый ХЭ символизирует один электрон:
-значит на первом уровне два е–
- на втором 8 е–
-на третьем 8 е–
-на четвёртом 18 е–
А номер группы ХЭ в ПС - число электронов на внешнем энергетическом уровне (вэу).

Имея вышеизложенные сведения, можем составить электронные формулы 20 первых атомов ХЭ из ПС:
1.пишем знак ХЭ.
2.число протонов ядра - порядковый номер, пишем в кружочке со знаком +
3.чертим число дуг по номеру периода, то есть число энергетических уровней
4.вспоминаем, что число е– в атоме равно числу p + (опять порядковый №, так как атом электронейтрален)
5.распределяем их по орбиталям - пишем число е– под дугами.

-Энергетический уровень состоит из подуровней - орбиталей.
-Орбитали имеют свою форму:
*с меньшей энергией - сферическая орбиталь, обозначается s (эс)
*с большей энергией - гантелеобразная орбиталь, обозначается р (пэ)
Но на орбитали может быть не более двух электронов, а у нас на 2,3,4 энергетических уровнях больше двух е– .
Оказалось, что подуровень р(пэ) - орбиталь имеет
Подподуровни рх ру рz
и на каждой может поместиться по 2 е–
Итого, на s (эс)-орбитали 2 е–, на р(пэ)- орбитали 6 е–, всего-8.

Стрелочками показаны электроны, причём вращаются они в противоположных направлениях - по и против часовой стрелки.
Внешний энергетический уровень, завершенный, если на нём 8 электронов.
Запишем полную электронную формулу ХЭ с использованием знаний о форме электронных орбиталей.
1.Нумеруем энергетический уровень - по периоду ХЭ в ПС.
2.Пишем сначала сферическую s-орбиталь
3.Затем, если электронов больше р-орбиталь
4.Над знаком подуровня пишем число электронов.
| № эл-та | химический знак | Название элемента | Электронная формула |
| H | водород | 1s 1 | |
| He | гелий | 1s 2 | |
| II период | |||
| Li | литий | 1s 22s 1 | |
| Be | бериллий | 1s 22s 2 | |
| B | бор | 1s 22s 22p 1 | |
| C | углерод | 1s 22s 22p 2 | |
| N | азот | 1s 22s 22p 3 | |
| O | кислород | 1s 22s 22p 4 | |
| F | фтор | 1s 22s 22p 5 | |
| Ne | неон | 1s 22s 22p 6 | |
| III период | |||
| Na | натрий | 1s 22s 22p 63s 1 | |
| Mg | магний | 1s 22s 22p 63s 2 | |
| Al | алюминий | 1s 22s 22p 63s 23p1 | |
| Si | кремний | 1s 22s 22p 63s 23p2 | |
| P | фосфор | 1s 22s 22p 63s 23p3 | |
| S | сера | 1s 22s 22p 63s 23p4 | |
| Cl | хлор | 1s 22s 22p 63s 23p5 | |
| Ar | аргон | 1s 22s 22p 63s 23p6 | |
| IV период | |||
| K | калий | 1s 22s 22p 63s 23p64s 1 | |
| Ca | кальций | 1s 22s 22p 63s 23p64s 2 |
ХЭ-ты, имеющие сходное строение вэу (внешнего энергетического уровня) имеют схожие химические свойства, то что и изучает химия.
Дома: учить параграф 8 или этот конспект.