Примеры решения задач
Пример 1
Выразите состав полученного раствора через молярную концентрацию, молярную концентрацию эквивалентов, массовую долю и титр растворенного вещества, если 5,6 л SO2, измеренного при н. у., растворили в 25 л воды.
Р е ш е н и е
При растворении газа SO2 в воде происходит его химическое взаимодействие с водой с образованием сернистой кислоты:
SO2 + H2O = H2SO3.
Определяем количество растворенной H2SO3 в растворе.
Молярный объем любого газа при нормальных условиях равен
22,4 л/моль. В соответствии с уравнением реакции из 1 моль SO2 образуется
1 мольH2SO3, тогдаn(SO2) = n(H2SO3) = 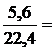 0,25 моль.
0,25 моль.
Считаем полученный раствор H2SO3 разбавленным и принимаем его плотность равной плотности воды, а объем раствора равным объему воды. Находим молярную концентрацию полученного раствора H2SO3:
См(H2SO3) = 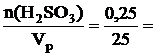 0,01 моль/л.
0,01 моль/л.
Число эквивалентности Z(H2SO3) равно 2.Рассчитываем молярную концентрацию эквивалентов Сэк(H2SO3) по формуле
Сэк(H2SO3) = Z ∙ См(H2SO3) = 0,01 ∙ 2 = 0,02 моль.
Определяем массу растворенной H2SO3 и массу раствора.
М(H2SO3) = 82 г/моль; m(H2SO3) = n(H2SO3) ∙ M(H2SO3) = 0,25 ∙ 82 = 20,5г; т.к. приняли 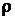 =
= 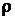 (Н2О) = 1 г/см3 = 1 000 г/л и Vp= V(H2O), то
(Н2О) = 1 г/см3 = 1 000 г/л и Vp= V(H2O), то
mp= 25 ∙ 1 000 = 25 000 г.
Определяем массовую долю (1) H2SO3 в растворе:
w (H2SO3) = 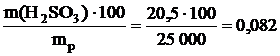 %.
%.
Титр раствора рассчитываем по формуле
Т(H2SO3) = 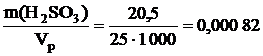 г/мл.
г/мл.
Ответ: См(H2SO3) = 0,01 моль/л; Сэк(H2SO3) = 0,02 моль/л;
w(H2SO3) = 0,082 %; Т(H2SO3) = 0,000 82 г/мл.
Пример 2
Определите массу кристаллогидрата хлорида железа (III) FeCl3 ∙ 6H2Oи массу воды, необходимые для приготовления 250г раствора с массовой долей хлорида железа (III) 15 %. Рассчитайте моляльность и молярную долю FeCl3 в полученном растворе.
Р е ш е н и е
Определяем массу безводного хлорида железа (III), необходимую для приготовления 250 г раствора с массовой долей FeCl3 15%:
w(FeCl3) = 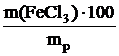 ,
,
откудаm(FeCl3) = 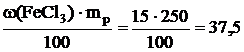 г.
г.
Исходя из того, что М (FeCl3 ∙ 6H2O) = 270,5 г/моль и М (FeCl3) =
= 162,5 г/моль, определяем массу кристаллогидрата хлорида железа (III), соответствующую найденной массе безводной соли:
270,5 г FeCl3 ∙ 6Н2О содержат 162,5 г FeCl3
х г FeCl3 · 6Н2О содержат 37,5 г FeCl3
х = m (FeCl3 ∙ 6H2O) = 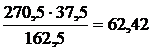 г.
г.
Определяем массу воды, необходимую для приготовления 250 г раствора FeCl3:
m(H2O) = mp – m(FeCl3·6Н2О) = 250 – 64,42 = 187,58 т.
Определяем массу воды, содержащуюся в 250 г раствора FeCl3:
m(H2O) = mp – m(FeCl3) = 250 – 37,5 = 212,5 г = 0,212 5 кг.
Находим моляльностьFeCl3 в полученном растворе:
Сm(FeCl3) = 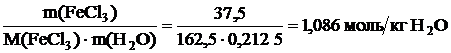
Рассчитываем молярную долю FeCl3 в полученном растворе:
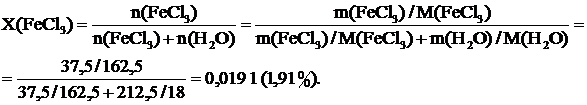 О т в е т: m (FeCl3 ∙ 6H2O) = 62,42 г; m(H2O) = 187,58 г;
О т в е т: m (FeCl3 ∙ 6H2O) = 62,42 г; m(H2O) = 187,58 г;
Сm(FeCl3) = 1,086 моль/кг Н2О; Х(FeCl3) = 1,91 %.
Пример 3
Выразите состав раствора H2SO4с массовой долей 60 % и плотностью 1,498 г/см3 через молярную концентрацию, молярную концентрацию эквивалентов (нормальность), моляльную концентрацию и титр.
Р е ш е н и е
Для расчета состава раствора с заданной массовой долей растворенного вещества В через молярность, нормальность, моляльность и титр можно воспользоваться пересчетными формулами, приведенными в прил. 1. Однако эти формулы запоминать не следует, а подобная справочная таблица не всегда имеется при решении задач. Покажем, что формулы пересчета можно легко вывести, используя расчетные формулы по определению состава раствора.
Выведем формулы расчета молярной концентрации вещества В См(В), молярной концентрации эквивалентов вещества В Сэк(В), моляльной концентрации вещества В Сm(B) и титра вещества В Т(В) через массовую долю вещества В в растворе w(В). Полученные формулы используем для определения состава раствора H2SO4 в соответствии с условием задачи.
w(B) = 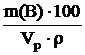 ;Cм(В) =
;Cм(В) = 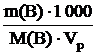 ,
,
где Vpвыражен в см3 (мл). Выражаем из формулы для расчета массовой доли вещества соотношение:
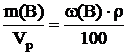 .
.
Полученное выражение подставляем в формулу для расчета молярной концентрации, получаем выражение:
См(В) = 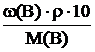 ,
,
Рассчитываем молярную концентрацию H2SO4 в растворе с массовой долей 60 %, учитывая, что М(H2SO4) = 98 г/моль:
См(H2SO4) = 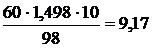 моль/л.
моль/л.
Молярную концентрацию эквивалентов H2SO4легко рассчитать, учитывая, чтоZ(H2SO4) = 2:
Сэк(H2SO4) = Z ∙ См(H2SO4) = 2 ∙ 9,17 = 18,34 моль/л.
Выведем формулу для расчета моляльной концентрации вещества В
Сm(B) = 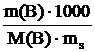 ,принимая, что масса растворителя –ms, г.
,принимая, что масса растворителя –ms, г.
w(В) = 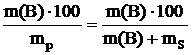 , учитывая, что масса раствора равна сумме масс растворенного вещества В и растворителя S. Из данной формулы выражаем массу растворенного вещества В:
, учитывая, что масса раствора равна сумме масс растворенного вещества В и растворителя S. Из данной формулы выражаем массу растворенного вещества В:
m(B) ∙ w(B) + mS ∙ w(B) = m(B) ∙ 100;
m(B) ∙ (100 – w(B)) = mS ∙ w(B),
откуда m(B) = 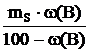 , полученное выражение подставляем в формулу для расчета Cm(B):
, полученное выражение подставляем в формулу для расчета Cm(B):
Cm(B) = 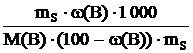 ,
,
откуда Cm(B) = 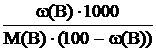 .
.
Рассчитываем моляльную концентрацию H2SO4 в растворе с массовой долей 60 %:
Cm(H2SO4) = 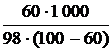 = 15,31 моль/кг Н2О.
= 15,31 моль/кг Н2О.
Выводим формулу для расчета титра вещества В:
Т(В) = 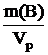 , где Vp выражен в см3 (мл).
, где Vp выражен в см3 (мл).
Соотношение  ,
,
поэтому
Т(В) = 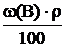
Рассчитываем титр H2SO4 в растворе с массовой долей 60 %:
Т(H2SO4) = 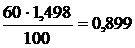 г/мл.
г/мл.
Ответ: См(H2SO4) = 9,17 моль/л; Сэк(H2SO4) = 18,34 моль экв/л;
Сm(H2SO4) = 15,31 моль/кг Н2О; Т(H2SO4) = 0,899 г/мл.
Эквиваленты и эквивалентные массы
Количественный подход к изучению химических явлений и установление закона постоянства состава показали, что вещества вступают во взаимодействие в определенных соотношениях масс, что привело к введению такого важного понятия, как «эквивалент», и установлению закона эквивалентов: массы взаимодействующих без остатка веществ соотносятся как их эквивалентные массы. Математическое выражение закона эквивалентов:
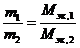 ,
,
где Мэк,1 и Мэк,2- эквивалентные массы.
Эквивалент - это частица или часть частицы, которая соединяется (взаимодействует) с одним атомом или ионом водорода.
Из этого определения видно, что понятие «эквивалент» относится к конкретной химической реакции; если его относят к атому в химическом соединении, то имеют в виду реакцию образования этого соединения из соответствующего простого вещества и называют эквивалентом элемента в соединении.
В одном атоме, одной молекуле или формульной единице вещества (В) может содержаться Zэквивалентов этого вещества. Число Zназывают эквивалентным числом (или показателем эквивалентности). Обратная величина этого числа называется фактором эквивалентности. Фактор эквивалентности (f) - доля частицы, составляющая эквивалент.
Относительная масса эквивалента называется эквивалентной массой, а масса одного моля эквивалентов, выраженная в граммах, называется молярной эквивалентной массой; она обозначается Мэк, единица измерения – моль эк/г, она численно равна относительной молекулярной массе эквивалента.
Пример 4. Определить эквивалент, эквивалентную массу и молярную массу эквивалента кислорода в молекуле воды.
Решение. Такая формулировка вопроса предполагает реакцию образования воды из кислорода и водорода H2 + ½O2 = Н2О, в которой с 1 атомом водорода соединяется ½ атомов кислорода. Следовательно, Z(О) = 2. Атомная масса кислорода равна 16. Эквивалентом кислорода является ½ его атома, эквивалентная масса равна 8, а молярная масса эквивалента равна 8 г/ моль.
Эквиваленты одних и тех же элементов в различных химических соединениях могут различаться, т.к. величина эквивалента зависит от характера превращения, претерпеваемого им. Так, в соединении SO2 эквивалентная масса серы равна 8 г/моль, что составляет 1/4 от атомной массы, а в соединении SO3- 5,3 г/моль, что составляет 1/6 от атомной массы серы. Эквивалентное число серы в этих оксидах равно 4 и 6, т.е. оно равно степени окисления (стехиометрической валентности) серы в этих соединениях. Таким образом,относительная эквивалентная массаи численно равная ей молярная масса элемента в соединении вычисляется по формуле:
Мэк (элемента) =  , (1.7)
, (1.7)
где А - атомная масса, w- степень окисления элемента в данном соединении.
Например, Z(Mn) в соединении KMnO4 составляет 7(w = +7), а Мэк (Mn) =  = 7,85 г/моль; в соединении Mn2O3Z = 3 и поэтому Мэк (Mn)=
= 7,85 г/моль; в соединении Mn2O3Z = 3 и поэтому Мэк (Mn)= 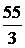 = 18,3 г/моль.
= 18,3 г/моль.
Эквивалентная масса вещества имеет различные значения в зависимости от того, в какойхимической реакции участвует это вещество. При расчете эквивалентных масс можно пользоваться следующими правилами и формулами.
1. Эквивалентная масса кислоты в реакциях замещения ионов водорода равна:
Мэк кислоты = 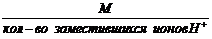
2. Эквивалентная масса основания в реакции замещения гидроксид-ионов равна:
Мэкоснования = 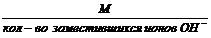
Пример 5. Определить эквивалентную массу H2SO4 в реакциях:
1) H2SO4 + KOH = KHSO4 + H2O
2) H2SO4 + 2KOH = K2SO4 + 2H2O
Решение. В реакции 1 замещён один ион водорода, следовательно, эквивалентное число серной кислоты Z(H2SO4) = 1, Мэк(H2SO4) = 98 г/моль эк. В реакции 2 заместились оба иона водорода, следовательно, эквивалентное число Z(H2SO4) = 2, а Mэк(H2SO4) = 49 г/моль эк.
Пример 6. Определить эквивалентную массу гидроксида висмута в реакциях:
1) Bi(OH)3 + HCl = Bi(OH)2Cl + H2O
2) Bi(OH)3 + 3HCl = BiCl3 + H2O
Решение. 1)Z(Bi(OH)3) = 1, а Mэк(Bi(OH)3) = 260 г/мольэк, т.к. изтрехгидроксид-ионовзаместилсяодин; 2) Z(Bi(OH)3) = 3, a Mэк(Bi(OH)3) = 260:3 = 86,3 г/мольэк, т.к. заместилисьвсетриионаОН-).
3.Эквивалентная масса соли в реакциях полного замещения катиона или аниона равна:
Мэк. соли = 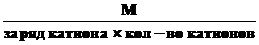
или Мэк соли= 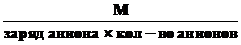
Например. в сульфате алюминия Al2(SO4)3произведение заряда катиона на их число равно 3×2 = 6. Но эквивалентное число соединения в реакции может быть меньше (неполное замещение катионов) или больше (комплексообразование). Если, например, это соединение участвует во взаимодействии
Al2(SO4)3 + 12KOH = 2K3[Al(OH)6] + 3K2SO4,
то при этом три сульфат-аниона с суммарным зарядом 6 замещаются двенадцатью гидроксид-ионами ОН-, следовательно, в этой реакцииZ(Al2(SO4)3) = 12.
4.Эквивалентная масса оксида в реакциях полного замещения равна
Мэк оксида = 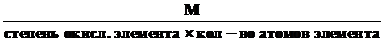
Например, Z(Fe2O3) = 3×2 = 6, Мэк = М(Fe2O3)= 160:6 = 26,6 г/мольэк. Но в реакции
Fe2O3 + 4HCl = 2FeOHCl2 + H2O
Z(Fe2O3) = 4, Мэк(Fe2O3) = 160:4 = 40 г/моль эк, т.к. одна формульная единица Fe2O3 взаимодействует с четырьмя эквивалентами HCl.
При решении задач, связанных с газообразными веществами, целесообразно пользоваться значением эквивалентного объема. Это объем, занимаемый одним молем эквивалентов газообразного вещества. Для водорода при н.у. этот объем равен 11,2 л/моль эк (так как Мэк(Н) = 1г/моль эк), а для кислорода – 5,6 л/моль эк (так как Мэк(О) = 8 г/моль эк).
Пример 7. На восстановление 1,80 г оксида металла израсходовано 883 мл водорода (н.у.). Вычислить эквивалентные массы оксида и металла.
Решение. Согласно закону эквивалентов, массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам):
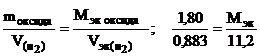
Отсюда
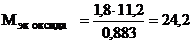 (г/моль),
(г/моль), 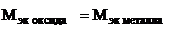 +
+ 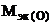 ,
,
следовательно
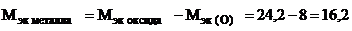 г/моль эк.
г/моль эк.
Пример 8 Вычислить эквивалентную массу цинка, если 1,168 г этого металла вытеснили из кислоты 438 мл Н2 (Т = 17°С и Р = 750 мм рт. ст.).
Решение. 1) По уравнениюКлапейрона–Менделеева вычисляем массу водорода:
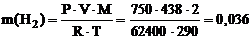 г
г
Согласно закону эквивалентов
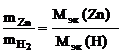 ,
,
следовательно
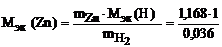 = 32,6 г/моль эк.
= 32,6 г/моль эк.
Многовариантные задачи
Задача 1
Определите, изменяется ли химическая природа вещества В (табл. 1) при его растворении в воде. Напишите соответствующее уравнение реакции взаимодействия вещества В с водой с образованием нового вещества А, если реакция протекает.
Выразите состав полученного раствора вещества В или вещества А через молярную концентрацию, молярную концентрацию эквивалентов, массовую долю и титр, если в воде объемом V(H2O) растворили твердое вещество В массой m(B) или газ В объемом V(B), измеренным при н. у. Считайте плотность полученного раствора равным плотности воды.
Таблица 1
Варианты заданий к задаче 1
| Вариант | В | m(B), г V(B), л | V(H2O), л |
| CO2 (газ) | 0,224 л | ||
| NaOH (тв) | 2,00 г | ||
| SO2 (газ) | 10,08 л | ||
| HCl (газ) | 5,60 л | ||
| Ca (тв) | 1,00 г | ||
| H2S (газ) | 4,48 л | ||
| CrO3 (тв) | 27,00 г | ||
| HBr (газ) | 2,80 л | ||
| Na (тв) | 3,60 г | ||
| KOH (тв) | 4,54 г | ||
| B2O3 (тв) | 11,42 г | ||
| H2C2O4 (тв) | 1,86 г | ||
| SO3 (газ) | 3,40 л | ||
| H3BO3 (тв) | 5,98 г | ||
| CaO (тв) | 2,60 г | ||
| TlOH (тв) | 26,52 г | ||
| HI (газ) | 10,08 л | ||
| Na2O (тв) | 20,46 г | ||
| BaO (тв) | 63,95 г | ||
| HBr (газ) | 4,95 л | ||
| Tl2O (тв) | 23,74 г | ||
| Li (тв) | 1,40 г | ||
| H2SeO4 (тв) | 36,50 г | ||
| LiOH (тв) | 5,40 г | ||
| HIO3 (тв) | 36,96 г | ||
| CO2 (газ) | 1,12 л | ||
| As2O5 (тв) | 15,18 г | ||
| HCl (газ) | 7,24 л | ||
| SrO (тв) | 25,17 г | ||
| H2SeO3 (тв) | 14,26 г | ||
Задача 2
Определите искомую величину Х и массу воды m(H2O), необходимые для приготовления раствора вещества В массой mpи массовой долей w по заданным величинам в соответствии с вариантом задания (табл. 2), где m(B) – масса вещества В. Рассчитайте моляльную концентрацию и молярную долю вещества В в полученном растворе.
Таблица 2
Варианты заданий к задаче 2
| Вариант | В | w, % | mp, г | m(B), г |
| CdI2 | Х | |||
| NaCl | Х | |||
| KOH | Х | |||
| MgSO4 ∙ 7H2O | Х | |||
| Na2SO4 ∙ 7H2O | Х | |||
| NiCl2 ∙ 6H2O | Х | |||
| Na2CO3 | Х | |||
| Ba(OH)2 ∙ 8H2O | Х | |||
| NH4Cl | Х | |||
| NaBr | Х | |||
| BaCl2 ∙ 2H2O | Х | |||
| LiNO3 | Х | |||
| KCl | Х | |||
| MnCl2 ∙ 4H2O | Х | |||
| SbCl3 | Х | |||
| LiOH | Х | |||
| ZnSO4 ∙ 7H2O | Х | |||
| CdI2 | Х | |||
| AlCl3 ∙ 6H2O | Х | |||
| LiBr | Х | |||
| KNO3 | Х | |||
| NH4NO3 | Х | |||
| Al2(SO4)3 ∙ 18H2O | Х | |||
| LiCl | Х | |||
| CuSO4 ∙ 5H2O | Х | |||
| CaCl2 ∙ 6H2O | Х | |||
| NaBr ∙ 2H2O | Х | |||
| KI | Х | |||
| K2SO4 | Х | |||
| NaF | Х | |||
Задача 3
Выразите состав раствора вещества В с заданной массовой долей w и плотностью  (табл. 3) через молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию и титр.
(табл. 3) через молярную концентрацию, молярную концентрацию эквивалентов, моляльную концентрацию и титр.
Таблица 3
Варианты заданий к задаче 3
| Вариант | В | w, % |  , г/см3 , г/см3
|
| HNO3 | 9,26 | 1,050 | |
| H2SO4 | 92,00 | 1,824 | |
| HCl | 8,49 | 1,040 | |
| H3PO4 | 97,00 | 1,831 | |
| HСlO4 | 16,00 | 1,100 | |
| CH3COOH | 23,00 | 1,030 | |
| KOH | 10,00 | 1,090 | |
| NaOH | 50,50 | 1,530 | |
| NH4OH | 11,00 | 0,954 | |
| Na2CO3 | 17,70 | 1,190 | |
| HNO3 | 66,97 | 1,400 | |
| H2SO4 | 54,00 | 1,435 | |
| HCl | 26,20 | 1,130 | |
| H3PO4 | 42,00 | 1,270 | |
| HСlO4 | 31,00 | 1,215 | |
| CH3COOH | 8,00 | 1,010 | |
| KOH | 39,00 | 1,385 | |
| NaOH | 6,00 | 1,065 | |
| NH4OH | 30,00 | 0,892 | |
| Na2CO3 | 11,60 | 1,12 | |
| HNO3 | 45,27 | 1,280 | |
| H2SO4 | 10,56 | 1,070 | |
| HCl | 40,00 | 1,198 | |
| H3PO4 | 4,00 | 1,020 | |
| HСlO4 | 63,00 | 1,580 | |
| CH3COOH | 98,00 | 1,055 | |
| KOH | 52,05 | 1,535 | |
| NaOH | 32,00 | 1,349 | |
| NH4OH | 21,50 | 0,918 | |
| Na2CO3 | 4,5 | 1,045 |
Задача 4. В предложенной реакции определить эквивалент, эквивалентную массу и молярную массу эквивалента для выделенных красным цветом веществ и элементов.
Варианты заданий к задаче 4
1. FеСl3 + Н2О = FеОНСl2+ НСl
2. КМnО4 + Аl + 2Н2О = МnО2 + К[Аl(ОН)4]
3. Аl2(SО4)3+ 2КОН = 2АlОНSО4 + К2SО4
4. 2КМnО4 + 16НСl = 2МnСl2 + 5Сl2 + 2КСl + 8Н2О
5. СаСО3 + Н3РО4 = СаНРО4 + СО2 + Н2О
6. N2+ 5О3 = N2О5 + 5О2
7. Са3(РО4)2+ Н2SО4 = 2СаНРО4 + СаSО4
8. Н2S + 4Сl2 + 4Н2О = Н2SО4 + 8НСl
9. Са3(РО4)2 + 6Н2SО4 = 3Са(НSО4)2+ 2Н3РО4
10.КМnО4 + Аl+ 2Н2О = МnО2 + К[Аl(ОН)4]
11. FеСl3 + Н2О = FеОНСl2+ НСl
12.N2О+ 2О2 = N2О5
13. СаСО3 + Н3РО4 = СаНРО4 + СО2 + Н2О
14. 2КМnО4 + 16НСl = 2МnСl2 + 5Сl2 + 2КСl + 8Н2О
15. Аl2(SО4)3+ 2КОН = 2АlОНSО4 + К2SО4
16. Н2S + 4Сl2 + 4Н2О = Н2SО4 + 8НСl
17. К3РО4 + 3Н2SО4 = 3КНSО4 + Н3РО4
18. 2СrО3 + 12НСl = 2СrСl3+ 3Сl2 +6Н2О
19. Fе2(SО4)3+ 2Н2О = 2FеОНSО4 + Н2SО4
20. Н2SО3 + 2Н2S = S + 3Н2О
21. Са3(РО4)2+ Н2SО4 = 2СаНРО4 + СаSО4
22. Н2S + 4Сl2 + 4Н2О = Н2SО4+ 8НСl
23. Сr2(SО4)3+ Н2О = 2СrОНSО4 + Н2SО4
24. 2Н2S + Н2SО3 = 3S + 3Н2О
25. 2АlОНSО4+ Н2SО4 = Аl2(SО4)3 + 2Н2О
26. 4NН3+ 5О2 = 4NО+ 6Н2О
27. Fе(ОН)3+ НСl = FеОНСl2+ 2Н2О
28. N2 + 2О2 = 2NО2
29. СаСО3 + Н3РО4= СаНРО4 + СО2 + Н2О
30.4NН3 + 7О2 = 4NО2 + 6Н2О
31. СаСl2+ Н2SО4 = Са(НSО4)2 + 2НСl
32.2Н2S + О2 = S + 2Н2О
33. Са3(РО4)2+ Н2SО4 = 2СаНРО4 + СаSО4
34.4NН3 + 4О2 = 2N2О+ 6Н2О
35. Fе(ОН)3+ Н2SО4 = FеОНSО4+ Н2О
36. Н2S + 4Сl2 + 4Н2О = Н2SО4+ 8НСl
37. Са3(РО4)2+ 2Н2SО4 = Са(Н2РО4)2 + 2СаSО4
38.4NН3 + 3О2 = 2N2 + 6Н2О
39. Аl(ОН)3+ НСl = Аl(ОН)2Сl+ Н2О
40. Н2S + 2О2 = SО3 + Н2О
Задача 5. Используйте закон эквивалентов!
1. 0,075 г металла вытесняет из раствора соли никеля 0,183 г никеля, а из раствора кислоты – 70 мл водорода, измеренного при нормальных условиях. Определите молярные массы эквивалентов металла и никеля. Ответ: 29,35 г/моль
2. При сгорании трёхвалентного металла в количестве 23,48 г было получено 44,40 г его оксида. Какой металл был сожжен? Определите массу оксида. Ответ: Al2O3; 17 г/моль.
3. Определите молярные массы эквивалентов кислот и гидроксидов в реакциях:
H2SO4 + 2NaOH = Na2SO4 + 2H2O Ответ: 49 г/моль
2H3PO4 + Ca(OH)2 = Ca(H2PO4)2 + 2H2O Ответ: 98 г/моль
Al(OH)3+ 3NaCl = AlCl3 + 3NaOH Ответ: = 26 г/моль
Zn(OH)2+ NaCl = ZnOHCl + NaOH Ответ: 99,4 г/моль
4. На реакцию с 13,61 гдигидрофосфата калия израсходовано 5,61 г гидроксида калия. Вычислите молярную массу эквивалента дигидрофосфата калия и напишите уравнения реакции. Ответ: 136,1 г/моль
5. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла (МЭ(Ме)). Ответ: 15 г/моль.
6. В какой массе Са(ОН)2 содержится столько же эквивалентов, сколько в 312г А1(ОН)3? Ответ: 444г.
7. Вычислите абсолютную массу молекулы серной кислоты в граммах. Ответ: 1,63* 10-22
8. На восстановление 3,6 г оксида двухвалентного металла израсходовано 1,7 л водорода (н.у.). Вычислить молярные массы эквивалента оксида и металла. Ответ: 15,72 г.
9. Объемное содержание углекислого газа в воздухе составляет 0,03% (н.у.). Найти количество (моль) и массу (г) СО2, содержащегося в 0,5 м3 воздуха. Ответ: 0,295 г.
10. Масса колбы вместимостью 750 мл, наполненной при 27°С кислородом, равна 83,3 г. Масса пустой колбы составляет 82,1 г. Определить давление кислорода в колбе. Ответ: 124,65 кПа.
11. При сгорании 5,00 г трехвалентного металла образовалось 9,45 г его оксида. Определите молярную массу эквивалента этого металла и назовите металл. Ответ: 27 г.
12. 0,978 г щелочного металла реагирует с 0,200 г кислорода и с 3,17 г галогена. Определите эквивалент галогена и назовите его. Ответ: галоген – I.
13. Чему равен эквивалент щелочноземельного металла и его оксида, если известно, что 0,608 г металла вытесняют из раствора соляной кислоты 0,560 л водорода (н.у.)? Определите металл. Ответ: металл – Mg.
14. 0,200 г двухвалентного металла вытеснили 197 см3 водорода, который был собран под водой и измерен при 20ºС и 780 ммHg. Давление насыщенных паров воды при этих условиях составляет 17,4 ммHg. Определите, какой это металл. Ответ: металл – Mg.
15. 3,16 г перманганата калия взаимодействуют с концентрированной соляной кислотой. Образующийся хлор пропустили в раствор иодида калия. Сколько граммов иода выделилось, если общий выход реакций составил 80 %? Ответ: 10,2 г.
16. Определите эквивалент и эквивалентные массы элементов в соединениях с водородом: H2O, HCl, PH3. Ответ: 8 г/моль, 35,5 г/моль, 10,3 г/моль.
17. Определите эквивалентные массы следующих соединений: CO2, H2SO4, Cu(OH)2, MgCl2. Ответ: 11 г/моль, 49 г/моль, 49 г/моль, 47,5 г/моль.
18. На нейтрализацию кислоты массой 2,18 г израсходовано KOH массой 2,49 г. Определите эквивалентную массу кислоты. Ответ: 49 г/моль.
19. Определите массу металла, вступившего в реакцию с кислотой, если при этом выделился водород объёмом 260 мл при нормальных условиях. Эквивалентная масса металла mэ(Ме) = 9 г/моль. Ответ: 0,2 г.
20. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла. Ответ: 15 г/моль.
21. При взаимодействии магния с кислородом образуется оксид магния. Определите массу магния, необходимую для реакции с кислородом массой 64 г, а также массу образующегося при этом оксида. Ответ: m (Мg) = 96 г, m (MgO) = 160г.
22. Чему равны массы цинка и серы, необходимые для получения сульфида цинка массой 485 г? Ответ: m (MgO) = 325 г, m (S) = 160 г.
23. Определите массу хлорида калия, образующегося при взаимодействии хлористого водорода массой 219 г с раствором, содержащим гидроксид калия массой 224 г. Ответ: 298 г.
24. При 25°С и давлении 745 мм Т. Ст. некотороеколичество газа занимает объем 152 мл. Вычислить, какой объем займет это же количество газа при нормальных условиях. Ответ: 136,5 мл.
25. Чему равны значения а) относительной плотности хлора по воздуху, б) массы 1 л хлора (при н.у.), в) объема 1 л хлора (при н.у.). Ответ: а) 2,45; б) 3,17 г; в) 0,3 л.
26. При растворении металла массой 0,0548 г в избытке раствора кислоты выделялся водород объемом 50,4 мл (н.у.). Вычислите значение молярной массы эквивалента металла. Ответ: 12,17 г/моль.
27. Вычислить эквивалент и молярную массу эквивалента ортофосфорной кислоты в реакциях: а) с магнием, б) с гидроксидом калия, если при этом образуется кислая соль K2HPO4. Ответ: а) 32,67 г/моль; б) 49 г/моль.
28. При окислении металла массой 8,43 г образовался оксид массой 9,63 г. Вычислите значения молярных масс эквивалентов металла и его оксида. Ответ: 64,2 г/экв.
29. Вычислите значения относительной атомной массы и молярной массы эквивалента некоторого элемента, зная, что массовая доля данного элемента в его оксиде составляет 46,74 % и что на один атом его в оксиде приходится два атома кислорода. Ответ: 28,08 г/моль.
30. Масса 0,327 ·10-3 м3 газа, при 13 оС и давлении 1,04 ·105 Па равна 0,828 ·10-3 кг. Вычислить молярную массу газа. Ответ: 57,8 * 10-3 кг/моль.