Соединения хрома
Оксид хрома (II) и гидроксид хрома (II) имеют основной характер.
Cr(OH)2 + 2HCl → CrCl2 + 2H2O
Соединения хрома (II) — сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.
2CrCl2 + 2HCl → 2CrCl3 + H2
4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
Оксид хрома (III) Cr2O3 – зелёный, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия и аммония:
2Cr(OH)3 –t°→ Cr2O3 + 3H2O
4K2Cr2O7 –t°→ 2Cr2O3 + 4K2CrO4 + 3O2
(NH4)2Cr2O7 –t°→ Cr2O3 + N2+ 4H2O (реакция «вулканчик»)
Амфотерный оксид. При сплавлении Cr2O3 со щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
Cr2O3 + 2NaOH → 2NaCrO2 + H2O
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
При сплавлении со смесью щёлочи и окислителя получают соединения хрома в степени окисления (+6):
Cr2O3 + 4KOH + KClO3 → 2K2CrO4+ KCl + 2H2O
Гидроксид хрома (III) Сr(ОН)3 . Амфотерный гидроксид. Серо-зеленый, разлагается при нагревании, теряя воду и образуя зеленый метагидроксид СrО(ОН). Не растворяется в воде. Из раствора осаждается в виде серо-голубого и голубовато-зеленого гидрата. Реагирует с кислотами и щелочами, не взаимодействует с гидратом аммиака.
Обладает амфотерными свойствами — растворяется как в кислотах, так и в щелочах:
2Cr(OH)3 + 3H2SO4 → Cr2(SO4)3 + 6H2O Сr(ОН)3 + ЗН+ = Сr3+ + 3H2O
Cr(OH)3 + KOH → K[Cr(OH)4], Сr(ОН)3 + ЗОН— (конц.) = [Сr(ОН)6]3-
Cr(OH)3 + KOH → KCrO2+2H2O Сr(ОН)3 + МОН = МСrO2(зел.) + 2Н2O (300—400 °С, М = Li, Na)
Сr(ОН)3 →(120oC –H2O) СrO(ОН) →(430-10000С –H2O) Cr2O3
2Сr(ОН)3 + 4NаОН(конц.) + ЗН2O2(конц.) =2Na2СrO4 + 8Н20
Получение: осаждение гидратом аммиака из раствора солей хрома(Ш):
Сr3+ + 3(NH3 Н2O) = Сr(ОН)3↓ + ЗNН4+
Cr2(SO4)3 + 6NaOH → 2Cr(OH)3 ↓+ 3Na2SO4 (в избытке щелочи — осадок растворяется)
Соли хрома (III) имеют фиолетовую или тёмно-зелёную окраску. По химическим свойствам напоминают бесцветные соли алюминия.
Соединения Cr (III) могут проявлять и окислительные, и восстановительные свойства:
Zn + 2Cr+3Cl3 → 2Cr+2Cl2 + ZnCl2
2Cr+3Cl3 + 16NaOH + 3Br2 → 6NaBr + 6NaCl + 8H2O + 2Na2Cr+6O4
Соединения шестивалентного хрома
Оксид хрома (VI) CrO3 — ярко-красные кристаллы, растворимые в воде.
Получают из хромата (или дихромата) калия и H2SO4(конц.).
K2CrO4 + H2SO4 → CrO3 + K2SO4 + H2O
K2Cr2O7 + H2SO4 → 2CrO3 + K2SO4 + H2O
CrO3 — кислотный оксид, со щелочами образует жёлтые хроматы CrO42-:
CrO3 + 2KOH → K2CrO4 + H2O
В кислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
В щелочной среде эта реакция протекает в обратном направлении:
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
Дихромат калия – окислитель в кислой среде:
К2Сr2O7 + 4H2SO4 + 3Na2SO3 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O
K2Cr2O7 + 4H2SO4 + 3NaNO2 = Cr2(SO4)3 + 3NaNO3 + K2SO4 + 4H2O
K2Cr2O7 + 7H2SO4 + 6KI = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
K2Cr2O7 + 7H2SO4 + 6FeSO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
Хромат калия К2 CrО4. Оксосоль. Желтый, негигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде (желтая окраска раствора отвечает иону СrO42-), незначительно гидролизуется по аниону. В кислотной среде переходит в К2Cr2O7. Окислитель (более слабый, чем К2Cr2O7). Вступает в реакции ионного обмена.
Качественная реакция на ион CrO42- — выпадение желтого осадка хромата бария, разлагающегося в сильнокислотной среде. Применяется как протрава при крашении тканей, дубитель кож, селективный окислитель, реактив в аналитической химии.
Уравнения важнейших реакций:
2K2CrO4+H2 SO4(30%)=K2Cr2O7 +K2SO4 +H2O
2K2CrO4(т)+16HCl(конц.,гор.) =2CrCl3+3Cl2↑+8H2O+4KCl
2K2CrO4+2H2O+3H2S=2Cr(OH)3↓+3S↓+4KOH
2K2CrO4+8H2O+3K2S=2K[Сr(ОН)6]+3S↓+4KOH
2K2CrO4+2AgNO3=KNO3+Ag2CrO4(красн.)↓
Качественная реакция:
К2СгO4 + ВаСl2 = 2КСl + ВаCrO4↓
2ВаСrO4(т)+ 2НСl (разб.) = ВаСr2O7(p)+ ВаС12 + Н2O
Получение: спекание хромита с поташом на воздухе:
4(Сr2Fe‖‖)O4 + 8К2CO3 + 7O2 = 8К2СrO4 + 2Fе2O3 + 8СO2 (1000 °С)
Дихромат калия K2Cr2O7. Оксосоль. Техническое название хромпик. Оранжево-красный, негигроскопичный. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (оранжевая окраска раствора отвечает иону Сr2O72-). В щелочной среде образует К2CrO4. Типичный окислитель в растворе и при сплавлении. Вступает в реакции ионного обмена.
Качественные реакции — синее окрашивание эфирного раствора в присутствии Н2O2, синее окрашивание водного раствора при действии атомарного водорода.
Применяется как дубитель кож, протрава при крашении тканей, компонент пиротехнических составов, реагент в аналитической химии, ингибитор коррозии металлов, в смеси с Н2SO4 (конц.) — для мытья химической посуды.
Уравнения важнейших реакций:
4К2Cr2O7=4K2CrO4+2Cr2O3+3O2 (500-600o C)
K2Cr2O7(т)+14HCl (конц) =2CrCl3+3Cl2↑+7H2O+2KCl (кипячение)
K2Cr2O7(т)+2H2SO4(96%) ⇌2KHSO4+2CrO3+H2O (“хромовая смесь”)
K2Cr2O7+KOH (конц) =H2O+2K2CrO4
Cr2O72- +14H+ +6I— =2Cr3+ +3I2↓+7H2O
Cr2O72- +2H+ +3SO2(г)=2Cr3+ +3SO42- +H2O
Cr2O72- +H2O +3H2S(г)=3S↓+2OH— +2Cr2(OH)3↓
Cr2O72- (конц)+2Ag+(разб.) =Ag2Cr2O7 (т. красный)↓
Cr2O72- (разб.) +H2O +Pb2+=2H+ + 2PbCrO4 (красный)↓
K2Cr2O7(т) +6HCl+8H0(Zn)=2CrCl2(син)+7H2O+2KCl
Получение: обработка К2СrO4 серной кислотой:
2К2СrO4 + Н2SO4 (30%) = К2Cr2O7 + К2SO4 + Н2O

Марганец — элемент 4-го периода и VII B-группы Периодической системы, порядковый номер 25. Электронная формула атома [18Аr]Зd54s2; характерные степени окисления + VII,+ VI, +IV, +III, +II и 0.
Шкала степеней окисления марганца:
+7 — Mn2O7 , MnO4— ,HMnO4,KMnO4
+ 6 — MnO42-, K2MnO4
+4 — MnO2, Mn(SO4)2 ,MnF4,K3[MnF6]
+3 — Mn2O3, MnO(OH),Mn2(SO4)3 ,MnF, K3[MnF6]
+ 2 — Mn2+ , MnO, Mn(OH)2, MnSO4 ,MnCl2
0 — Mn
По электроотрицательности (1,60) марганец занимает промежуточное положение между типичными металлами (Na, К, Са, Мg) и неметаллами (F, O,N, Cl). Соединения Мn‖‖ — оксид и гидроксид — проявляют основные свойства, соединения Мn‖‖‖ и Мn IV — амфотерные свойства, для соединений МnVI и МnVII характерно почти полное преобладание кислотных свойств. Марганец образует многочисленные соли и бинарные соединения.
В природе — четырнадцатый по химической распространенности элемент (восьмой среди металлов; второй, после железа, тяжелый металл).
Марганец Мn. Серебристо-белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним.
При нагревании сгорает в кислороде воздуха, реагирует с хлором и серой:
Mn →(O2, до450oC) MnO2 →(O2, до 800oC) Mn2O3
Mn→ MnO+(MnIIMn2 II)O4 “окалина “ (O2, выше 800oC)
Mn+Cl2→MnCl2, (200oC) Mn+S→ MnS (до1580oC)
В ряду напряжений марганец стоит левее водорода, из разбавленных кислот НCl и Н2SO4 вытесняет водород:
Мn (порошок) + 2Н+ = Мn2+ + Н2↑
Взаимодействует с кислотами-окислителями при нагревании, также образуя соли марганца (II):
Мn + 2Н2SO4 (конц.) = МnSO4 + SO2↑+ 2Н2O
3Мn + 8HNO3 (разб.) = 3Мn(NO3)2 + 2NO↑ + 4Н2O
Получение марганца в промышленности — восстановление пиролюзита МnO2 или гаусманита (МnIIMnIII)O4 коксом или алюминием:
МnO2 + С (кокс) = Мn + СO2 (600 °С)
3(МnII MnIII)O4 + 8Аl = 9 Мn + 4А12O3(700-900 °С)
Наиболее чистый марганец выделяют электролизом раствора из солей марганца (П), например:
2MnSO4+2H2O→ 2Mn↓+ O2↑+2H2SO4 (40oC, эликтролиз)
Промышленно важен сплав с железом — ферромарганец (> 70 % Мn), его получают восстановлением оксидных руд марганца и железа.
Применяется марганец для изготовления специальных и тугоплавких сплавов, зеркального чугуна и марганцевых твердых сталей, в качестве катализатора в органическом синтезе.
Оксид марганца (IV) МnO2. Черный, с коричневым оттенком, при нагревании разлагается. Из раствора осаждается в виде черного гидрата МnO2 nН2O. Не проявляет амфотерных свойств в силу малой реакционной способности по отношению к воде, разбавленным кислотам НCl и Н2SO4, азотной кислоте и щелочам в растворе. Типичный окислитель в растворе и расплаве, менее характерны свойства восстановителя.
Применяется для промышленного производства марганца, как деполяризатор в «батарейках» (сухих гальванических элементах), компонент минеральных пигментов, осветлитель стекла.
Уравнения важнейших реакций:
4МnO2 = 2Мn2O3 + O2 (530-585 °С)
2МnO2 + 2Н2SO4(конц.) = МnSO4 + O2↑ + 2Н2O (кипячение)
МnO2 + 4НС1(конц.) = МnС12 + С12↑ + 2Н2O
МnO2 + Н2SO4 (гор.) + КNO2 = МnSO4 + КNO3 + Н2O
МnO2 + 2Н2SO4 + 2FeSO4 = МnSO4 + Fе2(SO4)3 + 2Н2O
МnO2 + 2КОН + КNO3 = К2MnO4 + KNO2 + Н2O (350-450 °С)
ЗМnO2 + ЗК2CO3 + КС1O3 = ЗК2MnO4+ КС1 + ЗCO2 (400 °С)
В природе самое распространенное соединение марганца — минерал пиролюзит
Манганат калия К2MnO4. Оксосоль. Темно-зеленый, плавится под избыточным давлением О2. В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону МnO42-. Медленно разлагается при разбавлении раствора водой, быстро — при подкислении. Проявляет окислительно-восстановительные свойства.
Качественная реакция — появление фиолетовой окраски при подкислении раствора. Промежуточный продукт при синтезе КMnO4.
Уравнения важнейших реакций:
3K2MnO4(конц) +2H2O→(t) 2KMnO4+MnO2↓+4KOH
3K2MnO4(разб)+4HCl=2KMnO4+MnO2↓+2H2O+4KCl
K2 MnO4 +8HCl(конц)=MnCl2+2Cl2↑+4H2O+2KCl
3K2MnO4+2H2O+4CO2(г)=2KMnO4+MnO2↓+4KHCO3
2K2 MnO4+Cl2(насыщ)=2KMnO4+2KCl
2K2MnO4+2H2O→ H2↑+2KMnO4+KOH (эликтролиз)
Получение: сплавление МnO2 с сильными окислителями (KNO3, КClO3).
Перманганат калия КМnO4. Оксосоль. Красно-фиолетовый (почти черный). При нагревании разлагается без плавления. Умеренно растворим в воде (интенсивно-фиолетовая окраска раствора отвечает иону МnO4), гидролиза нет. Медленно разлагается в воде, серной кислоте, щелочах. Сильный окислитель в растворе и при сплавлении; в сильнокислотной среде восстанавливается до МnII, в нейтральной среде – до Mn IV в сильнощелочной среде — до МnVI
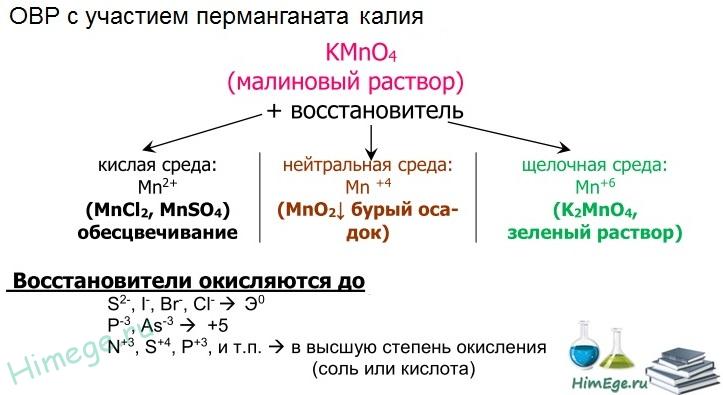
Качественная реакция на ион МnO4 — исчезновение фиолетовой окраски раствора при восстановлении в кислотной среде.
Применяется как окислитель углеводородов до карбоновых кислот, реактив в фотографии, антисептик в медицине, средство для очистки газов и отбеливания тканей, твердый источник кислорода. Распространенный окислитель в лабораторной практике. Уравнения важнейших реакций:
2КMnO4= К2MnO4 + МnO2 + O2 (200—240°С)
4КМnO4 + 2Н2O→МnO2↓+ 3O2↑ + 4КОН (t)
2КМnO4(т) + 16НСl(конц.) = 2МnС12 + 5С12↑ + 8Н2O + 2КС1 (80°С)
2КМnO4(т) + 2Н2SO4 (96%) = 2КНSO4 + Мn2O7 + Н2O (на холоду)
4КМnO4 (насыщ.) + 4КОН (15%) = 4К2МnO4+ O2↑ + 2Н2O (100 °С)
2КМnO4 + 2(NН3• Н2O)= 2МnO2↓ + N2↑ + 4Н2O+ 2КОН (50 °С)
2МnO4— + 16Н+ +10I— = 5I2+2Мn2+ + 8Н2O
2МnO4— + 6Н+ + 5Н2O2 (разб.) = 2Мn2+ + 5O2↑+ 8Н2O
2МnO4— + 6Н+ + 5SO32- =2Мn2+ + 5SO42- + ЗН2O
МnO4— + 8Н+ + 5Fе2+ = Мn2+ + 5Fе3+ + 4Н2O
2МnO4— + 6Н+ + 5NO2— = 2Мn2+ + 5NО3— + 3Н2O
2МnO4— + 3Н2S (насыщ.) = 2МnO2↓ + 3S↓ + 2Н2O + 2OН—
2МnO4— + Н2O + 3SO32- = 2МnO2↓ + 3SO42-+ 2OH—
2МnO4— + 2Н2O + ЗМn2+ = 5МnO2↓ + 4Н+ (50-80 °С)
2МnO4— + 2OH— (конц.) + SO32- = 2МnO42-+ SO42- + Н2O
Получение — электролиз раствора К2MnO4